利用SSH方法筛选与鉴定AC3基因缺失小鼠主要嗅觉表皮内的差异表达基因
曹振龙, 郝江叶, 周艳芬,2, 张喆, 倪志华, 胡远想, 刘伟丽, 李永超, Daniel R. Storm, 马润林, 王振山,2
1. 河北大学生命科学学院, 保定 071002;
2. 河北省生物工程技术研究中心, 保定 071002;
3. 河北大学基础医学院, 保定 071002;
4. 中国科学院遗传与发育生物学研究所, 北京 100101;
5. Department of Pharmacology, University of Washington, Seattle, WA 98195
利用SSH方法筛选与鉴定AC3基因缺失小鼠主要嗅觉表皮内的差异表达基因
曹振龙1, 郝江叶1, 周艳芬1,2, 张喆3, 倪志华1, 胡远想3, 刘伟丽3, 李永超4, Daniel R. Storm5, 马润林4, 王振山1,2
1. 河北大学生命科学学院, 保定 071002;
2. 河北省生物工程技术研究中心, 保定 071002;
3. 河北大学基础医学院, 保定 071002;
4. 中国科学院遗传与发育生物学研究所, 北京 100101;
5. Department of Pharmacology, University of Washington, Seattle, WA 98195
腺苷酸环化酶3(Adenylate cyclase 3, AC3)基因在小鼠主要嗅觉表皮(Main olfactory epithelium, MOE)内的嗅觉信号传导中起着重要作用, AC3缺失是否会导致MOE内与之相关的基因发生差异表达, 尚待确定。文章利用抑制性消减杂交(Suppression subtractive hybridization, SSH)方法, 以AC3敲除(AC3-/-)及其同窝出生的野生型(AC3+/+)小鼠MOE为材料, 构建了正向和反向两个消减文库, 采用斑点杂交对消减文库进行初步筛选, 对筛选出的差异表达基因进行序列测定及生物信息学分析, 并利用荧光定量PCR(qRT-PCR)方法对其进行验证。斑点杂交筛选获得了386个差异表达克隆, 随机选取其中的80个进行DNA序列测定, 经序列比对后发现有62个在GenBank上获得了与之相匹配的基因信息, 其中24个上调差异表达克隆对应于kcnk3、mapk7、megf11等基因, 38个下调差异表达克隆对应于tmem88b、c-mip、skp1a、mlycd等基因。利用Gene Ontology(GO)方法对这些差异表达基因进行蛋白功能注释, 发现它们主要集中在分子结合、细胞周期、生物和细胞过程等功能方面。选取其中上调基因kcnk3和下调基因c-mip、mlycd、tmem88b及trappc5进行qRT-PCR验证。结果表明, 在AC3-/-小鼠MOE内kcnk3的表达量显著上调, 是对照组小鼠的1.27倍, 而c-mip、mlycd、tmem88b和trappc5的表达量显著下调, 为对照组小鼠的20%、7%、32%和29%。这些基因的功能与K+通道、细胞发育与分化、脂肪代谢和膜蛋白转运等密切相关。推测它们可能与AC3基因共同作用, 调节小鼠MOE内的嗅觉信号传导信息。
腺苷酸环化酶3; 主要嗅觉表皮; 差异表达基因; 抑制性消减杂交
嗅觉在动物乃至人类的生命活动中具有重要作用。哺乳动物的嗅觉感知是由两个解剖和功能上相互独立的器官介导的, 即主要嗅觉表皮(Main olfactory epithelium, MOE)和犁鼻器 (Vomeronasal organ, VNO)。MOE的主要功能是感受挥发性化学信号, 识别种内不同个体的社会地位; VNO的主要功能是感受信息素, 控制生殖及其相关行为[1,2]。单磷酸环化腺苷酸(cAMP)通路是MOE组织内主要的嗅觉信号传导通路, 由 Golf蛋白[3]、腺苷酸环化酶 3(AC3)[4]和环核苷酸门控离子通道(CNG channel)[5]等组成。研究发现, 敲除AC3基因的小鼠(AC3-/-)嗅觉功能丧失[4], 并且在雄性攻击、母性关爱、体重、学习与记忆和生殖能力等诸多方面均受到影响[6~9]。
小鼠基因组内有 1000个以上的嗅觉受体基因(Olfactory receptor, OR)[10]表达于MOE组织内的嗅觉神经细胞, 绝大多数嗅觉神经细胞使用单一cAMP信号传导通路来感知气味分子。生物体内每一个基因的表达都是网络调控的结果。在MOE组织内, 敲除AC3基因后是否会导致相关基因表达发生改变, 尚未见报道。抑制性消减杂交技术(Suppression subtractive hybridization, SSH)是筛选差异表达基因的快捷有效方法[11], 被广泛应用于多个领域的研究。
本研究利用 SSH方法, 以来源于 AC3-/-和其同窝出生的野生型小鼠MOE组织为材料, 构建了正向和反向消减杂交文库, 运用斑点杂交、DNA测序、荧光定量 PCR(qRT-PCR)等技术, 对文库进行初步筛选与鉴定, 筛选出多个在MOE组织内受AC3调控的差异表达基因, 为进一步深入了解嗅觉信号传导机制奠定了初步基础。
1 材料和方法
1.1 小鼠基因型鉴定、总RNA提取及cDNA合成
本研究所使用的 AC3+/-(C57BL/6J)小鼠从美国华盛顿大学(西雅图分校)Daniel.R. Storm 实验室引进, 并饲养于河北大学标准动物房。后代小鼠基因型按照文献使用的PCR方法进行鉴定[12]。小鼠脱臼处死后, 外科手术取出MOE立即置于RNA Later中,按照 TRIzol(Invitrogen)法提取总 RNA, NanoDrop (Thermo)、琼脂糖凝胶电泳检测合格后-80℃保存备用。按照SMARTer PCR cDNA Synthesis Kit(Clontech)反转录成 cDNA。实验动物的所有处理方法和操作程序均符合中华人民共和国科学技术部颁发的《关于善待实验动物的指导性意见》, 并得到河北大学动物伦理及关爱委员会的批准。
1.2 抑制性消减杂交与文库构建
以来源于 AC3-/-小鼠的 cDNA 作为测试子(Tester)、AC3+/+的cDNA 作为驱动子(Driver), 进行正向消减杂交; AC3+/+小鼠cDNA作为测试子、AC3-/-的cDNA作为驱动子, 进行反向消减杂交。参照PCR Select cDNA Substraction Kit(Clontech)说明书, cDNA用 RsaⅠ酶切后, 测试子分别连接两种接头,与过量驱动子进行两次杂交, 杂交产物采用巢式PCR扩增。每一过程以及最后的消减杂交效率均进行检测验证。将正向、反向消减杂交第二次PCR扩增产物各3 μL与pESAY-T1(Transgen Biotech, 北京)连接, 转化到大肠杆菌DH5α, 挑选阳性克隆并接种到含有氨苄青霉素(Amp+)LB液体培养基的96孔微孔板内进行扩大培养。
1.3 斑点杂交(Dot blot)
将扩大培养的阳性克隆菌液进行PCR扩增, 分别取 1 μL PCR产物点到两张带正电荷的尼龙膜(Amersham, 瑞典)的同一位置, 紫外交联(UVP, 美国)固定。以 SSH实验过程中未经过消减杂交的AC3-/-和AC3+/+cDNA样品为模板, 随机引物法合成地高辛(DIG)标记的正向探针和反向探针(Roche, 瑞士), 按照DIG Labeling and Detection kit(Roche, 瑞士)说明书进行Dot blot杂交, NBT/BCIP显色后用扫描仪(惠普)扫描成像。对比同一克隆在正向、反向探针杂交后显色程度的不同, 筛选出差异表达克隆。DNA测序由华大基因科技有限公司(北京)完成。获得的序列在 NCBI上进行 BLASTX比对后, 用AmiGO和 IntroPro网站进行蛋白功能注释, 并在WeGO网站进行统计分析。
1.4 qRT-PCR
根据BLAST分析结果, 选择5个差异表达基因kcnk3、c-mip、mlycd、tmem88b和 trappc5, 进行qRT-PCR, 检测它们在不同个体 AC3-/-(n=3)和AC3+/+小鼠(n=3)中的相对表达量(引物序列见表1)。
以小鼠MOE组织反转录(TaKaRa, 日本)后的单链cDNA为模板, 使用SYBR荧光染料, 高效PCR酶(Transgen Biotech, 北京)进行 qRT-PCR扩增, 用β-actin为内参。利用 2-ΔΔct分析方法[13]并结合SPSS19.0软件对qRT-PCR扩增结果进行统计分析。

表1 差异表达及内参基因引物序列
2 结果与分析
2.1 消减杂交效率分析及差异表达基因片段的富集
为了筛选MOE内受AC3调控的差异表达基因,以AC3-/-和AC3+/+小鼠MOE mRNA反转录的cDNA互为测试子和驱动子, 进行双向消减杂交。从图1A可以看出, 带接头的内参基因量(A1、A2)是全部内参基因量(G1和G2)的1/4以上, 说明cDNA已与不同的接头高效连接, 证明了消减杂交的有效性。对照组第二次PCR产物电泳显示, 掺入的目的片段得到了有效富集(图 1D), 经过消减杂交后的样品掺入片段清晰显示在电泳图中(S-C), 与未经过消减杂交样品相比有更少的弥散条带和更清晰的目的条带。同样, 正向、反向消减杂交后第二次PCR产物电泳显示出较多特异条带、较少的弥散(图1:B, C), 说明差异表达基因的 cDNA片段得到有效富集。以GAPDH为参照基因对消减杂交效率进行PCR法检测。结果表明:正向消减组GAPDH基因PCR产物在消减和未消减样品之间有15个循环数的差异, 而反向消减组GAPDH基因PCR产物有10个循环数的差异(图2)。无论是正向还是反向消减杂交, 常量表达的 GAPDH基因均被大幅度扣除, 说明通过消减杂交非差异表达基因得到了有效扣除。
2.2 消减文库的构建及差异表达克隆的筛选
将消减杂交富集的差异表达基因片段与T载体连接, 分别构建正向和反向消减杂交文库, 共获得3 958个阳性克隆, 将其在96孔板中扩大培养。每96孔板随机选取8个阳性克隆用M13F和M13R引物进行PCR扩增, 电泳结果显示这8个克隆均能扩增100 bp以上的目的片段(电泳图未给出), 说明挑选的阳性克隆高效携带目的片段。将消减杂交文库用DIG标记的正向和反向未消减cDNA探针(浓度均为1000 ng/mL)进行Dot blot杂交, NBT/BCIP显色, 根据杂交后斑点的大小及显色深浅(图3), 初步筛选出386个克隆在AC3-/-和AC3+/+基因型小鼠之间的差异表达, 其中172个为上调表达, 214个为下调表达。
2.3 差异表达克隆测序及生物信息学分析
从 386个差异表达克隆中随机选取 80个进行DNA测序, 序列经NCBI数据库比对后获取相应的基因信息。结果显示24个上调克隆中有6个对应于kcnk3基因, 3个分别对应于mapk7、megf11基因; 38个下调克隆中有8个对应于tmem88b基因, 4个分别对应于c-mip基因和skp1a, 3个对应于mlycd基因(表2, 表 3), 其余基因相对应的差异表达克隆数为 1~2个。为了进一步分析这些差异表达基因的功能, 将这些基因序列上传到AmiGO和IntroPro网站进行蛋白功能注释, 返回数据汇总后在 WeGo网站进行统计分析。发现这些差异表达基因的功能主要集中在分子结合、细胞周期、生物和细胞过程等方面, 上调差异表达基因以分子结合功能最多, 下调表达差异基因以细胞过程最多(图4)。
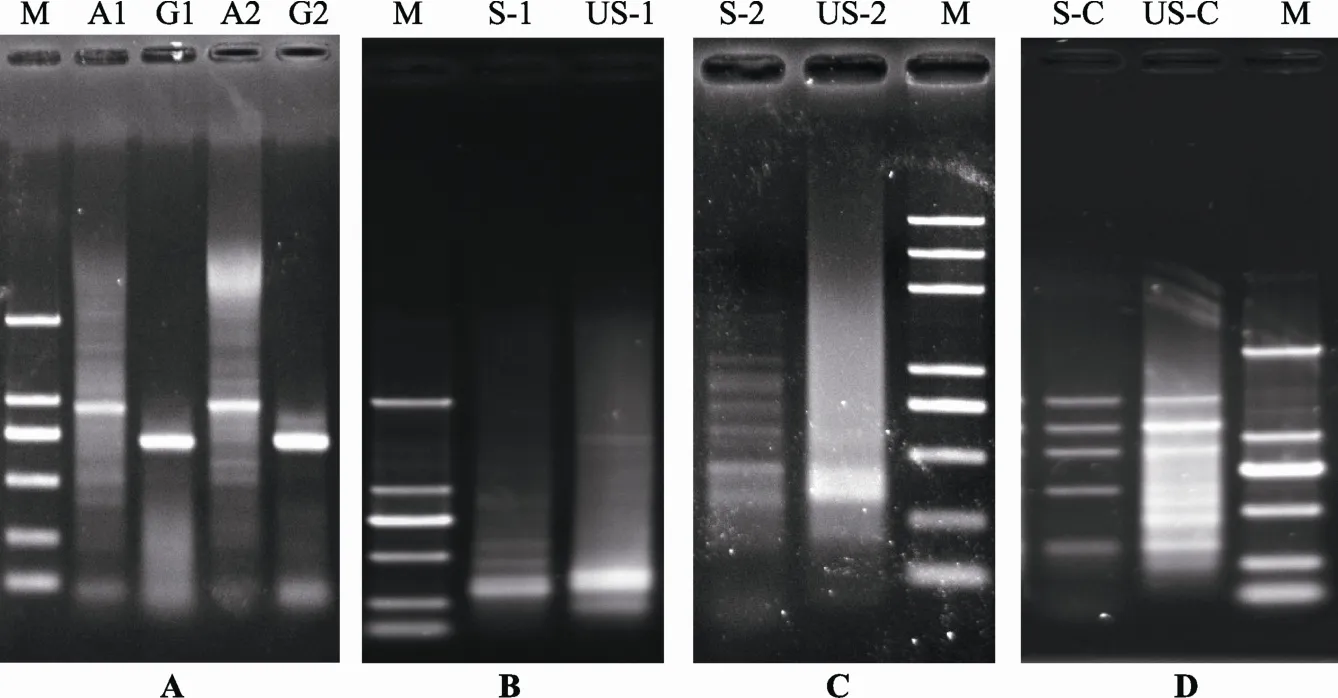
图1 抑制性消减杂交过程验证结果A:接头连接效率检测。A1(Adaptor1, 接头1)与G1(GAPDH-A1组)检测A1与RsaⅠ酶切后cDNA片段的连接效率, A2(Adaptor2R, 接头2R)与G2(GAPDH-A2组)检测接头2R与RsaⅠ酶切后cDNA片段的连接效率; 图中显示连接效率均大于1/4。B、C、D:正向、反向和对照组消减后(Substracted, S)与未消减(Unsubstracted, US)样品第二次PCR电泳结果, 消减后(S-1、S-2、S-C)比未消减样品(US-1、US-2、US-C)均有较少弥散和较多扩增条带, 表明正向和反向消减杂交效果明显。

图2 正反向消减杂交效率检测结果利用内参基因 GAPDH对正向、反向消减杂交效率进行检测, GAPDH基因在正向消减杂交效率检测中有15个循环的差异, 在反向消减杂交效率检测中有10个循环的差异, 表明消减杂交成功。

图3 正向和反向DIG标记探针斑点杂交结果A:正向未消减的 US-1探针杂交结果; B:反向未消减的 US-2探针杂交结果。通过比较相同位置斑点杂交结果鉴别差异表达克隆(箭头所示)。

表2 上调差异表达基因BLAST结果

表3 下调差异表达基因BLAST结果

图4 差异表达基因功能注释结果A:上调差异表达基因功能注释后WeGO统计结果; B:下调差异表达基因功能注释后WeGO统计结果。
3.4 差异表达基因相对表达量分析
为了进一步检测筛选出的受AC3调控的基因在AC3-/-和AC3+/+小鼠MOE中相对表达量是否存在差异, 随机选取kcnk3、c-mip、mlycd、tmem88b、trappc5基因进行qRT-PCR分析。从图5中可以看出, kcnk3基因qRT-PCR结果呈明显上升趋势, 相对表达量为野生型小鼠的 1.27倍, C-mip、mlycd、tmem88b和trappc5基因qRT-PCR结果则呈明显下调趋势, 相对表达量分别为野生型小鼠的20%、7%、32%和29%,而且差异显著(P<0.05)。这些结果表明, 选取的5个基因qRT-PCR检测的相对表达量分别与斑点杂交筛选结果相一致。

图5 差异表达基因qRT-PCR结果以 AC3+/+小鼠(n=3)为对照, AC3-/-小鼠(n=3)MOE内各个基因相对表达量, *表示显著差异(P<0.05)。
3 讨 论
AC3基因在小鼠的嗅觉活动中起着重要作用,它的缺失不仅引起小鼠嗅觉探测丧失及相关行为失常, 还会导致MOE内cAMP和IP3信号通路异常[4]。然而小鼠 MOE中该基因缺失后是否影响相关基因网络群体的表达, 尚待确定。本文目的是利用 SSH方法和基因敲除小鼠筛选与鉴定MOE内受AC3调控的相关差异表达基因。
SSH方法是建立在抑制性杂交和选择性PCR基础上的差异表达基因筛选手段[14], 由于其高效和低假阳性等特点, 广泛应用在动物[15,16]、植物[17]、人类[18]及癌症[19]等研究领域。Tan等[20]在高血糖发病研究中, 利用 SSH 方法发现丙酮酸羧激酶(Phosphoenolpyruvatecarboxykinase, PEPCK)和胆固醇O-乙酰基转移酶(Sterol O-acyltransferase, SOAT2)两个基因与葡萄糖激酶(Glucokinase, GCK)代谢紧密相关, 并利用 qRT-PCR对其进行了验证; 在进行GCK对肾脏功能影响研究时筛选到谷胱甘肽过氧化物酶 3(Glutathione peroxidase-3, GPX3)基因表达发生改变, 并且 GPX3可作为肾脏损伤初期的标记物[21]。Wang等[22]利用 SSH 方法鉴定出旋毛虫(T. spiralis)肌肉期幼虫与肠道期幼虫的9个差异表达基因(Ts7、Ts8、Ts11、Ts17、Ts19、Ts22、Ts23、Ts26、Ts33), 对旋毛虫肌肉期幼虫转变成肠道期幼虫的相关机理进行了阐述。本文利用SSH方法对小鼠MOE内受AC3调控的差异表达基因进行了筛选, 获得了kcnk3、mapk7、megf11、c-mip、skp1a、mlycd、tmem88b、trappc5、ppat、ssr3等差异表达基因(表 2, 表 3)。这些基因分别与K+通道[23]、胞外信号调控[24]、胞内蛋白泛素化因子[25]、胞内蛋白转膜与运输[26,27]等生物学功能相关。本研究对其中的kcnk3、c-mip、mlycd、 tmem88b和trappc5基因进行了qRT-PCR验证, 证实kcnk3基因在AC3-/-小鼠MOE(相对于野生型小鼠)显著上调表达, 而其余4个基因则显著下调表达。
kcnk3为 K+通道的重要成分[28], 它在神经系统中起着重要作用[29]。有研究表明, 腺苷酸环化酶激活肽对 Kv1.4和 Kv4.2有抑制作用[30], 而本文检测到kcnk3呈上调表达, 推测AC3可能对K+通道具有负向调节作用, 或者cAMP信号通路与K+通道之间存在交叉对话。另有研究显示, kcnk3在蛋白激酶C(PKC)的介导下参与内吞过程[19], 在细胞与外界交流中发挥作用。C-mip通过 c-maf参与 IL-2R及JAK/STAT信号通路的调控[31,32], 在细胞的发育与分化中起着重要作用。此外, C-mip的上调表达还与膜性肾病密切相关[33], 进而影响肾脏小球发育。C-mip也能下调 NF-κB活性, 促进足细胞的凋亡[34]。C-mip还与 p85协同参与免疫系统发育过程[35]。AC3基因是否通过c-mip影响MOE内嗅觉神经细胞的发育与分化, 尚待确定。本文检测到与脂肪酸代谢相关的 mlycd(MCD)基因在 AC3-/-小鼠MOE内呈下调表达。MCD是乙酰辅酶A形成过程中的有效抑制物, MCD表达量降低会使乙酰辅酶A在细胞内含量发生变化[36~38], 最终影响 MOE内脂肪酸及能量代谢。MCD缺失患者纤维母细胞线粒体脂肪酸代谢异常[39], 影响脂肪酸的生物合成。在缺失AC3基因的小鼠MOE内, MCD如何对嗅觉或者嗅觉神经细胞发育和代谢等产生影响, 尚待明确。转膜蛋白基因tmem88b和trappc5被认为与胞内蛋白转膜和运输相关[27,40], 本文中它们的表达量在AC3-/-小鼠 MOE 内显著下调。Tmem88 是Wnt/β-catenin信号通路中的散乱(Dishevelled- binding protein)结合蛋白, RNAi干扰 tmem88能激活Wnt/β-catenin信号。Tmem88作为心肌细胞 GATA因子的下游调控元素调节心肌细胞的发育[41], 还与非小细胞肺癌调控有关[42]。Trappc5与其他因子形成蛋白转运颗粒参与蛋白质胞内转 运[43]。小鼠 MOE内的 1000多个嗅觉受体均为跨膜蛋白, AC3-/-小鼠MOE内tmem88b和trappc5表达量显著降低, 有可能影响嗅觉受体蛋白的合成或运输, 进而导致嗅觉探测及相关行为缺陷。嗅觉受体蛋白质合成也与能量代谢密切相关, 本研究发现 MCD基因表达量在AC3-/-小鼠 MOE内明显下调, 这可能是嗅觉受体蛋白合成或分泌受到能量代谢与转运的影响, 以及多个离子通道失调等综合原因, 导致 AC3-/-小鼠嗅觉功能丧失[4]。
虽然AC3基因缺失对小鼠MOE产生多方面的影响, 但是 MOE内参与其他信号通路(cGMP[44]、IP3[45])的相关基因在本文中并未检测出。究其原因:(1)AC3+/+和 AC3-/-基因型小鼠之间仅有一个基因的差异, 它们之间遗传背景差异较小; (2)与鸟类等研究中筛选出16 512个差异表达克隆相比较[15], 本文在386个差异表达克隆中随机挑取80个进行测序分析, 规模较小, 有可能 cGMP和 IP3信号通路的相关基因未包括在内; (3)SSH实验材料是通过PCR扩增获得的, 整个过程包括多次酚:氯仿抽提, 这些过程可能会使部分基因丢失。
嗅觉活动对于动物的生存和我们人类的健康具有至关重要的作用, 但关于其嗅觉神经信号传导分子机制的了解, 还十分有限。本研究以基因敲除小鼠为材料, 利用 SSH方法成功构建了 AC3-/-小鼠MOE组织正向和反向两个消减文库, 并对文库进行了筛选、分析与鉴定。发现所筛选出的差异表达基因与K+通道、细胞发育与分化、脂肪酸代谢和胞内蛋白转运等重要生物学过程相关。可能是这些基因共同作用结果, 导致AC3敲除后小鼠嗅觉及其相关行为表现功能缺陷。本研究结果为阐明AC3对小鼠嗅觉功能及相关行为的分子调控机制提供了一定的数据积累。
[1] Restrepo D, Arellano J, Oliva AM, Schaefer ML, Lin W. Emerging views on the distinct but related roles of the main and accessory olfactory systems in responsiveness to chemosensory signals in mice. Horm Behav, 2004, 46(3): 247–256.
[2] Wang ZS, Nudelman A, Storm DR. Are pheromones detected through the main olfactory epithelium? Mol Neurobiol, 2007, 35(3): 317–323.
[3] Belluscio L, Gold GH, Nemes A, Axel R. Mice deficient in G(olf) are anosmic. Neuron, 1998, 20(1): 69–81.
[4] Wong ST, Trinh K, Hacker B, Chan GC, Lowe G, Gaggar A, Xia Z, Gold GH, Storm DR. Disruption of the type III adenylyl cyclase gene leads to peripheral and behavioral anosmia in transgenic mice. Neuron, 2000, 27(3): 487–497.
[5] Brunet LJ, Gold GH, Ngai J. General anosmia caused by a targeted disruption of the mouse olfactory cyclic nucleotidegated cation channel. Neuron, 1996, 17(4): 681–693.
[6] Chen XM, Xia ZG, Storm DR. Stimulation of electroolfactogram responses in the main olfactory epithelia by airflow depends on the type 3 adenylyl cyclase. J Neurosci, 2012, 32(45): 15769–15778.
[7] Wang ZS, Li V, Chan GCK, Phan T, Nudelman AS, Xia ZQ, Storm DR. Adult type 3 adenylyl cyclase-deficient mice are obese. PLoS One, 2009, 4(9): e6979.
[8] Wang ZS, Storm DR. Maternal behavior is impaired in female mice lacking type 3 adenylyl cyclase. Neuropsychopharmacology, 2010, 36(4): 772–781.
[9] Wang ZS, Phan T, Storm DR. The type 3 adenylyl cyclase is required for novel object learning and extinction of contextual memory: role of cAMP signaling in primary cilia. J Neurosci, 2011, 31(15): 5557–5561.
[10] Zhang XM, Firestein S. The olfactory receptor gene superfamily of the mouse. Nat Neurosci, 2002, 5(2): 124–133.
[11] Diatchenko L, Lukyanov S, Lau YFC, Siebert PD. Suppression subtractive hybridization: a versatile method for identifying differentially expressed genes. Methods Enzymol, 1999, 303: 349–380.
[12] Wang ZS, Storm DR. Extraction of DNA from mouse tails. Biotechniques, 2006, 41(4): 410, 412.
[13] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods, 2001, 25(4): 402–408.
[14] Diatchenko L, Lau YF, Campbell AP, Chenchik A, Moqadam F, Huang B, Lukyanov S, Lukyanov K, Gurskaya N, Sverdlov ED, Siebert PD. Suppression subtractive hybridization: a method for generating differentially regulated or tissue-specific cDNA probes and libraries. Proc Natl Acad Sci USA, 1996, 93(12): 6025–6030.
[15] Wang ZS, Farmer K, Hill GE, Edwards SV. A cDNA macroarray approach to parasite-induced gene expression changes in a songbird host: genetic response of house finches to experimental infection by Mycoplasma gallisepticum. Mol Ecol, 2006, 15(5): 1263–1273.
[16] Saban MR, Hellmich HL, Simpson C, Davis CA, Lang ML, Ihnat MA, O'Donnell MA, Wu XR, Saban R. Repeated BCG treatment of mouse bladder selectively stimulates small GTPases and HLA antigens and inhibits singlespanning uroplakins. BMC Cancer, 2007, 7: 204.
[17] Sahebi M, Hanafi MM, Abdullah SNA, Rafii MY, Azizi P, Nejat N, Idris AS. Isolation and expression analysis of novel silicon absorption gene from roots of mangrove (Rhizophora apiculata) via suppression subtractive hybridiza-tion. Biomed Res Int, 2014, 2014: 971-985.
[18] Ni YH, Ji CB, Wang B, Qiu J, Wang JW, Guo XR. A Novel pro-adipogenesis factor abundant in adipose tissues and over-expressed in obesity acts upstream of PPARgamma and C/EBPalpha. J Bioenerg Biomembr, 2013, 45(3): 219–228.
[19] Mottaghi-Dastjerdi N, Soltany-Rezaee-Rad M, Sepehrizadeh Z, Roshandel G, Ebrahimifard F, Setayesh N. Genome expression analysis by suppression subtractive hybridization identified overexpression of Humanin, a target gene in gastric cancer chemoresistance. Daru, 2014, 22(1): 14.
[20] Xu W, Li H, Wang R, Lei Z, Mao YQ, Wang X, Zhang YZ, Guo TT, Song RJ, Zhang XJ, Jin L, Li ZX, Irwin DM, Niu G, Tan HR. Differential expression of genes associated with the progression of renal disease in the kidneys of liver-specific glucokinase gene knockout mice. Int J Mol Sci, 2013, 14(3): 6467–6486.
[21] Wang R, Gao H, Xu W, Li H, Mao YQ, Wang Y, Guo TT, Wang X, Song RJ, Li ZX, Irwin DM, Niu G, Tan HR. Differential expression of genes and changes in glucose metabolism in the liver of liver-specific glucokinase gene knockout mice. Gene, 2013, 516(2): 248–254.
[22] Ren HJ, Cui J, Yang W, Liu RD, Wang ZQ. Identification of differentially expressed genes of Trichinella spiralis larvae after exposure to host intestine milieu. PLoS ONE, 2013, 8(6): e67570.
[23] Goldstein SA, Bockenhauer D, O'Kelly I, Zilberberg N. Potassium leak channels and the KCNK family of two-P-domain subunits. Nat Rev Neurosci, 2001, 2(3): 175–184.
[24] Zhou G, Bao ZQ, Dixon JE. Components of a new human protein kinase signal transduction pathway. J Biol Chem, 1995, 270(21): 12665–12669.
[25] Fishman-Jacob T, Reznichenko L, Youdim MB, Mandel SA. A sporadic Parkinson disease model via silencing of the ubiquitin-proteasome/E3 ligase component SKP1A. J Biol Chem, 2009, 284(47): 32835–32845.
[26] Gabriel L, Lvov A, Orthodoxou D, Rittenhouse AR, Kobertz WR, Melikian HE. The acid-sensitive, anestheticactivated potassium leak channel, KCNK3, is regulated by 14–3-3beta-dependent, protein kinase C (PKC)-mediated endocytic trafficking. J Biol Chem, 2012, 287(39): 32354–32366.
[27] Scrivens PJ, Noueihed B, Shahrzad N, Hul S, Brunet S, Sacher M. C4orf41 and TTC-15 are mammalian TRAPP components with a role at an early stage in ER-to-Golgi trafficking. Mol Biol Cell, 2011, 22(12): 2083–2093.
[28] Talley EM, Solorzano G, Lei Q, Kim D, Bayliss DA. Cns distribution of members of the two-pore-domain (KCNK) potassium channel family. J Neurosci, 2001, 21(19): 7491–7505.
[29] Zuzarte M, Heusser K, Renigunta V, Schlichthörl G, Rinne S, Wischmeyer E, Daut J, Schwappach B, Preisig-Müller R. Intracellular traffic of the K+ channels TASK-1 and TASK-3: role of N- and C-terminal sorting signals and interaction with 14-3-3 proteins. J Physiol, 2009, 587(5): 929–952.
[30] Meyer DK, Fischer C, Becker U, Gottsching I, Boutillier S, Baermann C, Schmidt G, Klugbauer N, Leemhuis J. Pituitary adenylyl cyclase-activating polypeptide 38 reduces astroglial proliferation by inhibiting the GTPase RhoA. J Biol Chem, 2005, 280(26): 25258–25266.
[31] Grimbert P, Valanciute A, Audard V, Pawlak A, Le gouvelo S, Lang P, Niaudet P, Bensman A, Guellaën G, Sahali D. Truncation of C-mip (Tc-mip), a new proximal signaling protein, induces c-maf Th2 transcription factor and cytoskeleton reorganization. J Exp Med, 2003, 198(5): 797–807.
[32] Newbury DF, Winchester L, Addis L, Paracchini S, Buckingham LL, Clark A, Cohen W, Cowie H, Dworzynski K, Everitt A, Goodyer IM, Hennessy E, Kindley AD, Miller LL, Nasir J, O'Hare A, Shaw D, Simkin Z, Simonoff E, Slonims V, Watson J, Ragoussis J, Fisher SE, Seckl JR, Helms PJ, Bolton PF, Pickles A, Conti-Ramsden G, Baird G, Bishop DVM, Monaco AP. CMIP and ATP2C2 modulate phonological short-term memory in language impairment. Am J Hum Genet, 2009, 85(2): 264–272.
[33] Sendeyo K, Audard V, Zhang SY, Fan QF, Bouachi K, Ollero M, Rucker-Martin C, Gouadon E, Desvaux D, Bridoux F, Guellaën G, Ronco P, Lang P, Pawlak A, Sahali D. Upregulation of c-mip is closely related to podocyte dysfunction in membranous nephropathy. Kidney Int, 2013, 83(3): 414–425.
[34] Ory V, Fan QF, Hamdaoui N, Zhang SY, Desvaux D, Audard V, Candelier M, Noel LH, Lang P, Guellaen G, Pawlak A, Sahali D. C-mip down-regulates NF-kB activity and promotes apoptosis in podocytes. Am J Pathol, 2012, 180(6): 2284–2292.
[35] Kamal M, Pawlak A, BenMohamed F, Valanciute A, Dahan K, Candelier M, Lang P, Guellaën G, Sahali D. C-mip interacts with the p85 subunit of PI3 kinase and exerts a dual effect on ERK signaling via the recruitment of Dip1 and DAP kinase. FEBS Lett, 2010, 584(3): 500–506.
[36] Dyck JR, Barr AJ, Barr RL, Kolattukudy PE, Lopaschuk GD. Characterization of cardiac malonyl-CoA decarboxylaseand its putative role in regulating fatty acid oxidation. Am J Physiol, 1998, 275(6 Pt 2): H2122–H2129.
[37] Kudo N, Barr AJ, Barr RL, Desai S, Lopaschuk GD. High rates of fatty acid oxidation during reperfusion of ischemic hearts are associated with a decrease in malonyl-CoA levels due to an increase in 5′-AMP-activated protein kinase inhibition of acetyl-CoA carboxylase. J Biol Chem, 1995, 270(29): 17513–17520.
[38] Park H, Kaushik VK, Constant S, Prentki M, Przybytkowski E, Ruderman NB, Saha AK. Coordinate regulation of malonyl-CoA decarboxylase, sn-glycerol-3-phosphate acyltransferase, and acetyl-CoA carboxylase by AMP-activated protein kinase in rat tissues in response to exercise. J Biol Chem, 2002, 277(36): 32571–32577.
[39] Bennett MJ, Harthcock PA, Boriack RL, Cohen JC. Impaired mitochondrial fatty acid oxidative flux in fibroblasts from a patient with malonyl-CoA decarboxylase deficiency. Mol Genet Metab, 2001, 73(3): 276–279.
[40] Rasche S, Toetter B, Adler J, Tschapek A, Doerner JF, Kurtenbach S, Hatt H, Meyer H, Warscheid B, Neuhaus EM. Tmem16b is specifically expressed in the cilia of olfactory sensory neurons. Chemical Senses, 2010, 35(3): 239–245.
[41] Lee HJ, Finkelstein D, Li X, Wu D, Shi DL, Zheng JJ. Identification of transmembrane protein 88 (TMEM88) as a dishevelled-binding protein. J Biol Chem, 2010, 285(53): 41549–41556.
[42] Stewart DJ. Wnt signaling pathway in non-small cell lung cancer. J Natl Cancer Inst, 2014, 106(1): djt356.
[43] Kummel D, Müller JJ, Roske Y, Misselwitz R, Büssow K, Heinemann U. The structure of the TRAPP subunit TPC6 suggests a model for a TRAPP subcomplex. EMBO Rep, 2005, 6(8): 787–793.
[44] Juilfs DM, Fülle HJ, Zhao AZ, Houslay MD, Garbers DL, Beavo JA. A subset of olfactory neurons that selectively express cGMP-stimulated phosphodiesterase (PDE2) and guanylyl cyclase-D define a unique olfactory signal transduction pathway. Proc Natl Acad Sci USA, 1997, 94(7): 3388–3395.
[45] Chen S, Lane AP, Bock R, Leinders-Zufall T, Zufall F. Blocking adenylyl cyclase inhibits olfactory generator currents induced by "IP(3)-odors". J Neurophysiol, 2000, 84(1): 575–580
(责任编委:史庆华)
Differentially expressed genes identified in the main olfactory epithelium of mice with deficiency of adenylate cyclase 3 by using suppression subtractive hybridization approach
Zhenlong Cao1, Jiangye Hao1, Yanfen Zhou1,2, Zhe Zhang3, Zhihua Ni1, Yuanxiang Hu3, Weili Liu3, Yongchao Li4, Daniel R. Storm5, Runlin Z. Ma4, Zhenshan Wang1,2
1. College of Life Science, Hebei University, Baoding 071002, China;
2. Research Center of Bioengineering of Hebei Province, Baoding 071002, China;
3. College of Basic Medicine, Hebei University, Baoding 071002, China;
4. Institute of Genetics and Developmental Biology, Chinese Academy of Sciences, Beijing 100101, China;
5. Department of Pharmacology, University of Washington, Seattle, WA 98195, USA
Adenylate cyclase 3 (AC3) is one of the major players in the olfactory signaling within the main olfactory epithelium (MOE) of mice. However, we are not ascertained whether deficiency of AC3 will lead to the differential expression of related genes in the MOE. Forward and reverse subtractive libraries were constructed by suppression subtractive hybridization (SSH) approach, with MOEs from AC3-/-and AC3+/+mice. These two libraries were primarily screened by Dot blot, differential expressed clones were sequenced and analyzed by bioinformatics, and differential expressed genes were verified by qRT-PCR. A total of 386 differentially expressed clones were picked out after Dot blot. The DNA sequences of 80 clones randomly selected were determined, and 62 clones were identified by blasting in GenBank. We found that 24 up-regulated clones were corresponded to genes of kcnk3, mapk7, megf11, and 38 down-regulated clones were corresponded to tmem88b, c-mip, skp1a, mlycd, etc. Their functions were annotated with Gene Ontology (GO) and found to be mainly focused on molecular binding, cell cycle, processes of biology and cells. Five genes (kcnk3, c-mip, mlycd, tmem88b and trappc5) were verified by qRT-PCR with individuals of AC3+/+and AC3-/-mice. The data indicate that kcnk3 gene is up-regulated significantly, increasing 1.27 folds compared to control mice, whereas c-mip, mlycd, tmem88b and trappc5 are down-regulated significantly, decreasing 20%, 7%, 32% and 29% compared to the AC3+/+mice. The functions of these genes are closely related with K+channels, cell differentiation, metabolism of fats, membrane transportation, and so on. It is tempting to speculate that these genes might work together with AC3 to orchestrate the olfactory transduction signaling in the MOE.
adenylate cyclase 3 (AC3); main olfactory epithelium (MOE); differentially expressed genes; suppression subtractive hybridization (SSH)
2013-11-24;
2014-01-16
国家自然科学基金项目(编号:31171191), 河北省自然科学基金项目(编号:C2012201106), 教育部留学人员回国启动基金项目(教外司留<2013>693号)和河北省生物工程重点学科经费资助
曹振龙, 硕士研究生, 专业方向:细胞分子生物学。E-mail: dafeizizhu@163.com
王振山, 教授, 博士生导师, 研究方向:动物行为遗传分子机制。E-mail: zswang@hbu.edu.cn
10.3724/SP.J.1005.2014.0574
时间: 2014-4-1 11:35:35
URL: http://www.cnki.net/kcms/detail/11.1913.R.20140401.1135.001.html

