高表达HER2的自发转移性乳腺癌小鼠模型的建立与应用
刘卉卉,胡思怡,沈国栋,张志辉,费保珍,刘 兢3,,胡世莲
(1.安徽医科大学附属省立医院老年病科,老年医学研究所,2.肿瘤免疫与营养治疗安徽省重点实验室,安徽合肥 230001;3.中国科学技术大学生命科学学院,安徽 合肥 230027;4.合肥瀚科迈博生物技术有限公司,安徽合肥 230088)
乳腺癌已成为全球女性发病率最高的恶性肿瘤,而乳腺癌转移是患者死亡的主要原因,有25%~40%的乳腺癌病人因为发生转移而最终无法治愈[1-3]。因此,建立合适的肿瘤转移动物模型对乳腺癌的治疗研究具有重要意义。据报道,高达40%乳腺癌患者存在表皮生长因子受体2(HER2/ErbB2/P185)过表达[4-5]。HER2蛋白是由 c-erbB2(her2/neu)基因编码的具有受体酪氨酸激酶(RTK)活性的跨膜糖蛋白,其过表达往往预示肿瘤易发生转移及预后不良[6]。由于HER2表达于肿瘤细胞的表面,而在成人正常组织中不表达或者仅有极低表达,使得它成为一个良好的药物靶点。第一个抗HER2人源化单克隆抗体药物曲妥珠单抗(Trastuzumab,商品名Herceptin)在10余年的临床治疗中展示了独特的功效,然而,还存在曲妥珠单药有效率低及大部分初始治疗有效的患者常在1年内产生耐药的现象[7-8]。因此,研究者们正在不断研究与开发新的针对HER2受体的肿瘤靶向治疗药物。
本实验室在国内较早开展了这方面工作,相继研发了鼠源单克隆抗体A21及基因工程人源化抗体chA21等[9-10]。为了评价抗体免疫治疗对乳腺癌细胞生长及转移的影响,我们将重组人源HER2全长基因转染小鼠乳腺癌细胞4T1-Luc,成功构建了高表达HER2及荧光素酶标记蛋白的4T1-Luc/HER2稳定转染细胞株。我们在裸鼠和BALB/c小鼠中初步研究了chA21和Trastuzumab抗体单用或联用对高表达HER2小鼠乳腺癌移植瘤生长和肿瘤转移的影响。
1 材料与方法
1.1 实验动物、细胞和质粒 裸鼠及BALB/c小鼠购于北京华阜康实验动物有限公司,SPF级,♀,4~5周龄,饲养于中国科技大学实验动物中心,按中国科技大学实验动物伦理委员会批准的方案进行实验。4T1-Luc小鼠乳腺癌细胞株由中国科学技术大学生命科学学院朱涛老师实验室惠赠。人乳腺癌细胞株BT-474(HER2过表达)购自美国ATCC。带有人源HER2全长基因的pMH3-HER2重组质粒为本室前期构建[11]。
1.2 试剂与药物 RPMI 1640培养基、胎牛血清购于Gibco公司;G418抗生素购于Amresco公司;荧光素酶底物(Sciencelight)和HER2兔多抗(Ab-1)为 Neomarkers公司产品;蛋白酶抑制剂Cocktail购自美国Roche公司;HRP标记羊抗兔抗体、FITC标记羊抗人抗体以及化学发光检测试剂购自美国Pierce公司;抗HER2抗体药物chA21为本课题组研制(批号111130);注射用曲妥珠单抗为购自美国Roche公司。
1.3 细胞转染及筛选 4T1-Luc细胞采用含10%胎牛血清的RPMI 1640培养基,37℃,5%CO2,饱和湿度培养。利用pMH3-HER2质粒,参照本实验室沈国栋等[11]方法转染4T1-Luc细胞,传代至96孔细胞培养板,加入1 g·L-1的G418持续加压筛选约10~15 d,挑取单克隆细胞株扩大培养并保种。
1.4 免疫印迹检测 胰酶消化收集细胞,加入RIPA裂解液(含蛋白酶抑制剂),冰上裂解30 min,离心15 000 r·min-110 min收集上清;取40μg总蛋白进行SDS-PAGE电泳,按常规免疫印迹方法检测,其中,抗HER2一抗稀释比例为1∶1 000,HRP标记羊抗兔的二抗稀释比例为1∶2 000。
1.5 流式细胞仪检测 胰酶消化收集细胞,加入冰冷的FACS缓冲液(PBS加入1%BSA)洗涤2次后,调整细胞浓度为1×109·L-1;取200μl细胞悬液加入2μg曲妥珠抗体,冰浴静置30 min;洗涤2次后,每管加入2μg FITC标记羊抗人二抗,冰浴晃动30 min;洗涤2次后,用200μl PBS重悬,用流式细胞仪上机检测(BD公司);结果用FlowJo7.6软件分析。
1.6 肿瘤模型建立与给药实验 将处于对数生长期的肿瘤细胞经胰酶消化后,PBS洗涤1次,调整活细胞浓度为5×108·L-1,取0.1 ml细胞悬液接种于裸鼠和BALB/c小鼠左侧乳房垫内。每周2次用游标卡尺测量肿瘤长径(L)和短径(W),肿瘤体积(tumor volume)计算公式为:TV=0.5×L×W2。待肿瘤体积生长至约100 mm3,将荷瘤小鼠随机分成4组,分别给予PBS对照、chA21(30 mg·kg-1)、Trastuzumab(30 mg·kg-1)、chA21+Trastuzumab(各 15 mg·kg-1),每周2次静脉给药,连续给药21 d。抑瘤率计算公式为:(对照组瘤体积-治疗组瘤体积)/对照组瘤体积×100%。
1.7 活体动物成像仪检测 小鼠腹腔注射200μl体积的荧光素酶底物,剂量为150 mg·kg-1小鼠体重。15 min后,用麻醉机进行小鼠异氟烷麻醉,置于小动物活体成像仪(Xenogen公司)观察并拍照,曝光时间为5~10 s。必要时CO2处死小鼠并分离各个器官检测。
1.8 统计学处理 实验数据经SPSS 13.0统计软件处理,以x¯±s表示,使用方差分析方法分析两组之间差异是否有统计学意义。
2 结果
2.1 小鼠乳腺癌细胞系4T1-Luc荧光素酶表达测定 将野生型小鼠乳腺癌细胞系4T1和带有萤火虫荧光素酶基因的衍生细胞系4T1-Luc分别接种于3 cm培养皿中,待细胞贴壁后,加入适量荧光素酶底物,放入活体成像仪检测。结果显示,4T1阴性对照细胞没有发现任何荧光信号,4T1-Luc细胞则有比较均一和高强度的荧光信号(Fig 1),符合进行动物模型活体成像实验的要求。

Fig 1 Luciferase gene expression in 4T1-Luc cells by bioluminescence imaging technology
2.2 高表达HER2的小鼠乳腺癌稳转细胞株构建 用实验室前期构建的pMH3-HER2重组质粒转染4T1-Luc细胞,经G418加压筛选和单克隆化,获得20多个稳转细胞株克隆。以4T1-Luc细胞作为阴性对照,BT-474细胞作为阳性对照,采用Western blot方法鉴定稳转细胞株HER2总蛋白表达水平。结果如Fig 2所示,约16个细胞克隆表达不同程度的HER2蛋白,即HER2阳性细胞株。其中,8C10、4B10、2C6等克隆为HER2高度表达,表达水平与BT-474细胞相当;8B7、7B4等克隆为HER2中度表达。

Fig 2 HER2 expression level in 4T1-Luc stably transfected cells by Western blot
随后,以4T1-Luc细胞作为阴性对照,BT-474细胞作为阳性对照,采用FACS方法检测HER2阳性细胞株中细胞膜表面的HER2表达水平。FACS结果显示这些细胞株表面均有不同程度的HER2表达,其中8C10、4B10、2C6克隆HER2表达水平达到或接近于BT-474细胞,细胞未见分群,且HER2水平阳性的细胞比例达到99%以上(Fig 3)。在后续的体内实验结束时,我们将高表达HER2细胞株的小鼠移植瘤取出进行Western blot检测,结果证实肿瘤细胞HER2受体稳定高表达(数据未显示)。为方便研究,我们将HER2高表达的4T1-Luc稳转细胞株命名为4T1-Luc/HER2。
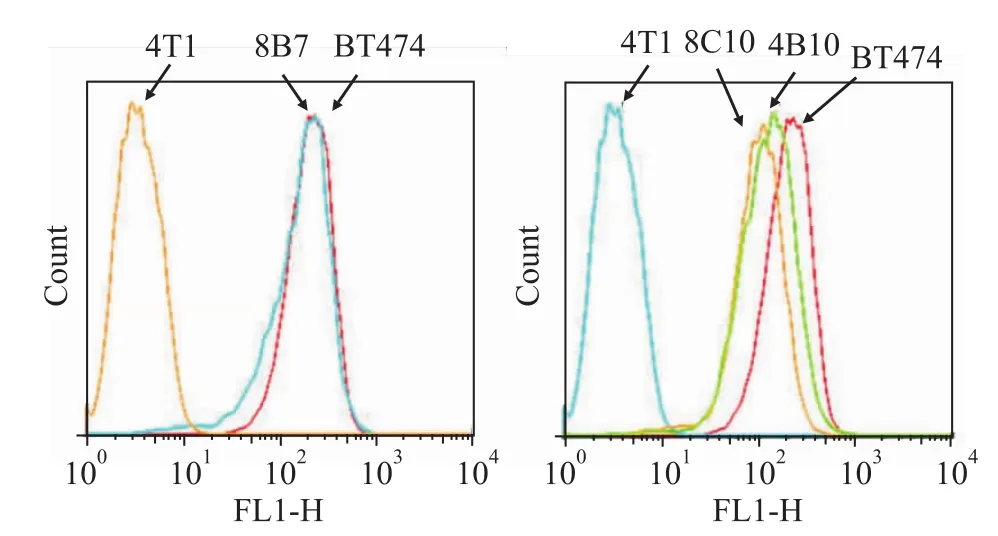
Fig 3 HER2 expression level on surface of 4T1-Luc stably transfected cells by FACS
2.3 小鼠乳腺癌稳转细胞株的生长和转移特性鉴定 选择4T1-Luc/HER2稳转细胞株克隆 8C10、4B10、2C6在不含有G418的培养基中扩大培养和计数,发现它们的体外增殖速度与野生型4T1-Luc细胞基本一致。将3个稳转细胞株分别接种5只BALB/c小鼠和裸鼠皮下乳房垫部位,构建原位移植瘤,每周2次测量肿瘤体积并作肿瘤生长曲线。结果显示,4T1-Luc/HER2细胞接种约1周后即可见明显的肿瘤形成,在BALB/c小鼠和裸鼠中成瘤率均为100%。而且4T1-Luc/HER2移植瘤生长速度较快,第3周末在BALB/c小鼠体内的肿瘤体积接近1 000 mm3,在裸鼠模型体内肿瘤体积超过1 000 mm3,但二者之间差异无统计学意义(P>0.05),见Fig 4。
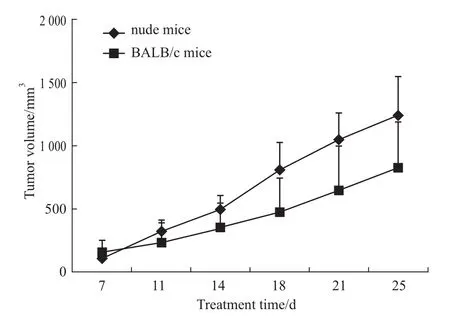
Fig 4 Tumor growth curve of 4T1-Luc/HER2 cells in mice
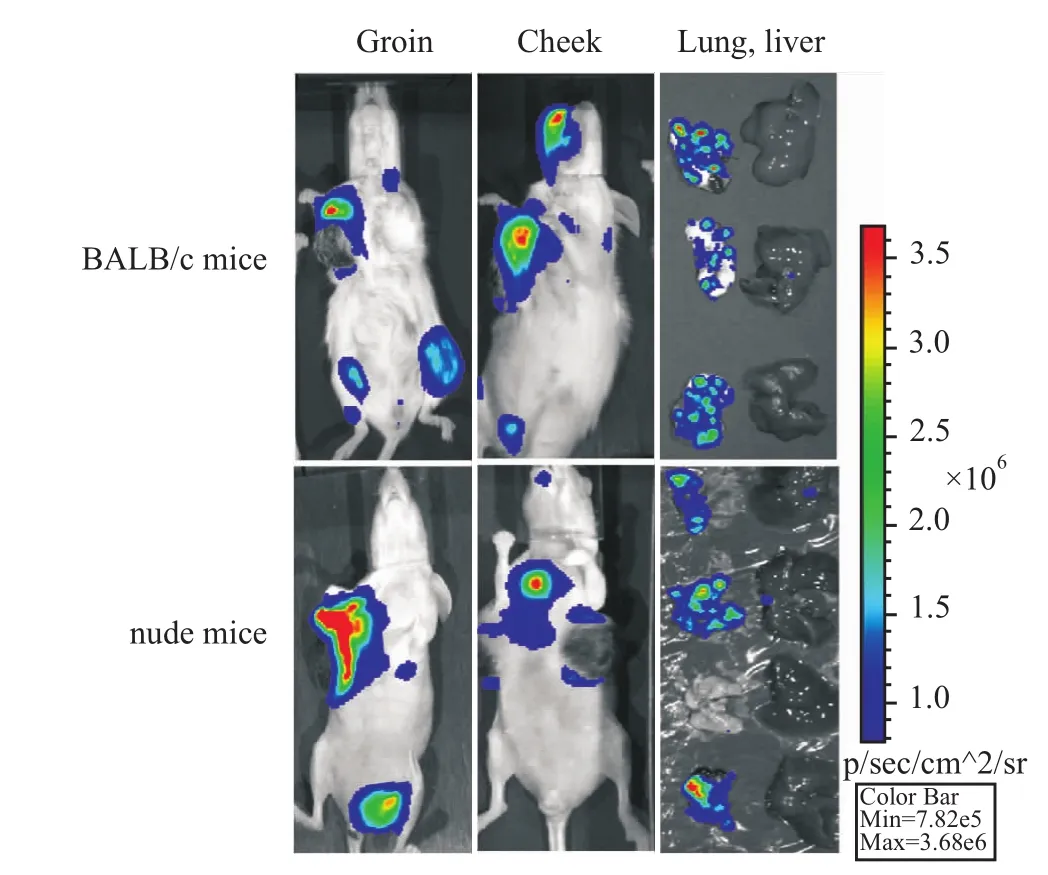
Fig 5 Tumor metastasis in BALB/c and nude mouse models by bioluminescence imaging technology
在4T1-Luc/HER2细胞接种小鼠30 d时,注射荧光素酶底物,并用活体成像仪观察肿瘤是否有转移现象。结果如Fig 5所示,除了肿瘤原发灶有很强的荧光信号,小鼠的肺、腹股沟与面部等部位出现不同程度的荧光信号,提示肿瘤细胞发生了转移。通过活体成像仪及病理解剖等手段,对BALB/c小鼠和裸鼠模型体内肿瘤转移部位及病灶数量进行统计与比较,结果显示,在BALB/c小鼠和裸鼠体内4T1-Luc/HER2转移情况相似,在肺部的转移率最高,约为93.3%;其次是腹股沟部位,约为27%;转移到面部的比率约为13%和7%(Tab 1)。而在小鼠心、肝、脾、肾、脑和股骨等器官与组织,未发现有明显的肿瘤转移。这些结果表明所筛选得到的4T1-Luc/HER2稳转细胞株具有较强的移植瘤形成和转移特性。

Tab 1 Metastasis organs and rates of 4T1-Luc/HER2 tumor
2.4 抗HER2抗体抑制肿瘤生长和转移的作用研究 为进一步考察抗HER2肿瘤靶向抗体药物对4T1-Luc/HER2肿瘤生长和转移的影响,我们选择体内成瘤率和转移能力均较强的克隆8C10,如上方法建立BALB/c小鼠和裸鼠移植瘤模型。在BALB/c小鼠接种细胞2周后,随机分为4组,分别给予 PBS对照、chA21(30 mg·kg-1)、Trastuzumab(30 mg·kg-1)、chA21+Trastuzumab(各15 mg·kg-1),每周 2次给药直至实验结束。实验结果见Fig 6,抗体单用组药效作用不明显,chA21组抑瘤率仅为11.1%,Trastuzumab组抑瘤率为23%,两组肿瘤体积与对照组相比差异均无显著性;抗体联用组则有明显药效,抑瘤率达43.3%,与对照组的差异有显著性(P<0.05)。以上结果提示,Trastuzumab与chA21抗体联用对BALB/c小鼠体内肿瘤生长的抑制作用具有明显的协同效应。同时,用小动物活体成像仪监测各组小鼠肿瘤转移情况,实验结束时处死小鼠,解剖观察肿瘤转移灶,结果显示,抗体联用组小鼠肺部出现的荧光强度和肿瘤转移灶的数目与对照组相比均有明显降低,但是抗体单用组与对照组之间无明显差异。另外,抗体单用和联用在裸鼠移植瘤模型体内均未见明显药效,肿瘤生长和转移情况基本未受影响(数据未显示),其机制尚有待进一步研究。
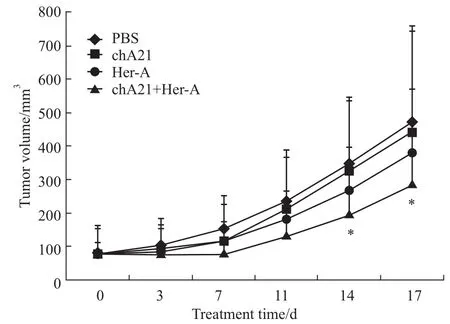
Fig 6 Effects of anti-HER2 antibodies on tumor growth in BALB/c mice*P<0.05 vs control.
3 讨论
HER2在乳腺癌、卵巢癌、胃癌等多种恶性肿瘤中存在过表达现象,且HER2过表达与肿瘤的高转移特性及治疗预后不良密切相关。HER2作为一个重要的肿瘤标志物分子,长期以来一直是抗肿瘤药物开发的热门靶点。建立合适的肿瘤动物模型不仅有助于研究乳腺癌生长和转移的分子机制,更有助于评价相关候选药物的药效学活性特点和作用机制。免疫缺陷小鼠模型是肿瘤治疗药物研究的常用模型,但是它不具备完整的免疫系统,对依赖于免疫杀伤效应的单克隆抗体等靶向药物的疗效评价存在明显的局限性。4T1细胞是BALB/c小鼠来源的乳腺癌细胞,具有快速生长和自发转移的特点,因此被广泛应用于肿瘤机制研究。由于4T1细胞仅表达极低水平的鼠源HER2蛋白,而且鼠源与人源HER2蛋白序列之间存在一定差异,因此,4T1小鼠乳腺癌模型无法准确评价针对人源HER2抗体治疗药物的免疫治疗效果。
近年来,已有国内外学者报道通过稳定转染人源HER2基因,成功构建了表达HER2蛋白的4T1乳腺癌细胞株用于各项研究[12-15]。但是,利用常规的重组蛋白表达载体(比如pCDNA3.1)或者病毒类载体构建的稳转细胞株并不能有效保证HER2处于高水平表达状态。因此,我们采用了一种新型表达载体pMH3用于HER2基因转染,该载体已经在多种哺乳动物细胞和肿瘤细胞中证明可以有效提高目的基因的表达水平[11,16]。结果表明,利用 pMH3-HER2质粒转染4T1-Luc细胞获得多个稳转细胞株克隆的HER2表达水平与人源乳腺癌BT-474细胞HER2水平相似,明显高于国内文献报道的HER2水平[15]。同时,由于该细胞表达荧光素酶基因,可采用活体成像技术实时监测肿瘤细胞在体内生长及转移情况,更直观地评价药物对肿瘤的治疗作用。
我们研究显示,4T1-Luc/HER2稳转细胞株表现出和野生型4T1细胞相似的体外生长和体内转移特性,提示它们的乳腺癌生物学特性未受影响。值得提出的是,我们发现4T1-Luc/HER2细胞在BALB/c小鼠中具有很强的成瘤性和肿瘤转移能力,该发现与大部分稳定转染人源HER2基因的4T1细胞的研究结果相似[12-13]。以上结果不同于 Rivera等[14]报道含有人源HER2基因的4T1细胞在BALB/c小鼠中不具备成瘤能力或者短暂成瘤后肿瘤消失现象。
体外实验显示,chA21和Trastuzumab两种抗体均不能抑制4T1-Luc/HER2细胞的增殖。体内研究发现,在BALB/c小鼠肿瘤模型中chA21与Trastuzumab抗体单用仅具有较弱的抗肿瘤生长和转移作用,抗体联用的药效作用明显提高,且具有协同效应。虽然裸鼠中含有NK细胞和巨噬细胞,可能通过抗体ADCC效应发挥免疫细胞介导的细胞毒作用。但是,我们在裸鼠中两种抗体单用或联用均未发现明显的抗肿瘤药效,说明裸鼠肿瘤模型对抗体药物研究的应用存在一定局限性。最新研究发现,抗HER2抗体药物的肿瘤治疗作用可能更多依赖于人体和动物中的固有免疫和适应性免疫应答[17]。因此,4T1-Luc/HER2小鼠肿瘤模型的成功建立对抗HER2肿瘤靶向药物的开发和作用机制研究具有重要意义。
参考文献:
[1] Guarneri V,Conte P.Metastatic breast cancer:therapeutic options according to molecular subtypes and prior adjuvant therapy[J].Oncologist,2009,14(7):645-56.
[2] DeSantis C,Siegel R,Bandi P,et al.Breast cancer statistics[J].CA Cancer J Clin,2011,61(6):409-18.
[3] Ni M,Chen Y,Lim E,et al.Targeting androgen receptor in estrogen receptor-negative breast cancer[J].Cancer cell,2011,20(1):119-31.
[4] Dittadi R,Gion M.More about:prognostic importance of low cerbB2 expression in breast tumors[J].J Natl Cancer Inst,2000,92(17):1443-4.
[5] Slamon D J,Clark G M,Wong SG,et al.Human breast cancer:correlation of relapse and survival with amplification of the HER2/neu oncogene[J].Science,1987,235(4785):177-82.
[6] Burstein H J.The distinctive nature of HER2-positive breast cancers[J].N Engl J Med,2005,53(16):1652-4.
[7] Nahta R,Yu D,Hung M C,et al.Mechanisms of disease:understanding resistance to HER2-targeted therapy in human breast cancer[J].Nat Clin Pract Oncol,2006,3(5):269-80.
[8] 沈国栋,刘 兢,宋礼华,等.抗HER2抗体曲妥珠单抗的耐药机制与展望[J].中国药理学通报,2010,26(8):981-5.
[8] Shen G D,Liu J,Song L H,et al.Mechanism and prospect of resistance to anti-ErbB2 antibody trastuzumab[J].Chin Pharmacol Bull,2010,26(8):981-5.
[9] Chen L S,Liu A P,Yang J H,et al.Construction,expression and characterization of the engineered antibody against tumor surface antigen,p185c-erbB-2[J].Cell Res,2003,13(1):35-48.
[10]Shen G,Huang H,Zhang A,et al.In vivo activity of novel anti-ErbB2 antibody chA21 alone and with Paclitaxel or Trastuzumab in breast and ovarian cancer xenograft models[J].Cancer Immunol Immunother,2011,60(3):339-48.
[11]沈国栋,査 昭,刘 兢,等.人乳腺癌细胞MCF-7/HER2稳转株裸鼠移植瘤模型的建立[J].中国药理学通报,2013,29(4):588-9.
[11]Shen G D,Zha Z,Liu J,et al.Establishment of nude mice xenograft model of human breast cancer cell strain MCF-7/HER2 with stable-transfected HER2[J].Chin Pharmacol Bull,2013,29(4):588-9.
[12]Morse M A,Wei J,Hartman Z,et al.Synergism from combined immunologic and pharmacologic inhibition of HER2 in vivo[J].Int J Cancer,2010,126(12):2893-903.
[13]Hartman Z C,Yang X Y,Glass O,et al.HER2 overexpression elicits a proinflammatory IL-6 autocrine signaling loop that is critical for tumorigenesis[J].Cancer Res,2011,71(13):4380-91.
[14]Rivera A,Fu X,Tao L,et al.Modification of a popular syngeneic murine mammary tumor model for immunotherapy studies[J].ISRN Immunol,2011,2011:1-8.
[15]吴 婷,檀英霞,王颖丽,等.表达人HER2/new及荧光素酶的小鼠乳腺癌模型的建立[J].军事医学,2012,36(2):133-6.
[15]Wu T,Tan Y X,Wang Y L,et al.Establishment of a mouse mammary cancer model stably expressing human HER2/neu gene and luciferase gene[J].Mil Med Sci,2012,36(2):133-6.
[16]贾 茜,吴洪涛,周兴军,等.富含GC的DNA片段在哺乳动物细胞基因超高表达调控中的重要作用[J].中国科学:生命科学,2010,40(2):159-65.
[16]Jia Q,Wu H T,Zhou X J,et al.A“GC-rich”method for mammalian gene expression:a dominant role of non-coding DNA GC content in regulation of mammalian gene expression[J].Sci China Life Sci,2010,40(2):159-65.
[17]Park S,Jiang Z,Mortenson E D,et al.The therapeutic effect of anti-HER2/neu antibody depends on both innate and adaptive immunity[J].Cancer Cell,2010,18(2):160-70.