FW-04-806对HER2阳性胃癌细胞的抗肿瘤活性及其机制研究
张 敏,曹品容,吴群丹,孔应利,陈丽红,罗燕梅,黄 维,3,许建华,2,叶 敏,2
(1.福建医科大学药学院,福建福州 350004;2.福建省天然药物药理学重点实验室,福建福州 350004;3.福建省微生物研究所,福建福州 350007)
胃癌是全球第4大常见的癌症,癌症相关致死率在全球排名第2位[1],在我国,胃癌的发生率居各癌症之首。大约20%的胃癌患者HER2过表达[2]。人类表皮生长因子受体2(HER2)是表皮生长因子受体家族的成员之一,分子质量185 ku,是一种具有酪氨酸激酶活性的跨膜受体[3]。临床上已出现多种HER2靶向药物,然而,大多数起初对HER2靶向药物有效的患者,最终都发生获得性耐药或二级耐药,由此衍生出一系列对曲妥珠单抗耐药的治疗策略,其中之一就是热休克蛋白90(Hsp90)抑制剂[4]。
Hsp90是高度保守的分子伴侣,通过消耗ATP,对细胞中众多信号蛋白构象成熟和功能稳定进行调控[5]。众多癌症相关蛋白(包括HER2)的稳定都需要Hsp90的参与,这使得它成为研究治疗基因突变相关癌症和克服靶向药物耐药的热门靶点。因此,探索其他具有Hsp90抑制功能的药物,对于治疗HER2阳性胃癌和解决HER2靶向药物的耐药问题具有重要的意义。
FW-04-806是本课题组的合作单位,福建省微生物研究所从土壤链霉菌Streptomyces sp.FIM-04-806发酵产物中分离获得的大环双内酯化合物[6],经过化学结构鉴别确定FW-04-806与conglobatin同质(Fig 1)。
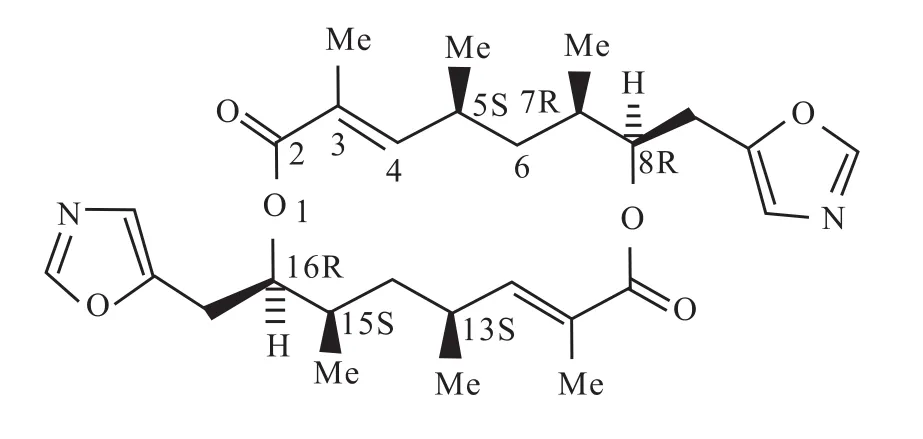
Fig 1 Molecular formula and molecular weight of FW-04-806Molecular formula:C28 H33 N2 O;Molecular weight:498.62
本课题组前期通过研究FW-04-806对HER2阳性乳腺癌的抗肿瘤活性发现[7],FW-04-806结合于Hsp90 N端,却不影响ATP和Hsp90的结合及ATP水解酶的活性,能减弱Hsp90与CDC37的相互作用,降解HER2和Akt等Hsp90客户蛋白,提示FW-04-806可能是一种新型的Hsp90抑制剂。本课题在此基础上,从Hsp90功能抑制的角度研究FW-04-806对HER2阳性胃癌细胞的抗肿瘤活性及其作用机制,并探讨FW-04-806与HER2酪氨酸酶抑制剂拉帕替尼(lapatinib)对HER2阳性胃癌细胞的联合效果,为今后本课题组开发该药作为新型Hsp90抑制剂提供参考依据。
1 材料与方法
1.1 材料 大环双内酯化合物FW-04-806(HPLC纯度=98%)由福建省微生物研究所提供;Lapatinib购自Lc laboratories公司,药物溶解于二甲基亚砜(DMSO)中,配成储存液 10 mmol·L-1于 -20℃备用,使用前解冻,用培养液稀释成所需浓度。人胃癌细胞株NCI-N87购自中国科学院上海生命科学研究院细胞资源中心;OE19购自中国广州吉妮欧生物科技有限公司;AGS、SGC-7901由福建医科大学临床药理研究所提供。MTT[3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐]购于美国 Sigma公司。HER2/ErbB、p-HER2/ErbB(Y1221/1222)、p-Akt、p44/42 MAPK(ERK1/2)、p-p44/42 MAPK(T202/Y204)(p-ERK)、caspase-3、cleaved caspase-3、Parp、cleaved Parp(Asp214)、CDC37均购自美国Cell Signaling Technology公司;Neu(C-18)(HER2)、Neu Antibody(24D2)FITC、Akt1(F-8)、β-actin(C4)、Hsp90(4F10)、Hsp70(W27)、Hsp27(G31)等均购自美国Santa Cruz公司;辣根过氧化物酶(HRP)标记的羊抗鼠/抗兔 IgG(二抗)、BCA蛋白定量试剂盒购于美国Pierce公司;蛋白酶抑制剂、磷酸酶抑制剂、流式凋亡检测试剂盒均购自Roche公司。Protein A Mag sepharoseTM、磁力架、ECL化学发光显影液购自GE healthy公司。FACSCantoII流式细胞仪购于BD公司;Image station 4000MM成像系统购于Carestream公司;电泳、转膜仪为BIORAD公司产品。♂SPF级Balb/C裸鼠购自上海斯莱克实验动物有限责任公司,合格证号:2007000566073。小鼠、兔超敏二步法检测试剂盒、DAB显色试剂盒均购自北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1 细胞培养 细胞株培养于含有胎牛血清(体积分数为 0.1)、青霉素(1×105IU·L-1)和链霉(100 mg·L-1)的 RPMI 1640培养液中,37℃、5%CO2饱和湿度培养箱中培养,NCI-N87使用Biochrome胎牛血清,OE19、AGS、SGC-7901使用 Hyclone胎牛血清,取对数生长期细胞用于实验。
1.2.2 FITC染色法检测细胞HER2表达 用不含EDTA的胰酶消化并收集对数生长期的NCI-N87、OE19、AGS、SGC-7901细胞各 1.8×106个,1 000 r·min-1离心5 min;PBS洗涤细胞后,每组中加入5 μl的Neu Antibody(24D2)FITC混匀,室温下避光反应5~15 min,PBS洗涤细胞2次后,转移入流式管中,4℃避光,冰上保存,60 min内在流式细胞仪上检测。
1.2.3 MTT法检测 FW-04-806对NCI-N87、OE19、AGS、SGC-7901细胞增殖抑制作用 96孔培养板中每孔种植4×103个细胞,每孔180μl,置于37℃、5%CO2培养箱中过夜,使细胞贴壁后,实验组分别加入不同浓度的药物,对照组不加药,另设空白孔组(只加培养基,无细胞),每组设3个复孔,作用48 h。然后每孔加入5 g·L-1的 MTT溶液20μl,继续培养4 h后,弃去上清,加入150μl DMSO溶解,培养箱孵育20 min后,用酶标仪(Thermo公司)在570 nm波长下测吸光度值(OD值)。结果用 Prism Graph软件分析,绘制细胞存活率-浓度曲线,计算药物IC50,实验重复3次,取平均值。
1.2.4 结晶紫染色法检测FW-04-806对NCI-N87、OE19细胞集落形成能力的抑制作用 12孔板上每孔种植5×103个细胞,培养箱过夜贴壁,实验组分别加入不同浓度的药物,对照组加DMSO,每组设3个平行孔,每周更换新鲜药液2次,作用10 d,弃去培养液,用PBS清洗2次,加入适量甲醇,固定细胞5 min,PBS清洗2次,吸干水分,晾干后加入结晶紫染液(0.5 g吉氏染色素粉末,溶于50 ml甲醇与50 ml双蒸水)覆盖细胞层,染色10 min,用自来水冲洗掉后,再用双蒸水冲洗细胞,显微镜下观察计算集落数目。
1.2.5 碘化丙啶(PI)染色法检测细胞周期 取对数生长期的NCI-N87、OE19细胞,调整细胞浓度为每孔9×105个细胞,接种到6孔板中,37℃培养箱过夜贴壁,设置对照组及加药处理组。不同浓度的FW-04-806作用48 h,用不含EDTA的胰酶消化并收集细胞,1 000 r·min-1离心 5 min,收集细胞后用0.5 ml PBS重悬,缓慢加入4.5 ml体积分数为0.75的乙醇中,边滴边轻轻摇匀,-20℃冰箱中放置24 h以上,离心弃去上层乙醇溶液,用PBS清洗1次,收集细胞后,0.5 ml PBS重悬,加入RNA酶使其终浓度为50 mg·L-1,37℃孵育 30 min,加入 PI染色液使其终浓度为50 mg·L-1,室温避光染色30 min;转移入流式管中,4℃避光,冰上保存,并在流式细胞仪上检测,实验结果采用Modifit软件进行分析。
1.2.6 Annexin-V-FITC/PI双染法检测细胞凋亡
取对数生长期的NCI-N87、OE19细胞,接种到6孔板中,每孔种1.8×106个细胞,37℃培养箱静置过夜贴壁,设置对照组及加药处理组。不同浓度的药物作用48 h,用不含EDTA的胰酶消化并收集细胞,1 000 r·min-1离心5 min;PBS洗涤细胞 2次后,用0.5 ml Binding Buffer重悬细胞;每组中加入5μl的Annexin-V-FITC混匀,再加入5μl的PI混匀;室温下避光反应5~15 min,转移入流式管中,4℃避光,冰上保存,60 min内在流式细胞仪上检测[8]。
1.2.7 体内动物实验
1.2.7.1 体内异种移植瘤模型检测FW-04-806对OE19肿瘤生长抑制作用 收集1×107个OE19细胞,0.2 ml PBS重悬,超净台内于裸鼠左侧背部皮下注射。肿瘤生长到一定大小后,无菌条件下解剖并取其瘤块,将瘤块剪成直径约为2.0 mm左右的均匀小块,用无菌套管针接种于裸鼠背部皮下,等肿瘤生长至100~200 mm3时,将裸鼠按瘤体积大小随机分3组,每组6只。分组后次日开始每天灌胃给药,低剂量组为50 mg·kg-1FW-04-806,高剂量组为200 mg·kg-1FW-04-806,阴性对照组为与实验组等体积的空白溶剂(体积分数为0.1的乙醇、0.1的PEG 400、0.1的 Tween 80、0.7的生理盐水)。最后一次给药24 h后,将裸鼠脱颈椎处死,剥取瘤块并称重,计算各组瘤重均数及肿瘤生长抑制率。抑瘤率/%=(1-给药组平均瘤重/阴性对照组平均瘤重)×100%;肿瘤体积=1/2×长径×短径2。
1.2.7.2 免疫印迹法检测FW-04-806对OE19瘤块细胞通路相关蛋白表达的影响 从称重后的瘤块剪下一粒黄豆大小的组织放入匀浆器内,加入细胞裂解液匀碎研磨,转入EP管,冷冻离心机4℃,12 000×g离心15 min,吸出上清,即为总蛋白,整个过程在冰上操作。BCA法蛋白定量后于98℃下蛋白变性,冷却后-20℃保存,免疫印迹法检测蛋白表达。
1.2.7.3 免疫组化检测FW-04-806对OE19肿瘤组织Akt、HER2蛋白表达的影响 将称重记录后的瘤块装入包埋盒中,4%甲醛液固定,自动脱水机脱水后将组织包埋;置于冷却机上冷却后,用切片机切片,60℃恒温烤片过夜,烘干的切片进行脱蜡和水化,使用酸性修复法进行抗原修复;加入3%H2O2孵育8 min,阻断内源性过氧化物酶的活性,加入相应的一抗稀释液室温下孵育2 h,加二抗检测试剂Ⅰ室温下孵育20 min后,加二抗检测试剂Ⅱ,室温下孵育30 min,加入DAB底物混合液孵育5 min,PBS冲洗后苏木精复染、脱水、透明、封片,正置显微镜下观察,拍照。
1.2.8 免疫印迹法检测FW-04-806对HER2阳性胃癌细胞相关蛋白表达的影响 取对数生长期的NCI-N87和OE19细胞,在培养皿中种3×106个细胞,培养箱过夜贴壁,设置对照组及不同浓度的药物处理组,作用24 h,收集细胞裂解液,BCA蛋白定量,98℃蛋白变性,SDS聚丙烯酰胺凝胶电泳、转膜、封闭,相应一抗4℃孵育过夜,TBST洗涤3次,每次5 min,室温下二抗孵育1 h,TBST洗涤3次,每次5 min,在Image station 4000MM成像系统上加入ECL发光底物进行曝光显影。
1.2.9 免疫共沉淀法检测FW-04-806对Hsp90/CDC37复合物的影响 取生长对数期的OE19细胞,每皿3×106个细胞,接种到10 cm的培养皿中,于培养箱过夜贴壁,设置对照组及加药处理组,作用24 h,收集细胞裂解液,BCA蛋白定量,用NP-40裂解液将对照组和加药处理组稀释为1 g·L-1,各取500μl(500μg总蛋白)装于1.5 ml EP管,各加入Hsp90抗体2μg,在旋转培养器上4℃垂直旋转孵育过夜。每管加入20μl protein A Mag sepharose,4℃垂直旋转孵育2 h。置于磁力架上,分层后弃去上清,NP-40裂解液重悬,继续放回磁力架分层,用预冷的PBS清洗2次后,离心收集复合物,98℃蛋白变性5 min,免疫印迹法检测Hsp90和CDC37。
1.3 统计学方法 采用SPSS 13.0软件进行统计处理,结果以¯x±s表示,实验独立重复3次,采用One-Way analysis of variance统计分析。
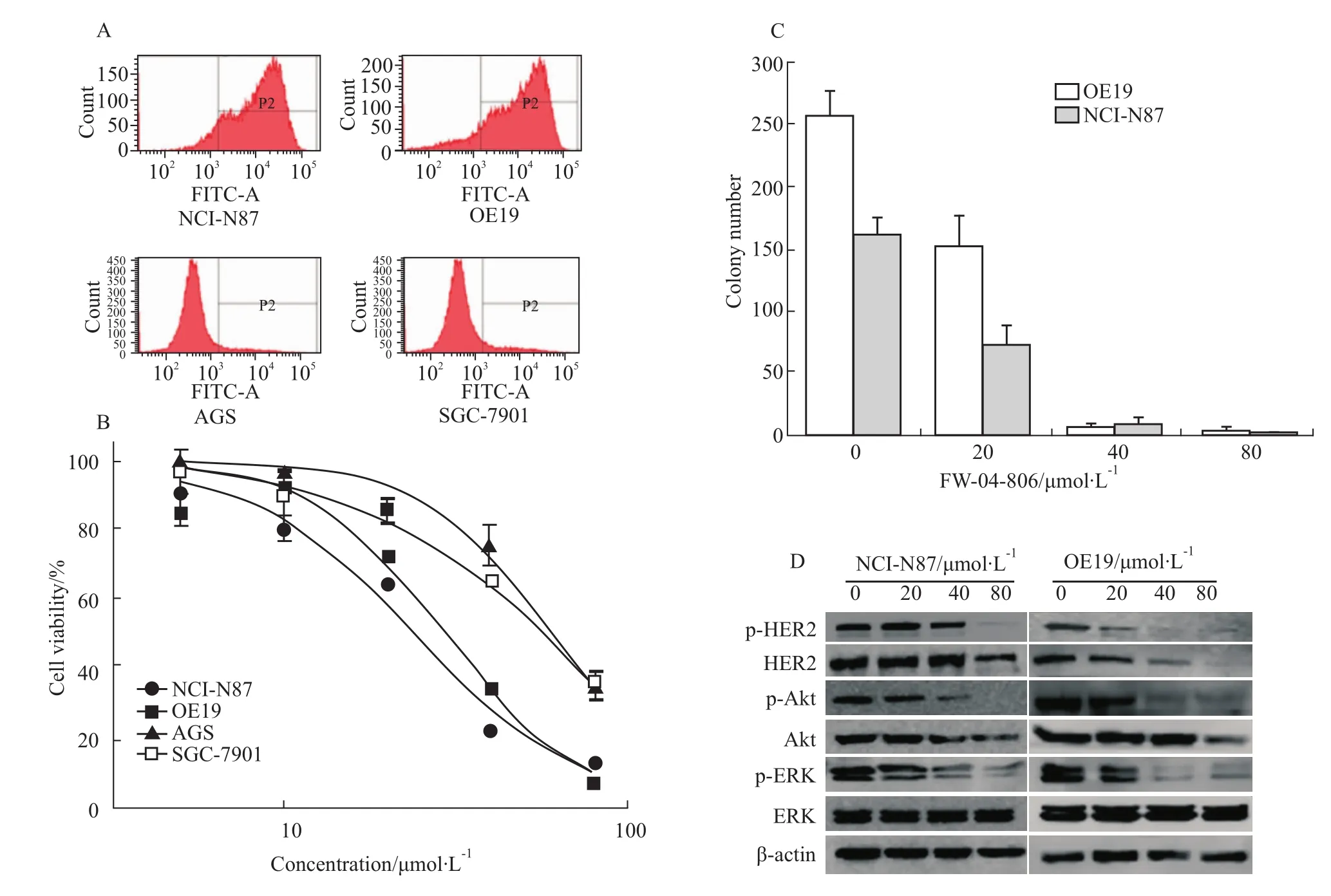
Fig 2 Proliferous inhibition of FW-04-806 against HER2-positive gastric cancer cell linesA:The expression of HER2 was tested in four gastric cancer cells by flow cytometry.NCI-N87 and OE19 cell lines overexpressed HER2 compared with AGSand SGC-7901 cell lines;B:Four gastric cancer cells were treated with FW-04-806 for 48h,HER2-positive gastric cancer cells showed more sensitivity to FW-04-806;C:NCI-N87 and OE19 were treated with increasing concentration of FW-04-806 for 10d.FW-04-806 inhibited both NCI-N87 and OE19 in colony formation;D:NCI-N87 and OE19 were treated with FW-04-806 for 24h.Degradation of HER2,Akt and inhibition of phosphorylated HER2,Akt,ERK were observed.
2 结果
2.1 FW-04-806有效抑制胃癌细胞增殖,对HER2阳性胃癌细胞更敏感 流式检测结果表明(Fig 2A),NCI-N87、OE19、AGS与 SGC-7901胃癌细胞的HER2表达率分别为:(95.70±0.15)%、(92.18±0.29)%、(4.65±0.13)%、(3.54±0.19)%。不同浓度FW-04-806处理4株胃癌细胞48 h后,MTT结果表明(Fig 2B),随着药物浓度增加,FW-04-806明显抑制NCI-N87、OE19、SGC-7901和AGS细胞的增殖,IC50分别为(24.17±0.16)、(29.61±0.27)、(60.59±0.26)、(58.13±0.18)μmol·L-1。FW-04-806对HER2阳性的胃癌细胞抑制作用强于HER2阴性细胞。
2.2 FW-04-806明显抑制HER2阳性胃癌细胞集落形成 不同浓度FW-04-806处理NCI-N87、OE19细胞10 d后,结果表明(Fig 2C),FW-04-806能够抑制NCI-N87和OE19细胞集落的形成,与对照组相比较,随着药物浓度的增加抑制作用愈趋明显。
2.3 FW-04-806抑制胃癌细胞增殖信号通路的转导 不同浓度FW-04-806作用NCI-N87、OE19细胞24 h后,免疫印迹结果表明(Fig 2D),FW-04-806减少 HER2和 Akt表达,阻断 HER2、Akt、ERK的磷酸化。
2.4 FW-04-806使 HER2阳性胃癌细胞阻滞于G2-M期并诱导凋亡 不同浓度FW-04-806作用于NCI-N87和 OE19细胞48h,PI染色法、Annexin-VFITC/PI双染法流式细胞术检测结果显示(Fig 3A、3B),随着药物剂量增加,G2-M期比例和凋亡比例明显增加。不同浓度FW-04-806作用于NCI-N87和OE19细胞24 h,免疫印迹法检测结果可以看出(Fig 3C),随着剂量增加,caspase-3、parp表达减少,cleaved caspase-3、cleaved parp凋亡蛋白表达增加。
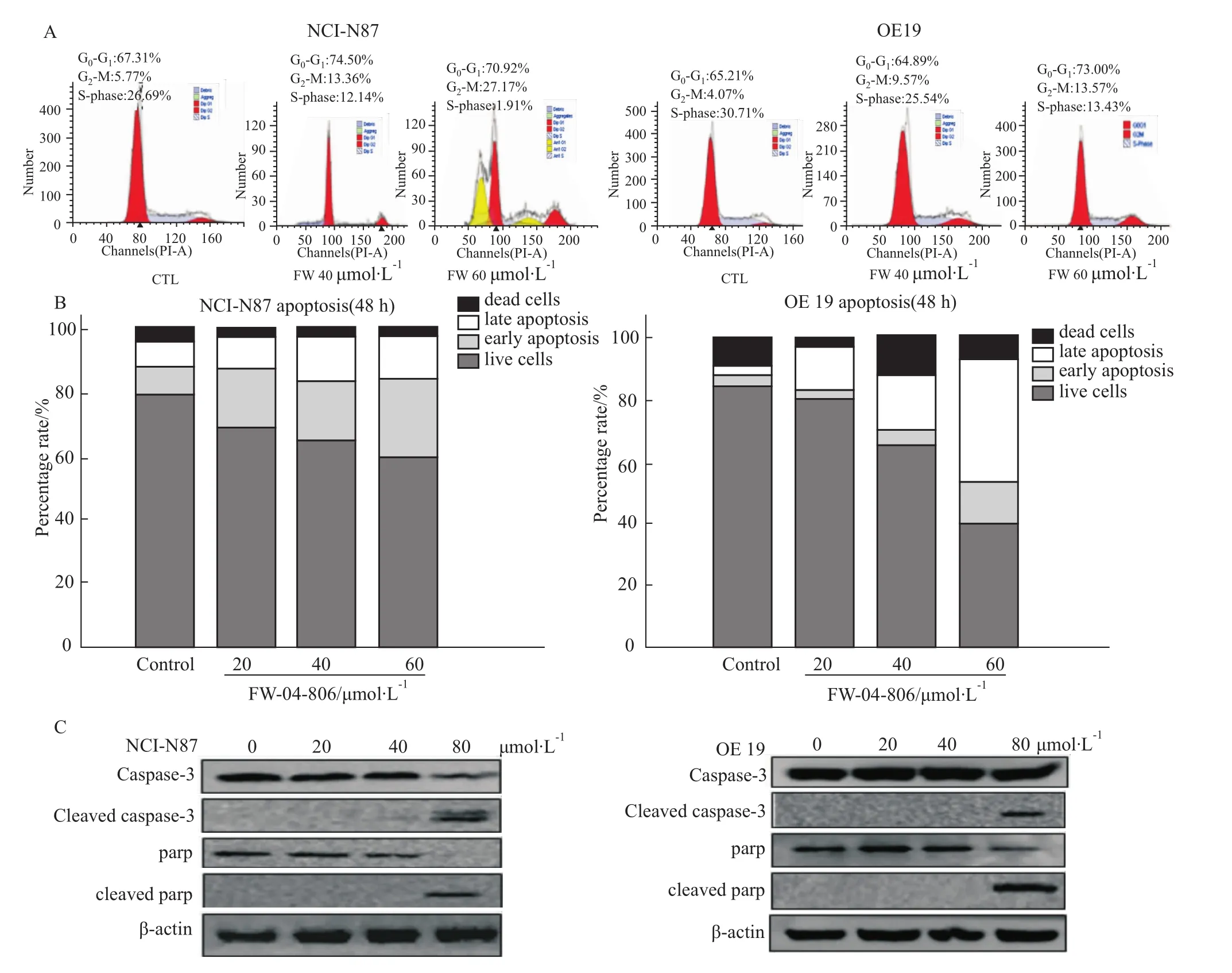
Fig 3 FW-04-806 induces G2-M arrest and apoptosis in NCI-N87 and OE19 cellsA:NCI-N87 and OE19 were treated with FW-04-806 for 48h.Both cell lines showed an increase of G2-M arrest in a dose-dependent manner;B:Treatment with FW-04-806 for 48h induced dose-dependent apoptosis in NCI-N87 and OE19;C:24h treatment of FW-04-806 induced apoptosis in both NCI-N87 and OE19,followed by the increase of cleaved caspase-3 and cleaved parp.
Tab 1 Effect of FW-04-806 on the tumor growth of established OE19 xenografts(±s,n=6)

Tab 1 Effect of FW-04-806 on the tumor growth of established OE19 xenografts(±s,n=6)
Treatment with FW-04-806 200 mg·kg-1·d-1 for 3 wk caused tumor growth inhibition(TGI)of 48.0%.**P<0.01 vs control group.
Group Dose/mg·kg-1 Body weight/g Start End Tumor weight/g TGI/%Control - 21.1±1.7 21.4±1.8 1.7±0.34 0 FW-04-806 50 21.1±1.0 20.9±0.6 1.6±0.15 6.1 200 21.3±1.2 21.0±1.8 0.9±0.23 48.0**
2.5 FW-04-806抑制OE19体内肿瘤生长 不同剂量组FW-04-806每天灌胃给药3周后,处死裸鼠,得到瘤块(Fig 4A),瘤块体积随时间变化见Fig 4B,与对照组相比,200 mg·kg-1实验组对OE19肿瘤的抑瘤率为48.0%(Tab 1);免疫组化法检测发现,Akt、HER2蛋白表达明显减少(Fig 4C);将组织捣碎、提取裂解蛋白,免疫印迹法检测显示(Fig 4D),FW-04-806减少 Akt、HER2表达,抑制 Akt、HER2、ERK的磷酸化,阻断细胞增殖信号通路,同时,增加cleaved parp的表达,诱导细胞凋亡。
2.6 FW-04-806诱导Hsp70表达,干扰CDC37与Hsp90的结合 不同浓度 FW-04-806分别作用NCI-N87和OE19细胞24 h,免疫印迹法检测结果显示(Fig 5A),FW-04-806对Hsp27的表达没有明显影响,但随着浓度增加,Hsp70诱导表达明显增加;40μmol·L-1FW-04-806作用OE19细胞24 h,免疫共沉淀法检测结果表明(Fig 5B),FW-04-806解离Hsp90/CDC37复合物,减少 CDC37与 Hsp90的结合。
2.7 FW-04-806与拉帕替尼联用具有协同作用不同浓度的FW-04-806联合拉帕替尼作用NCI-N87细胞48 h,通过CompuSyn软件联合指数CI均小于1(Tab 2),表明FW-04-806与拉帕替尼联合具有协同作用(协同作用:0<CI<1,拮抗作用:CI>1);Annexin-V-FITC/PI双染法检测结果显示(Fig 6A),联合用药比单用诱导凋亡效果更好;两药联合作用NCI-N87细胞24 h,免疫印迹法检测结果发现(Fig 6B),联合用药更有效抑制 HER2、Akt、ERK的磷酸化,并增加cleaved caspase-3、cleaved parp的表达。
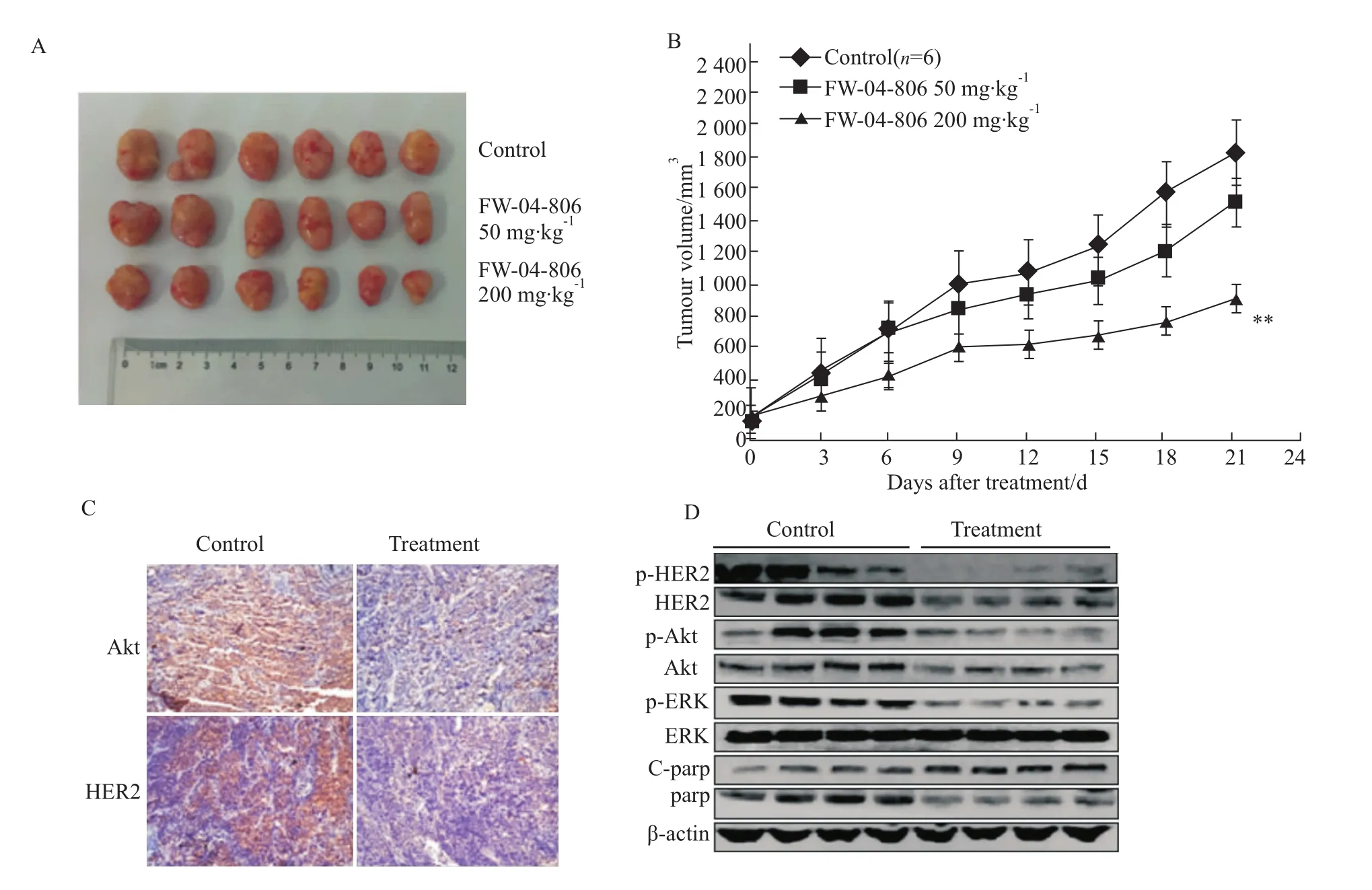
Fig 4 FW-04-806 inhibits tumor growth in OE19 tumor xenograft modelsA:Tumor photos;B:While tumors achieved volume of approximately 100 to 200 mm3,OE19 tumor xenograft nude mice were randomized into groups(n=6/group)treated with FW-04-806 at doses of 0,50,200 mg·kg-1·d-1,ig.Tumor volume was measured every 3 d;C:Representative immunohistochemistry of tumor tissues showed significant degradation of HER2 and Akt in OE19 tumors treated as indicated(10×);D:Tumor tissues excised from the OE19 xenograft mice were lysed and tested the protein level changes in HER2,p-HER2,ERK,p-ERK,Akt,p-Akt,parp and cleaved parp.
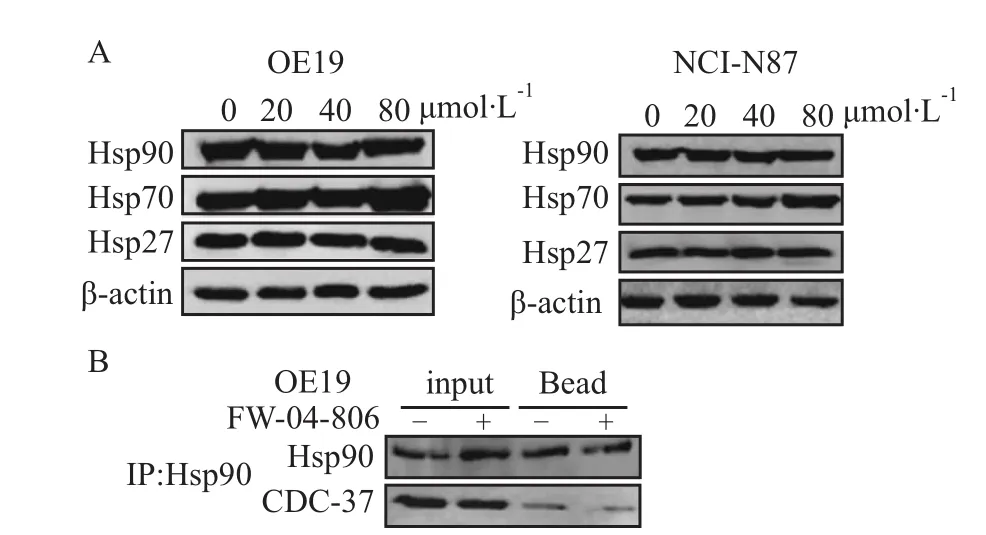
Fig 5 FW-04-806 induces Hsp70 expression and inhibits the Hsp90/CDC37 interactionsA:NCI-N87 and OE19 cells were treated with FW-04-806 for 24 h,FW-04-806 induced the increase of Hsp70,while Hsp27 had no significant difference;B:OE19 cells were treated with 40μmol·L-1 FW-04-806 or DMSO for 24h.Hsp90 protein was immuoprecipitated from whole cell lysates with an anti-Hsp90 antibody and analyzed by immunoblot with antibodies against Hsp90 and CDC37.
Tab 2 Synergistic effect of FW-04-806 with lapatinib in NCI-N87 cells±s,n=3)
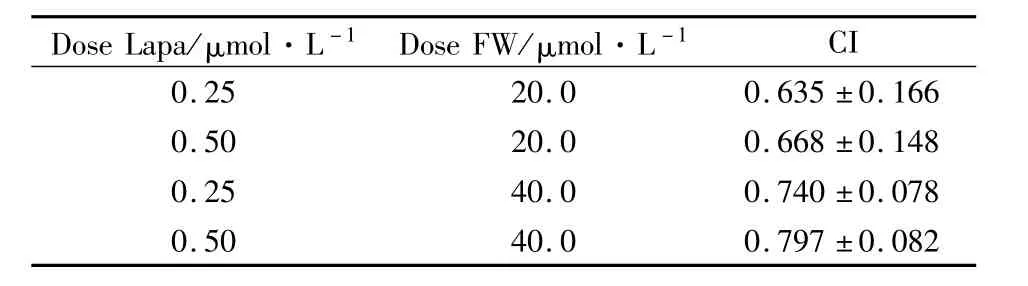
Tab 2 Synergistic effect of FW-04-806 with lapatinib in NCI-N87 cells±s,n=3)
NCI-N87 cells were treated with FW-04-806,lapatinib and combination of FW-04-806 and lapatinib for 48h,respectively.The combination of FW-04-806 and lapatinib showed greater inhibitory effect than single drug treatment(synergy:0<CI<1,antagonism CI>1).
D o s e L a p a/μ m o l·L-1 D o s e F W/μ m o l·L-1 C I 0.2 5 2 0.0 0.6 3 5±0.1 6 6 0.5 0 2 0.0 0.6 6 8±0.1 4 8 0.2 5 4 0.0 0.7 4 0±0.0 7 8 0.5 0 4 0.0 0.7 9 7±0.0 8 2
3 讨论
HER2还没有确定的配体,它可与别的HER家族成员发生同源或异源二聚化,引发自体磷酸化,激活下游的Ras-Raf-MAPK和PI3K-Akt-mTOR通路[9-10]。曲妥珠单抗(trastuzumab)为人源化单克隆抗体,选择性地结合于HER2的细胞外部位,阻断HER2的二聚化,是目前HER2阳性胃癌的一线治疗药物[11]。拉帕替尼是一种小分子酪氨酸激酶抑制剂,它可逆地结合于EGFR/HER-2酪氨酸激酶区的ATP结合位点[12],抑制了受体激酶区的自身磷酸化,从而阻断了下游信号通路。然而,针对HER2靶向的药物临床上都不可避免地出现了耐药[13]。而HER2是Hsp90主要的客户蛋白之一[14],肿瘤中Hsp90的表达比正常细胞更活跃[15],胃腺癌,尤其在淋巴结转移的胃癌中,Hsp90的表达水平增加[16],Hsp90调控的客户蛋白包含众多原癌基因蛋白,因此Hsp90抑制剂具有一靶多效的优势。
本实验结果证明,FW-04-806作为链霉菌的发酵产物,对HER2阳性胃癌具有良好的体内外抗肿瘤活性。综合FW-04-806对HER2阳性胃癌的研究结果,FW-04-806可能是一种新型的Hsp90抑制剂,其作用机制可能是通过减少CDC37/Hsp90复合物的形成,抑制Hsp90功能,从而降解Hsp90的客户蛋白HER2、Akt,阻断HER2下游Ras-Raf-MAPK和PI3K-Akt-mTOR信号通路,抑制肿瘤细胞增殖;另一方面,通过阻滞细胞周期于G2-M期,增加caspase-3、parp的切割,诱导细胞凋亡,从而达到抗肿瘤的效果。此外,FW-04-806联合拉帕替尼对HER2阳性胃癌细胞NCI-N87生长抑制具有协同作用,该协同效果可能是通过联合后加强对细胞增殖的抑制作用和对细胞凋亡的诱导作用这两个途径来实现。未来研究可以此为基础,在体外培养对拉帕替尼的耐药细胞株,进一步研究FW-04-806对HER2靶向药物耐药细胞株的抗肿瘤和克服耐药的效果及机制,为开展该药作为Hsp90抑制剂的研究提供理论依据。
综上所述,FW-04-806抑制 HER2阳性细胞NCI-N87和OE19的增殖,诱导细胞凋亡,有效抑制OE19体内异种移植瘤生长,对HER2阳性胃癌具有良好的体内外抗肿瘤活性,与拉帕替尼联合对NCIN87细胞的生长抑制具有协同作用。
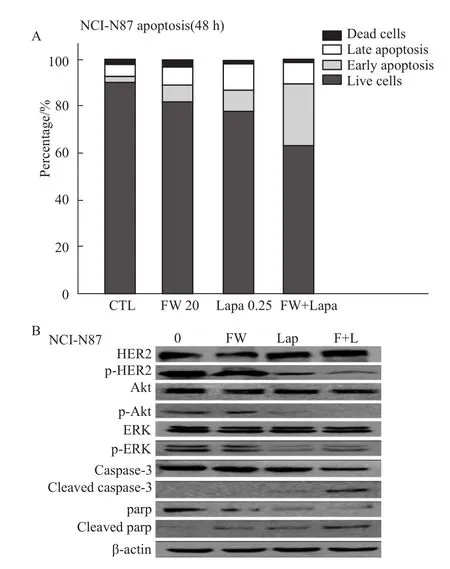
Fig 6 Synergistic effects of FW-04-806 with lapatinib in NCI-N87 in vitroA:Apoptotic induction in combination of FW-04-806 and lapatinib.Apoptosis rate increased when two drugs were combined for 48h;B:After 24h treatment with combination of FW-04-806 with lapatinib,cleaved caspase-3 and cleaved parp were enhanced,followed by blockage of HER2 downstream signaling pathways.
参考文献:
[1] Jemal A,Bray F,Center M M,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2] Gravalos C,Jimeno A.HER2 in gastric cancer:a new prognostic factor and a novel therapeutic target[J].Ann Oncol,2008,19(9):1523-9.
[3] Akiyama T,Sudo C,Ogawara H,et al.The product of the human c-erbB-2 gene:a 185-kilodalton glycoprotein with tyrosine kinase activity[J].Science,1986,232(4758):1644-6.
[4] Pazo Cid R A,Anton A.Advanced HER2-positive gastric cancer[J].Crit Rev Oncol Hematol,2013,85(3):350-62.
[5] Pazo Cid R A,Antón A.Hsp90 and co-chaperones twist the functions of diverse client proteins[J].Biopolymers,2010,93(3):211-7.
[6] 陈 宏,黄 维,贾 纬,等.FW-04-806的结构分析及其抗肿瘤活性研究[J].中国抗生素杂志,2011,36(7):502-6.
[6] Chen H,Huang W,Jia W,et al.Structure identification and anti-tumor activity research of FW-04-806[J].Chin J Antibiot,2011,36(7):502-6.
[7] Huang W,Ye M,Zheng W,et al.FW-04-806 inhibits proliferation and induces apoptosis in human breast cells by binding to N-terminus of Hsp90 and disrupting Hsp90-CDC37 complex[J].Mol Cancer,2014,13:150.
[8] 师以康,张胜华,黄云虹,等.乳腺癌细胞的HER2过表达降低其对紫杉醇的药物敏感性[J].中国药理学通报,2009,25(4):444-8.
[8] Shi Y K,Zhang SH,Huang Y H,et al.HER2 overexpression in breast cancer cell reduces the sensitivity to taxol[J].Chin Pharmacol Bull,2009,25(4):444-8.
[9] Hsieh A C,Moasser M M.Targeting HER proteins in cancer therapy and the role of the non-target HER3[J].British J Cancer,2007,97(4):453-7.
[10] Okines A,Cunningham D,Chau I.Targeting the human EGFR family in esophagogastric cancer[J].Nat Rev Clin Oncol,2011,8(8):492-503.
[11]Bang Y J,Van Cutsem E,Feyereislova A,et al.Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer(ToGA):a phase 3,open-label,randomised controlled trial[J].Lancet,2010,376(9742):687-97.
[12]Rusnak D W,Lackey K,Affleck K,et al.The effects of the novel,reversible epidermal growth factor receptor/ErbB-2 tymsine kinase inhibitor,GW572016,on the growth of human normal and tumorderived cell lines in vitro and in vivo[J].Mol Cancer Ther,2001,1(2):85-94.
[13]Spector N L,Xia W,Burris H,et al.Study of the biologic effects of Lapatinib,a reversible inhibitor of ErbB1 and ErbB2 tyrosine kinases,on tumor growth and survival pathways in patients with advanced malignancies[J].J Clin Oncol,2005,23(11):2502-12.
[14]Ferrarini M,Heltai S,Zocchi M R,Rugarli C.Unusual expression and localization of heat-shock proteins in human tumor cells[J].Int J Cancer,1992,51(4):613-9.
[15]Trepel J,Mollapour M,Giaccone G,Neckers L.Targeting the dynamic Hsp90 complex in cancer[J],Nat Rev Cancer,2010,10(8):537-49.
[16]Zuo D S,Dai J,Bo A H,et al.Significance of expression of heat shock protein90alpha in human gastric cancer[J].World J Gastroenterol,2003,9(11):2616-8.