干扰α烯醇化酶对耐药细胞株K562/A02耐药性的影响
高 雪,叶 舟,吴克雄,范冬梅,杨 铭,张砚君,张益枝
[中国医学科学院北京协和医学院天津血液病医院(血液学研究所),天津 300000]
血液病治疗过程中产生耐药性是治疗失败和复发的主要原因之一[1]。肿瘤细胞产生耐药的原因主要有3个方面:(1)肿瘤耐药相关基因的过表达,如MDR1基因、MRP基因和LPR基因等。(2)酶系统的活性异常,如GSH、GST和DNA拓扑异构酶等。(3)细胞凋亡异常:耐药性肿瘤细胞内抑制凋亡基因的异常表达,如 Bcl-2基因[2-3]。目前针对肿瘤耐药的治疗和逆转方法虽然取得了一定进展,但用于临床治疗还有很多限制和不足,肿瘤耐药产生及发展机制还需要不断深入研究。
α烯醇化酶(eno1)是烯醇化酶家族成员之一,是结构上高度保守的一种糖酵解酶,在脊椎动物组织中广泛存在。eno1主要与烯醇化酶家族其他成员形成同源或异源二聚体形式起作用。eno1与肿瘤发生、发展和多种疾病的发生密切相关。近年来研究发现,在侵袭转移性强和耐药性的恶性肿瘤细胞中,eno1常处于过表达状态,如头颈癌、乳腺癌和甲状腺癌等[4-5]。本文主要探讨eno1对人慢性粒细胞白血病耐药细胞株K562/A02生长及耐药性的影响及机制,为耐药性白血病治疗提供一定的实验依据。
1 材料与方法
1.1 材料 人慢性粒细胞白血病细胞株K562和人慢性粒细胞白血病耐药细胞株K562/A02由实验血液学国家重点实验室保存;pSilencerU6-sheno1质粒和pSilencerU6-shcon质粒有本室构建和保存;TRIzol、Lipofectamine2000转染试剂和MML-V逆转录试剂盒购自美国Invitrogen公司;SYBR实时检测试剂盒、G418、MTT和 DMSO购自美国 Sigma公司;RPMI 1640培养基粉剂购自美国Gibco公司;eno1、MDR1和GAPDH抗体购自CST公司;胎牛血清购自天津灏洋生物技术有限公司。
1.2 细胞培养及eno1干扰细胞株的筛选 细胞培养于含10%胎牛血清的RPMI 1640培养液中,细胞为标准的悬浮生长状态,常规传代,培养于CO2浓度为5%的37℃恒温细胞培养箱中。取对数生长期细胞,接种1×105个细胞于24孔板中,培养24 h后将pSilencerU6-sheno1质粒和pSilencerU6-shcon质粒按照Lipofectamine2000转染试剂说明进行RNA干扰转染实验。转染48 h后加入250μg·L-1的G418进行稳定克隆筛选,14d后进行细胞单克隆培养,得到稳定干扰的细胞株,分别取名为K562/A02-sheno1-1、K562/A02-sheno1-2、K562/A02-sheno1-3和 K562/A02-shcon。
1.3 细胞生长速率和细胞增殖检测 使用细胞计数法检测细胞生长速率:取对数生长的细胞,接种于24孔板内,每孔5 000个细胞,每组设3个复孔。使用MTT法检测细胞增殖:取对数生长期细胞,调整细胞浓度为5×107·L-1,接种于96孔培养板中,每孔180μl细胞液。培养24 h后,将抗肿瘤药物紫杉醇和阿霉素按照一定浓度加入培养板中,每个浓度设3个复孔,药物体积为每孔20μl,继续培养48 h。每孔加入20μl MTT溶液,恒温培养箱中继续培养4 h,每孔加入100μl DMSO溶解结晶,酶标仪检测各孔波长570 nm处的吸光度值,计算IC50值。
1.4 罗丹明123蓄积实验 收集1×105个细胞,冷的PBS缓冲液冲洗3次。细胞重悬于300μl罗丹明123染液中,37℃恒温振荡水浴中避光孵育1h。收集细胞,冷的PBS缓冲液冲洗3次,用300μl PBS缓冲液重悬细胞,流式细胞仪检测细胞荧光强度。
1.5 real-time PCR检测基因 mRNA水平 按TRIzol试剂盒说明书提取细胞总RNA,琼脂糖凝胶电泳鉴定其完整性,测定其260 nm和280 nm光密度值并计算RNA的纯度与浓度。按照MML-V逆转录试剂盒说明进行逆转录,获得相应cDNA。realtime PCR引物由上海生工生物工程股份有限公司合成。GAPDH:上游引物:5′-GAA GGT GAA GGT CGG AGT C-3′,下游引物:5′-GAA GAT GGT GAT GGG ATT TC-3′;eno1:上游引物:5′-AGC UGG UGC CGU UGA GAA GTT-3′,下游引物:5′-CUU CUC AAC GGCACC AGC UTT-3′。real-time PCR反应按SYBR实时检测试剂盒说明进行。
1.6 Western blot检测蛋白水平 收集1×106个细胞,冷的PBS缓冲液冲洗3次,将细胞转移至EP管中,加入一定量RIPA裂解液,冰上裂解30 min,4℃12 000×g离心20 min收集上清液。BCA法测定各组蛋白浓度,取50μg蛋白经SDS-PAGE电泳后,电转印至NC膜上。5%脱脂奶粉室温封闭1 h后,加入相应一抗,4℃孵育过夜。PBST缓冲液洗膜3次后,加入辣根过氧化物酶标记的二抗(1∶3 000稀释),室温孵育1 h。PBST缓冲液洗膜3次后进行ECL化学发光试剂显色,胶片曝光。
1.7 统计学方法 实验结果为3次重复实验结果。采用Quantity One软件进行Western blot条带灰度分析;采用GraphPad Prism 5.0软件分析和处理获得的数据;采用SPSS 13.0软件进行多组间单因素方差分析,两组间采用独立样本t检验,计量资料以x¯±s表示。
2 结果
2.1 eno1在K562/A02细胞中过表达 细胞计数法检测12、24、36、48和 60 h细胞数量发现,K562/A02细胞生长速率与敏感性K562细胞相比差异无显著性。real-time PCR实验和Western blot实验结果显示,K562/A02细胞中eno1基因在mRNA水平和蛋白水平均处于过表达状态。与K562细胞相比,K562/A02细胞中eno1基因在mRNA水平表达增强(2.85±0.56)倍,在蛋白水平表达增强(1.43±0.05)倍 (Fig 1,2)。
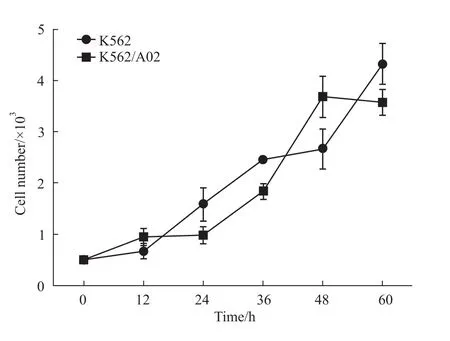
Fig 1 Cell growth rate(performed by cell counting assay)There was no difference in cell growth between K562 cells and K562/A02 cells and numerical analysis data represent¯x±s based on three independent experiments.

Fig 2 Expression of eno1 increases in K562/A02 cellsA:The mRNA expression level of eno1 was tested by real-time PCR assay.B:The protein expression level of eno1 was tested by western blot assay.Numerical analysis data represent¯x±s based on three independent experiments,*P<0.05 vs K562.
2.2 稳定干扰eno1细胞系的鉴定 使用本室构建的RNA干扰质粒pSilencerU6-sheno1和pSilencerU6-shcon转染并干扰K562/A02细胞,经G418筛选2周,单克隆细胞培养后得到稳定干扰细胞系。real-time PCR检测结果显示,eno1稳定干扰的3株细胞系在mRNA水平干扰效率分别为(43.15±0.03)%,(77.59±0.05)%和(57.04±0.06)%(Fig 3A)。Western blot检测结果显示,稳定干扰eno1组中eno1蛋白无明显表达(Fig 3B)。实验结果证明3株eno1稳定干扰细胞系及对照细胞系成功建立。

Fig 3 eno1 stable silencing cell lines are identified in mRNA level and protein levelThree eno1 stable silencing cell lines were tested and results showed that eno1 stable silencing cell line was successfully established.Numerical analysis data represent¯x±s based on three independent experiments,**P<0.01 vs K562/A02-shcon.
2.3 稳定干扰eno1增强K562/A02细胞对抗肿瘤药物紫杉醇和阿霉素的敏感 细胞计数法检测结果显示,K562/A02细胞稳定干扰eno1后,其生长速率明显降低,其中K562/A02-sheno1-2生长速率最低(Fig 4)。MTT法检测结果显示,K562/A02-sheno1组中紫杉醇和阿霉素对细胞增殖抑制明显增强,呈现剂量依赖性。对紫杉醇敏感性检测结果显示,紫杉醇对 K562/A02-shcon、K562/A02-sheno1-1、K562/A02-sheno1-2和K562/A02-sheno1-3细胞系48 h的IC50值分别为(7.40±0.03)、(2.08±0.49)、(1.66±0.05)和(2.03±0.37)μmol·L-1;对阿霉素敏感性检测结果显示,阿霉素对 K562/A02-shcon、K562/A02-sheno1-1、K562/A02-sheno1-2和 K562/A02-sheno1-3细胞系48 h的IC50值分别是(112.17±16.25)、(43.29±6.36)、(44.98±5.29)和(62.26±4.53)μmol·L-1。
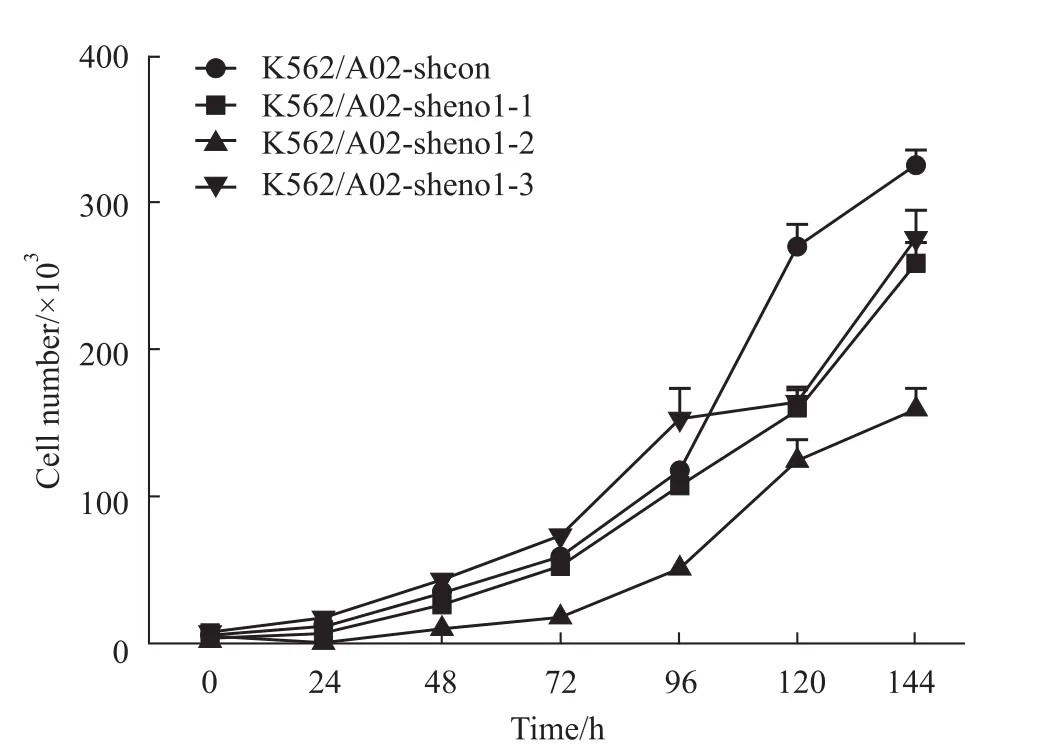
Fig 4 Cell growth rate(performed by cell counting assay)Cell growth rate in K562/A02 cells was associated with eno1 and three eno1 stable silencing cell lines were tested.Numerical analysis data represent¯x±s based on three independent experiments.
2.4 稳定干扰 eno1增强 K562/A02细胞罗丹明123蓄积能力 罗丹明123蓄积实验结果显示,eno1稳定干扰的细胞系K562/A02-sheno1-1、K562/A02-sheno1-2和 K562/A02-sheno1-3与对照组K562/A02-shcon相比,其罗丹明123含量分别提高了(59.05±0.15)%、(60.81±0.03)%和(50.82±1.02)%(Fig 5)。由此可知,eno1干扰增强 K562/A02细胞药物敏感性与其细胞膜上糖蛋白泵出药物的能力有关。
2.5 稳定干扰eno1对K562/A02细胞内耐药相关基因MDR1表达的影响 以GAPDH为内参,在Fig 6 real-time PCR实验结果显示,稳定干扰eno1的细胞 系 K562/A02-sheno1-1、K562/A02-sheno1-2和K562/A02-sheno1-3实验组与对照组相比,MDR1基因mRNA表达分别降低(45.02±0.08)%、(73.21±0.05)%和(41.67±0.91)%。而且 Western blot检测结果显示,eno1稳定干扰的细胞系K562/A02-sheno1-1、K562/A02-sheno1-2和 K562/A02-sheno1-3,与对照组相比,MDR1基因蛋白表达也明显降低,其中K562/A02-sheno1-2细胞系中MDR1蛋白水平表达最低。
3 讨论
人慢性粒细胞白血病是一种抑制骨髓正常造血功能的恶性肿瘤,一般采用药物治疗和干细胞移植等治疗方法,其治疗效果取决于白血病的分期和病人身体状况等因素[6]。药物治疗过程中肿瘤细胞会产生一定的耐药性,导致治疗失败或复发。肿瘤耐药的产生是一个复杂的、多因素参与的过程,目前研究主要集中于对耐药相关基因MDR1的研究及逆转耐药的方法研究[7-8]。MDR1基因不仅与药物转运功能相关,有效降低肿瘤细胞内药物的浓度,并能有效抑制细胞凋亡[9]。
eno1是烯醇化酶家族成员之一,几乎在人类所有组织中表达,其通常作为金属酶起作用。研究表明,eno1的表达水平与多种生物学功能和疾病相关,如肿瘤,阿尔采末症和肌细胞生成等[10-12]。近年来,eno1成为肿瘤研究领域的热点,eno1作为一种肿瘤标志物,不仅与肿瘤的发生发展相关,也与肿瘤耐药性和侵袭转移等相关,且在多种耐药性肿瘤中,eno1处于过表达状态。Georges等[13]研究发现,在肺癌细胞A549和H460,乳腺癌细胞株MCF-7和卵巢癌CaOV3中干扰eno1能增强细胞对抗肿瘤药物的敏感性。在ER+的乳腺癌细胞中,eno1过表达不仅能促进肿瘤的形成,还能增强乳腺癌耐他莫昔芬细胞对他莫昔芬的敏感性[14]。
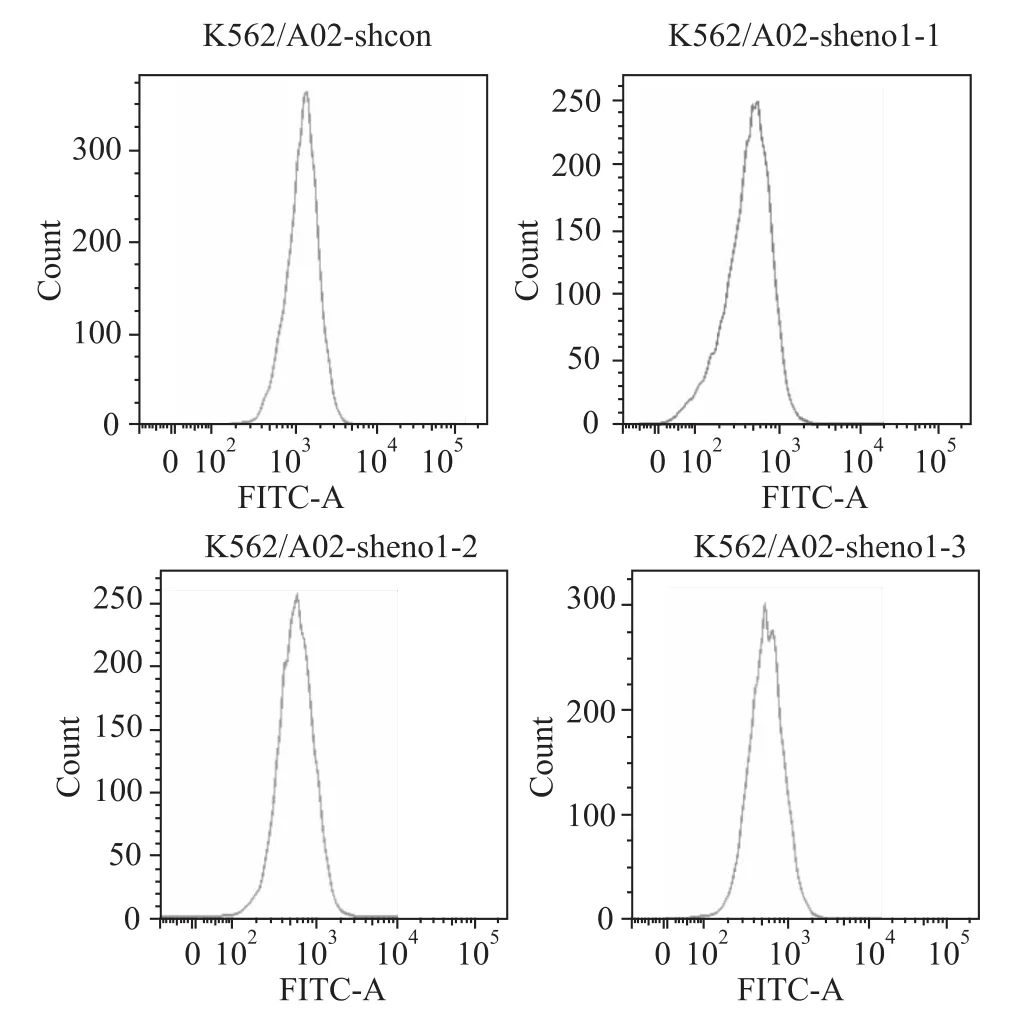
Fig 5 Intra-cellular Rho123 content(detected by flow cytometry)Results showed that Rho123 content decreased in K562/A02-sheno1 cells compared to K562/A02-shcon cells.
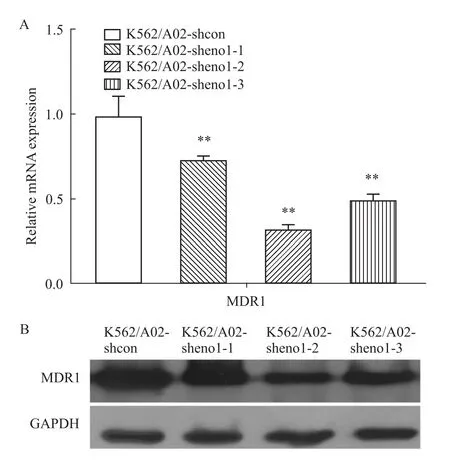
Fig 6 Expression of MDR1 decreases in K562/A02-sheno1 cellsA:The mRNA expression level of eno1 was tested by real-time PCR assay.B:The protein expression level of eno1 was tested by western blot assay.Numerical analysis data represent¯x±s based on three independent experiments,**P<0.01 vs K562/A02-shcon.
人慢性粒细胞白血病耐药细胞株K562/A02由本室筛选并保存,前期研究发现,K562/A02细胞不仅对诱导药物阿霉素表现耐药性,对其他部分抗肿瘤药物也表现一定的耐药性,为多药耐药细胞株,且K562/A02细胞耐药机制为 MDR1基因过表达[15]。本研究发现,与敏感性人慢性粒细胞白血病细胞株K562相比,耐药细胞株 K562/A02中 eno1处于过表达状态,但是K562/A02细胞生长速率与K562细胞无明显差异,表明正常生长状态下,K562/A02细胞内eno1需要处于过表达状态。
本文成功构建3株eno1稳定干扰的细胞系K562/A02-sheno1-1、K562/A02-sheno1-2和 K562/A02-sheno1-3,细胞形态观察发现eno1稳定干扰细胞系 K562/A02-sheno1,与对照组 K562/A02-shcon相比,细胞形态无明显改变,表明eno1在K562/A02细胞中对细胞形态维持无明显影响。
细胞计数法检测发现,eno1稳定干扰后细胞生长速率明显减慢,表明eno1可能与K562/A02细胞生长密切相关。细胞对抗肿瘤药物敏感性实验结果表明,eno1稳定干扰能有效逆转细胞耐药,使抗肿瘤药物紫杉醇和阿霉素对肿瘤细胞的IC50明显降低。进一步检测细胞药物蓄积能力发现,与对照组细胞K562/A02-shcon相比,eno1稳定干扰细胞系K562/A02-sheno1对罗丹明123的外排能力明显增强,细胞内药物蓄积减少。因K562/A02细胞耐药主要由MDR1基因过表达影响,而eno1稳定干扰细胞系其药物外排能力明显增强,表明eno1对K562/A02细胞耐药性影响可能通过调控MDR1基因表达实现。real-time PCR实验和Western blot实验结果表明,eno1稳定干扰细胞系K562/A02-sheno1细胞内MDR1基因在mRNA水平和蛋白水平表达均显著性降低,证明干扰eno1通过有效降低K562/A02细胞中耐药相关基因MDR1表达来增强细胞对抗肿瘤药物的敏感性,减弱细胞对抗肿瘤药物的外排能力。
综上所述,本研究发现,eno1过表达状态是人慢性粒细胞白血病耐药细胞株K562/A02正常生长所必需的条件,干扰eno1后明显抑制K562/A02细胞生长。eno1还可作为逆转人慢性粒细胞白血病耐药细胞株 K562/A02中 MDR1的靶位点,干扰eno1表达,有效降低细胞内耐药相关基因MDR1在mRNA水平和蛋白水平的表达,从而增强耐药细胞对抗肿瘤药物的敏感性。本研究将进一步研究eno1对耐药细胞增强药物敏感性的机制,为人慢性粒细胞白血病耐药治疗提供新线索。
参考文献:
[1] Szakacs G,Paterson J K,Ludwig JA,et al.Targeting multidrug resistance in cancer[J].Nat Rev Drug Discov,2006,5(3):219-34.
[2] Li W J,Zhong SL,Wu Y J,et al.Systematic expression analysis of genes related to multidrug-resistance in isogenic docetaxel-and adriamycin-resistant breast cancer cell lines[J].Mol Biol Rep,2013,40(11):6143-50.
[3] Li Y,Tan B B,Zhao Q,et al.Tumor chemosensitivity is correlated with expression of multidrug resistance associated factors in variously differentiated gastric carcinoma tissues[J].Hepatogastroenterology,2013,60(121):213-6.
[4] Maxwell SA,Cherry E M,Bayless K J.Akt,14-3-3zeta,and vimentin mediate a drug-resistant invasive phenotype in diffuse large B-cell lymphoma[J].Leuk Lymphoma,2011,52(5):849-64.
[5] Yu L,Shi J,Cheng S,et al.Estrogen promotes prostate cancer cell migration via paracrine release of ENO1 from stromal cells[J].Mol Endocrinol,2012,26(9):1521-30.
[6] Bjorkholm M,Ohm L,Eloranta S,et al.Success story of targeted therapy in chronic myeloid leukemia:a population-based study of patients diagnosed in Sweden from 1973 to 2008[J].J Clin Oncol,2011,29(18):2514-20.
[7] Szakacs G,Annereau JP,Lababidi S,et al.Predicting drug sensitivity and resistance:profiling ABC transporter genes in cancer cells[J].Cancer Cell,2004,6(2):129-37.
[8] 赵小琴,符立梧.肿瘤干细胞耐药机制研究进展[J].中国药理学通报,2012,28(12):1637-42.
[8] Zhao X Q,Fu L W.Research progress in mechanisms of drug resistance in cancer stem cells[J].Chin Pharmacol Bull,2012,28(12):1637-42.
[9] Wu C P,Calcagno A M,Ambudkar S V.Reversal of ABC drug transporter-mediated multidrug resistance in cancer cells:evaluation of current strategies[J].Curr Mol Pharmacol,2008,1(2):93-105.
[10]Linge A,Kennedy S,O′Flynn D,et al.Differential expression of fourteen proteins between uveal melanoma frompatients whosubsequently developed distant metastasesversus thosewho did Not[J].Invest Ophthalmol Vis Sci,2012,53(8):4634-43.
[11]Butterfield D A,Lange M L.Multifunctional roles of enolase in Alzheimer′s disease brain:beyond altered glucose metabolism[J].J Neurochem,2009,111(4):915-33.
[12]Lopez-Alemany R,Suelves M,Diaz-Ramos A,et al.Alpha-enolase plasminogen receptor in myogenesis[J].Front Biosci,2005,10:30-6.
[13]Georges E,Bonneau A M,Prinos P.RNAi-mediated knockdown of alpha-enolase increases the sensitivity of tumor cells to antitubulin chemotherapeutics[J].Int J Biochem Mol Biol,2011,2(4):303-8.
[14]Tu S H,Chang C C,Chen C S,et al.Increased expression of enolase alpha in human breast cancer confers tamoxifen resistance in human breast cancer cells[J].Breast Cancer Res Treat,2010,121(3):539-53.
[15]栾凤君,杨纯正,马建国,等.一株人红白血病多药耐药细胞系(K562/A02)的建立及其耐药特性的研究[J].中华肿瘤杂志,1993,15(2):101-3.
[15]Luan F J,Yang C Z,Ma JG,et al.Establishment of the multidrug resistant cell line K562/A02 and its drug resistant properties[J].Chin J Oncol,1993,15(2):101-3.