ILK siRNA对高糖刺激的人肾小管上皮细胞GSK-3β及β-catenin表达的影响*
闫 喆, 姚 芳, 张丽萍, 郝 军, 吴海江, 段惠军△
(河北医科大学1第二医院肾内科,2病理教研室,河北 石家庄 050000)
ILK siRNA对高糖刺激的人肾小管上皮细胞GSK-3β及β-catenin表达的影响*
闫 喆1,2, 姚 芳2, 张丽萍1, 郝 军2, 吴海江2, 段惠军2△
(河北医科大学1第二医院肾内科,2病理教研室,河北 石家庄 050000)
目的:探讨高糖诱导肾小管上皮细胞转分化中整合素连接激酶小干扰RNA(ILK siRNA)对糖原合成酶激酶3β(GSK-3β)磷酸化和β-连环蛋白(β-catenin)核内表达的影响及意义 。方法:体外培养人近端肾小管上皮细胞系HKC,分为正常对照组(NG)、高糖组(HG)、高糖+阴性转染对照组(HG+HK)和高糖+ILK siRNA组(HG+ILK siRNA)。倒置荧光显微镜下观察绿色荧光蛋白表达。RT-PCR及Western blotting检测ILK mRNA及蛋白表达水平;免疫细胞化学检测磷酸化GSK-3β(p-GSK-3β)和β-catenin表达。Western blotting检测总GSK-3β、p-GSK-3β、核β-catenin、总β-catenin、E-钙黏蛋白(E-cadherin)和α-平滑肌肌动蛋白(α-SMA)的表达水平。结果:(1)倒置荧光显微镜下可见绿色荧光蛋白表达,证实构建的siRNA重组质粒成功转染HKC细胞;(2)与HG和HG+ HK组相比,HG+ILK siRNA组ILK mRNA及蛋白水平下降,但较NG组表达仍高;(3)HG+ILK siRNA组ILK基因沉默后,p-GSK-3β与核β-catenin蛋白表达较HG及HG+HK组均下降,但较NG组表达仍高。而总GSK-3β与总β-catenin在各组表达无明显差异。结论:ILK、GSK-3β和β-catenin可能参与了高糖介导的肾小管上皮细胞转分化过程。ILK可能通过调节Wnt/β-catenin途径下游效应蛋白GSK-3β和β-catenin的表达而促使肾小管上皮细胞转分化。
糖尿病肾病;上皮-间充质转化;整合素连接激酶;小干扰RNA;糖原合成酶激酶3β;β-连环蛋白
近年研究发现肾小管间质纤维化程度与糖尿病肾病肾功能下降密切相关[1]。肾小管上皮细胞转分化是肾小管间质纤维化的重要因素。整合素连接激酶(integrin-linked kinase,ILK)是肾小管间质损伤及纤维化最强诱导因子之一[2]。有关肿瘤研究表明ILK可通过抑制糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK-3β)活性、影响β-连环蛋白(βcatenin)核聚集而发挥其生物学效应[3]。而GSK-3β与β-catenin均为Wnt/β-catenin途径下游效应蛋白。在肾小管上皮细胞转分化中 ILK与Wnt/β-catenin途径的关系尚未见报道。本研究利用ILK siRNA转染人肾小管上皮细胞沉默ILK基因,观察ILK、GSK-3β和β-catenin表达水平变化,以探讨三者在糖尿病肾小管间质纤维化中的作用及相互关系。
材料和方法
1 材料
人近端肾小管上皮细胞系HKC(解放军总医院陈香美教授惠赠)。D-葡萄糖 (Sigma),小鼠抗ILK单克隆抗体、兔抗GSK-3β多克隆抗体、小鼠抗βcatenin单克隆抗体和兔抗 E-cadherin多克隆抗体(Santa Cruz)。兔抗p-GSK-3β多克隆抗体(Cell Signalling),小鼠抗α-SMA单克隆抗体(Abcam)。RTPCR试剂(Promega),辣根过氧化物酶标记羊抗兔和羊抗小鼠IgG购自北京中杉金桥公司。核蛋白内参照兔抗组蛋白H1多克隆抗体购自博士德生物工程有限公司。pGenesil-1.1-HK质粒、pGenesil-1.1-ILK siRNA质粒和带有pGenesil-1.1-ILK siRNA质粒的DH5α大肠杆菌菌株(武汉晶赛公司)
2 方法
2.1 ILK siRNA转染及筛选 质粒pGenesil-1.1-ILK siRNA-1、pGenesil-1.1-ILK siRNA-2和pGenesil-1.1-ILK siRNA-3,是针对ILK基因(NM_001014795) 3个不同位点设计的带短发夹结构的siRNA,经酶切鉴定及测序证明质粒均符合设计要求。ILK siRNA-1:5’-GGGGCACGGATCAATGTAA-3’,ILK siRNA-2: 5’-GTACAAGGCAGACATCAAT-3’,ILK siRNA-3: 5’-GACATGACTGCCCGAATTA-3’。HKC细胞共分6组:正常对照(normal glucose,NG)组、高糖(high glucose,HG)组、高糖+阴性转染对照(HG+pGenesil-1.1-HK,HG+HK)组、高糖+pGenesil-1.1-ILK siRNA-1(HG+ILK siRNA-1)组、高糖+pGenesil-1.1-ILK siRNA-2(HG+ILK siRNA-2)组和高糖 + pGenesil-1.1-ILK siRNA-3(HG+ILK siRNA-3)组。
2.2 质粒的细胞转染 脂质体转染法(按照LipofectamineTM2000说明书步骤):HKC细胞按 1× 108/L浓度传于6孔细胞培养板,待细胞长至细胞板80%时弃培养基,每孔中加入DMEM无血清培养液。将10 μL LipofectamineTM2000用 250 μL无血清DMEM稀释,混匀后室温下孵育5 min。取4个离心管中各加入250 μL无血清DMEM培养液,分别加入质粒 pGenesil-1.1-HK、pGenesil-1.1-ILK siRNA-1、pGenesil-1.1-ILK siRNA-2和 pGenesil-1.1-ILK siRNA-3各 4 μg混匀。将质粒加入 LipofectamineTM2000稀释液中,质粒与脂质体比例为1∶2.5混匀,室温下孵育20 min。将上述DNA-脂质体混合物分别加入6孔细胞培养板中,轻摇培养板,充分混匀。37℃、5%CO2培养箱中孵育6 h。6 h后弃培养液,换10%无双抗正常或高糖DMEM培养液继续培养48 h,荧光倒置显微镜下观察绿色荧光蛋白(green fluorescent protein,GFP)的表达,计算转染效率。提取蛋白及RNA。
2.3 RT-PCR和Western blotting 检测转染细胞中ILK mRNA及蛋白表达,筛选敲低效果最明显的ILK-siRNA。
2.3.1 RT-PCR 按照TRIzol试剂说明书提取总RNA,利用Primers软件设计目的基因引物,由上海生工公司合成。ILK上、下游引物分别为5’-ACT GGA TGC CGT ATG GAT-3’和5’-TGT CTG CTG AGC GTC TGT-3’,扩增片段为315 bp;GAPDH上、下游引物分别为5’-TAT CGG ACG CCT GGT TAC-3’和5’-CTG TGC CGT TGA ACT TGC-3’,扩增片段为140 bp;扩增条件为:预变性94℃ 3 min,进入循环,95℃ 45 s,54℃ 80 s,72℃ 60 s,32个循环后72℃8 min。将PCR产物在1.5%琼脂糖凝胶中进行电泳,置于凝胶图像分析系统(UVP公司)进行吸光度扫描,用目的基因的吸光度与GAPDH吸光度的比值代表目的基因的相对表达含量。
2.3.2 Western blotting PBS洗2遍细胞,加入细胞裂解液,冰浴1 h,4℃、12 000 r/min离心20 min,提取细胞总蛋白。取细胞裂解蛋白50 μg,经 SDSPAGE凝胶电泳后电转移至PVDF膜;5%脱脂奶粉封闭PVDF膜2 h,加入小鼠抗ILK单克隆抗体4℃过夜,洗膜后加辣根过氧化物酶标记的抗小鼠抗体(1∶5 000稀释),37℃孵育2 h;洗膜后加ECL试剂,然后将PVDF膜放入X光片暗盒,压片,显影,定影。用UVP公司LabWorks 4.5软件对Western blotting条带进行定量分析。
2.4 根据筛选结果调整细胞分组 正常对照(NG,葡萄糖浓度5.5 mmol/L)组、高糖(HG,葡萄糖浓度30 mmol/L)组、高糖+pGenesil-1.1-HK(HG+HK)组和高糖+pGenesil-1.1-ILK siRNA-3(HG+ILK siRNA-3)组。
2.4.1 免疫细胞化学法检测转染细胞p-GSK-3β和β-catenin表达 按实验分组刺激48 h。2%的多聚甲醛固定细胞,1%H2O2甲醇室温孵育灭活内源性过氧化物酶,0.1%Triton X-100孵育20 min,10%正常山羊血清封闭。加入兔抗p-GSK-3β多克隆抗体(1∶50)和小鼠抗β-catenin单克隆抗体(1∶50),PBS为阴性对照,4℃过夜。滴加辣根过氧化物酶标记的山羊抗小鼠、羊抗兔抗体(1∶50),DAB显色。显微镜观察、拍照,采用HPIAS-1000彩色病理图文系统进行定量分析。p-GSK-3β以胞浆染色为阳性,选取5个不同视野(×200),计算单位面积阳性染色区域平均积分吸光度。β-catenin计数阳性细胞核占一个视野总细胞核的百分比。
2.4.2 Western blotting检测转染48 h细胞中总GSK-3β、p-GSK-3β、β-catenin、E-cadherin和 α-SMA表达 方法同上,核蛋白依据试剂盒说明书提取。
3 统计学处理
数据用均数±标准差(mean±SD)表示,各组间比较采用单因素方差分析,用SPSS 11.5统计软件统计,以P<0.05为差异有统计学意义。
结果
1 转染HKC后绿色荧光蛋白表达
pGenesil-1.1-ILK siRNA-1、pGenesil-1.1-ILK siRNA-2和pGenesil-1.1-ILK siRNA-3转染HKC细胞24 h倒置荧光显微镜下可见绿色荧光蛋白表达,48 h表达量明显增多。这证实构建的pGenesil-1.1-ILK siRNA-1、pGenesil-1.1-ILK siRNA-2和pGenesil-1.1-ILK siRNA-3重组质粒成功转染HKC细胞并能够表达绿色荧光蛋白,转染效率可达60~70%,见图1。

Figure 1.The fluorescent image of GFP protein expression in HKC cells transfected with ILK siRNA(×200).A:pGenesil-1.1-ILK siRNA-1;B:pGenesil-1.1-ILK siRNA-2;C:pGenesil-1.1-ILK siRNA-3.图1 肾小管上皮细胞转染ILK siRNA后绿色荧光蛋白的表达
2HKC转染3个ILK siRNA后ILK mRNA及蛋白的表达
2.1 RT-PCR检测结果 与 HG+HK组相比,pGenesil-1.1-ILK siRNA-1、pGenesil-1.1-ILK siRNA-2和pGenesil-1.1-ILK siRNA-3质粒转染组可见 ILK mRNA水平下降,分别减少36.47%、25.11%及43.15%,但较NG组表达仍高,见图2。这一结果表明,pGenesil-1.1-ILK siRNA-3质粒转染组ILK mRNA水平下降最为明显。
2.2 Western blotting检测结果 pGenesil-1.1-ILK siRNA-1、pGenesil-1.1-ILK siRNA-2、pGenesil-1.1-ILK siRNA-3质粒转染均可引起ILK蛋白表达下降,分别比 HG+HK组减少 41.59%、29.78%和56.12%,但较NG组表达仍高,见图3。这一结果表明,pGenesil-1.1-ILK siRNA-3质粒转染组ILK蛋白水平下降最为明显。
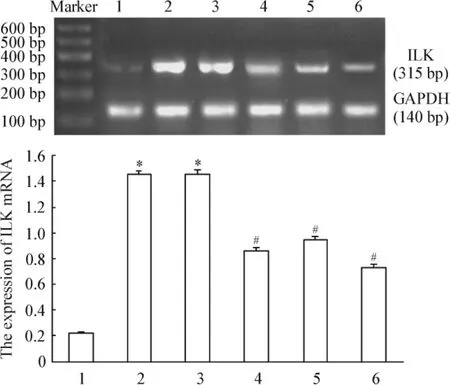
Figure 2.ILK mRNA expression in different groups detected by RT-PCR.1:NG group;2:HG group;3:HG+ pGenesil-1.1-HK group;4:HG+pGenesil-1.1-ILK siRNA-1 group;5:HG+pGenesil-1.1-ILK siRNA-2 group;6:HG+pGenesil-1.1-ILK siRNA-3 group.Mean±SD.n=6.*P<0.05 vs 1;#P<0.05 vs 2 or 3.图2 各组肾小管上皮细胞ILK mRNA表达
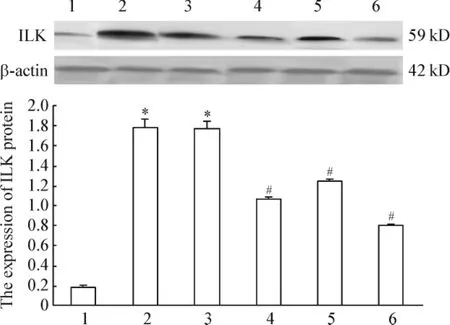
Figure 3.ILK protein expression in different groups detected by Western blotting.1:NG group;2:HG group;3:HG +pGenesil-1.1-HK group;4:HG+pGenesil-1.1-ILK siRNA-1 group;5:HG+pGenesil-1.1-ILK siRNA-2 group;6:HG+pGenesil-1.1-ILK siRNA-3 group.Mean±SD.n=6.*P<0.05 vs 1;#P<0.05 vs 2 or 3.图3 各组肾小管上皮细胞ILK蛋白表达
3 转染最佳敲低效果pGenesil-1.1-ILK siRNA-3后p-GSK-3β和β-catenin的表达
3.1 免疫细胞化学结果 pGenesil-1.1-ILK siRNA-3转染HKC后,p-GSK-3β和核β-catenin表达比HG及HG+HK组表达下降,但较NG组表达仍高,见图4、5和表1。
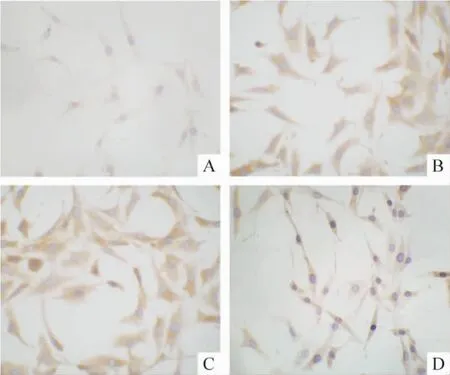
Figure 4.Immunocytochemistry of p-GSK-3β in HKC cells (×400).A:NG group;B:HG group;C:HG+ pGenesil-1.1-HK group;D:HG+pGenesil-1.1-ILK siRNA-3 group.图4 各组肾小管上皮细胞p-GSK-3β表达
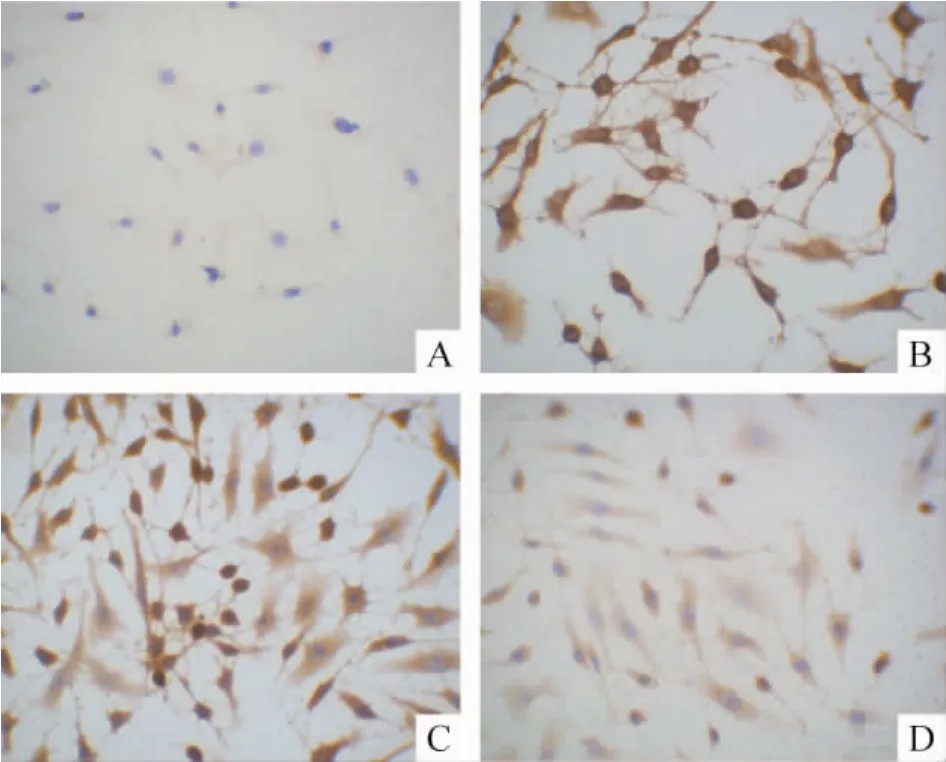
Figure 5.Immunocytochemistry of nuclear β-catenin in HKC cells(×400).A:NG group;B:HG group;C:HG +pGenesil-1.1-HK group;D:HG+pGenesil-1.1-ILK siRNA-3 group.图5 各组肾小管上皮细胞核内β-catenin表达
3.2 Western blotting结果 pGenesil-1.1-ILK siRNA-3转染HKC细胞后p-GSK-3β、核β-catenin及α-SMA均较HG及HG+HK组表达下降,但较NG组表达仍高。总GSK-3β与总β-catenin在各组表达无明显差异。E-cadherin在HG+ILK siRNA-3组的表达较HG及HG+HK组有所升高,但较NG组表达仍低,见图6。
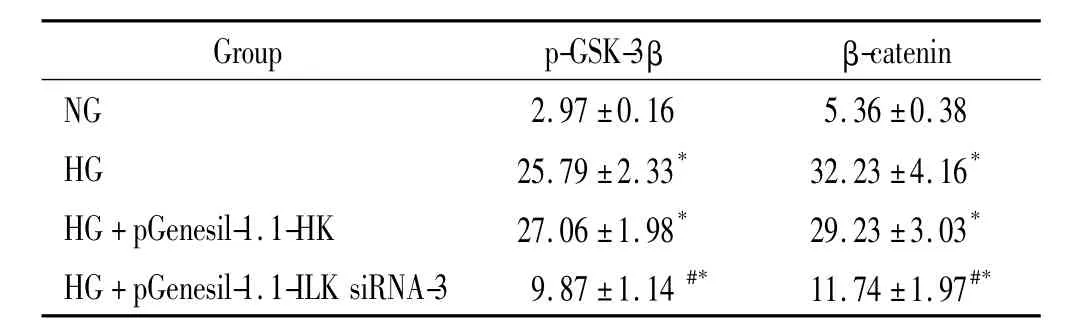
表1 免疫组化检测HKC细胞转染ILK siRNA后p-GSK-3β及核β-catenin蛋白表达Table 1.The expression of p-GSK-3β and nuclear β-catenin in HKC cells transfected with ILK siRNA detected by immunocytochemistry(Mean±SD.n=6)
讨论
肾小管间质纤维化与肾功能下降密切相关[4]。ILK与慢性肾脏病肾小球硬化、肾间质纤维化以及肾小管上皮细胞转分化等关系密切[5-6]。ILK是1996年Hammigan以整合素胞浆域为诱饵,运用酵母双杂交系统发现的一种细胞内的丝氨酸/苏氨酸蛋白激酶,是细胞-细胞外基质连接处的重要分子骨架,对细胞外基质(extracellular matrix,ECM)具有调控作用[7]。ILK可通过多种途径调节上皮细胞向间充质转化(epithelial-mesenchymal transition,EMT)过程。过度表达的外源性ILK导致上皮细胞E-钙黏蛋白的丢失及α-平滑肌肌动蛋白的表达;导致纤维连接蛋白的表达和细胞外积聚;引起基质金属蛋白酶MMP-2的表达和分泌增加,并增加细胞迁移和侵袭力等[8-9]。
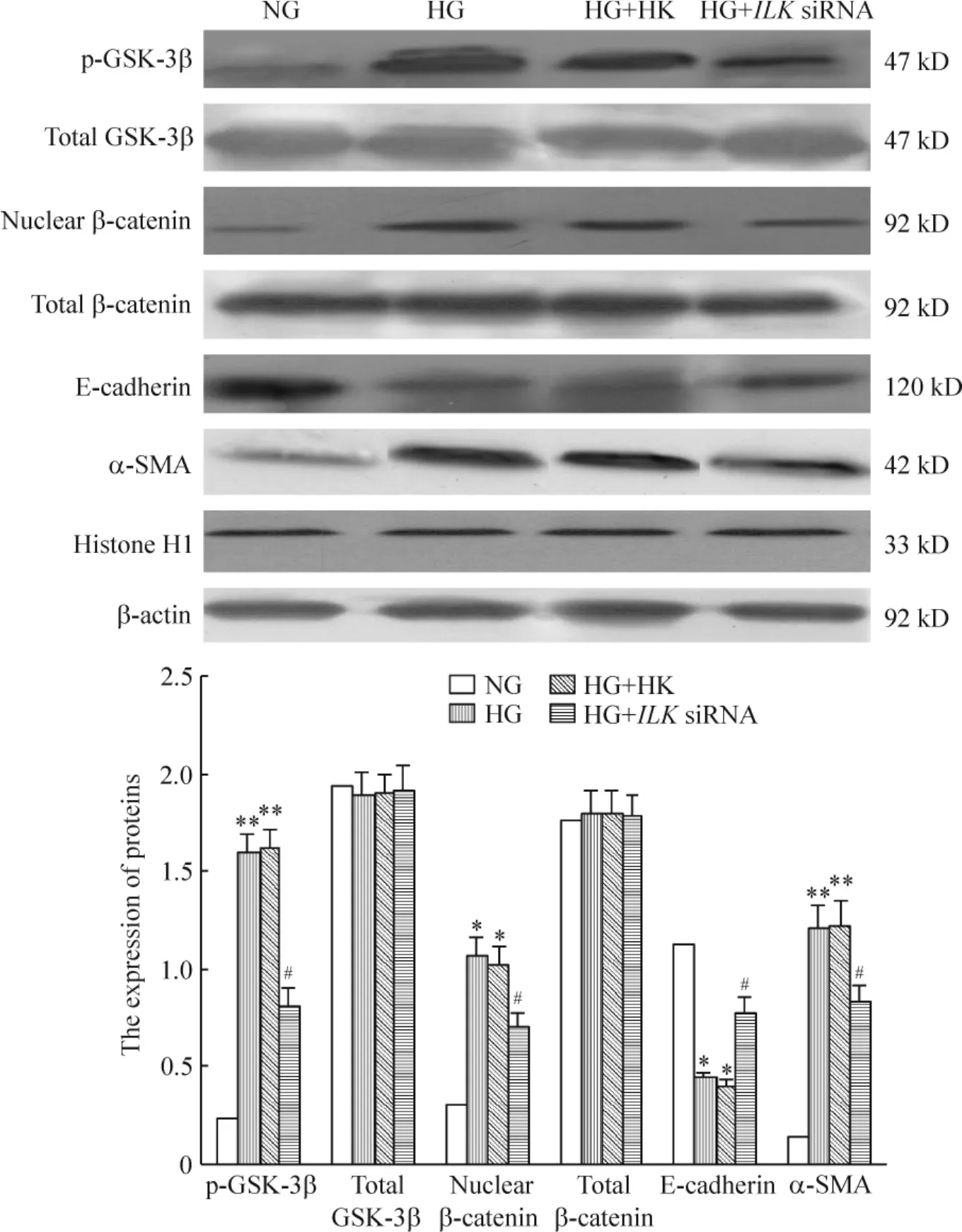
Figure 6.The expression of p-GSK-3β,total GSK-3β,nuclear β-catenin,total β-catenin,E-cadherin and α-SMA in HKC cells transfected with ILK siRNA.Mean±SD.n=6.*P<0.05;**P<0.01 vs NG;#P<0.05 vs HG or HG+HK.图6 各组肾小管上皮细胞p-GSK-3β、总GSK-3β、核β-catenin、总β-catenin、E-cadherin和α-SMA表达
GSK-3β与β-catenin均为Wnt/β-catenin途径下游效应蛋白。在Wnt/β-catenin信号途径未激活情况下,GSK-3β可促使该途径关键信号分子β-catenin泛素化后降解。Wnt/β-catenin途径激活后,GSK-3β磷酸化而活性降低,β-catenin降解减少,打破了其原有的出入核平衡,细胞核内的β-catenin大大增加,与转录因子淋巴样增强子结合因子1/T细胞因子(lymphoid enhancer-binding factor 1/T-cell factor,LEF1/TCF)家族成员结合,促进 EMT的发生[10]。Wnt/β-catenin信号途径不仅参与了肾脏的发育,在肾小球足细胞损伤中也发挥了作用[11]。
有研究表明ILK通过抑制GSK-3β活性而激活Wnt信号途径,对于ILK与Wnt/β-catenin信号途径关系的研究多集中于肿瘤的发病与进展中,ILK的过度表达可直接磷酸化GSK-3β(Ser9)而使其活性降低,使β-catenin降解减少而在胞浆与胞核内聚集,诱导靶基因的表达,促使EMT发生,增强了肿瘤细胞的迁移力与侵袭力[12]。而且,ILK可调控胞核内βcatenin/TCF/LEF1复合体的转录活性,使细胞间黏附及细胞与细胞外基质相互作用发生改变。同时,ILK可下调E-钙黏蛋白转录表达也促使β-catenin由胞膜向胞核的重新分布[13-14]。因而ILK与Wnt信号途径有交叉作用。但在肾小管转分化及肾纤维化过程中二者的关系尚需进一步研究。本研究利用ILK siRNA转染人肾小管上皮细胞沉默ILK基因,发现HKC细胞转染ILK siRNA后,ILK mRNA及蛋白表达均降低。GSK-3β磷酸化水平及胞核β-catenin表达较未转染高糖组和阴性转染对照组均降低。ILK siRNA能够逆转由高糖刺激的E-cadherin表达降低,同时下调α-SMA表达。据此认为ILK基因沉默后,改变了Wnt途径下游因子GSK-3β和β-catenin的表达活性,一定程度上阻止了高糖诱导的肾小管细胞转分化过程。
综上所述,ILK可能通过调节Wnt/β-catenin途径下游因子GSK-3β及β-catenin的表达,参与肾小管上皮细胞转分化过程。本研究为进一步控制糖尿病肾病肾小管间质纤维化进展提供了新的思路。
[1]Hills CE,Squires PE.The role of TGF-β and epithelial-to mesenchymal transition in diabetic nephropathy[J].Cytokine Growth Factor Rev,2011,22(3):131-139.
[2]Yan Q,Sui W,Xie S,et al.Expression and role of integrin-linked kinase and collagen IV in human renal allografts with interstitial fibrosis and tubular atrophy[J].Transpl Immunol,2010,23(1-2):1-5.
[3]Bagnato A,Rosanò L.Epithelial-mesenchymal transition in ovarian cancer progression:a crucial role for the endothelin axis[J].Cells Tissues Organs,2007,185(1-3):85-94.
[4]Liu Y.New insights into epithelial-mesenchymal transition in kidney fibrosis[J].J Am Soc Nephrol,2010,21(2): 212-222.
[5]Li Y,Tan X,Dai C,et al.Inhibition of integrin-linked kinase attenuates renal interstitial fibrosis[J].J Am Soc Nephrol,2009,20(9):1907-1918.
[6]戴厚永,郑 敏,汤日宁,等.厄贝沙坦对早期糖尿病肾病大鼠足细胞损伤及整合素连接激酶的影响[J].中国病理生理杂志,2010,26(11):2175-2179.
[7]Boulter E,Van Obberghen-Schilling E.Integrin-linked kinase and its partners:a modular platform regulating cellmatrix adhesion dynamics and cytoskeletal organization[J].Eur J Cell Biol,2006,85(3-4):255-263.
[8]McPhee TR,McDonald PC,Oloumi A,et al.Integrinlinked kinase regulates E-cadherin expression through PARP-1[J].Dev Dyn,2008,237(10):2737-2747.
[9]Cortez V,Nair BC,Chakravarty D,et al.Integrin-linked kinase 1:role in hormonal cancer progression[J].Front Biosci(Schol Ed),2011,3:788-796.
[10]Saito-Diaz K,Chen TW,Wang X,et al.The way Wnt works:components and mechanism[J].Growth Factors,2013,31(1):1-31.
[11]周 静,袁伟杰,谢院生,等.siRNA沉默WT1对小鼠足细胞Wnt/β-catenin和nephrin表达的影响[J].中国病理生理杂志,2013,29(2):219-224.
[12]Joshi MB,Ivanov D,Philippova M,et al.Integrin-linked kinase is an essential mediator for T-cadherin-dependent signaling via Akt and GSK3β in endothelial cells[J].FASEB J,2007,21(12):3083-3095.
[13]Bravou V,Klironomos G,Papadaki E,et al.ILK over-expression in human colon cancer progression correlates with activation of beta-catenin,down-regulation of E-cadherin and activation of the Akt-FKHR pathway[J].J Pathol,2006,208(1):91-99.
[14]Engelman M de F,Grande RM,Naves MA,et al.Integrin-linked kinase(ILK)expression correlates with tumor severity in clear cell renal carcinoma[J].Pathol Oncol Res,2013,19(1):27-33.
Role of ILK siRNA on expression of GSK-3β and β-catenin in human tubular epithelial cells stimulated by high glucose
YAN Zhe1,2,YAO Fang2,ZHANG Li-ping1,HAO Jun2,WU Hai-jiang2,DUAN Huijun2
(1Department of Nephrology,The Second Hospital,2Department of Pathology,Hebei Medical University,Shijiazhuang 050000,China.E-mail:duanhj999@163.com)
AIM:To investigate the effects of siRNA targeting integrin-linked kinase(ILK)on the expression of glycogen synthase kinase 3β(GSK-3β)and β-catenin during epithelial-mesenchymal transition(EMT)in human kidney proximal tubular epithelial cell line HKC induced by high glucose.METHODS:HKC cells were divided into 4 groups:normal glucose(NG)group,high glucose(HG)group,HG+HK(a vector containing the non-specific siRNA designed as negative control)group and HG+ILK siRNA group.The inverted fluorescence microscope was used to examine the expression of green fluorescent protein(GFP).The expression of ILK at mRNA and protein levels was detected by RTPCR and Western blotting.The expression of p-GSK-3β and β-catenin was observed by immunocytochemical staining.The protein expression of total GSK-3β,p-GSK-3β,nuclear β-catenin,total β-catenin,E-cadherin and α-smooth muscle actin (α-SMA)was measured by Western blotting.RESULTS:GFP was observed in HKC cells,indicating that the transfection was successful.Both the protein and mRNA of ILK were down-regulated in HG+ILK siRNA group compared with HG group and HG+HK group,but still higher than those in NG group.Silencing of ILK down-regulated the expression of p-GSK-3β and nuclear β-catenin.No difference of total GSK-3β or total β-catenin was observed among the 4 groups.CONCLUSION:These data support a functional role of ILK,GSK-3β and β-catenin in tubular EMT induced by high glucose.ILK may promote tubular EMT by regulating the activity of GSK-3β and β-catenin,the downstream effectors of the Wnt/βcatenin pathway.
Diabetic nephropathies;Epithelial-mesenchymal transition;Integrin-linked kinase;Small interfering RNA;Glycogen synthase kinase 3β;β-catenin
R363
A
10.3969/j.issn.1000-4718.2014.03.020
1000-4718(2014)03-0503-06
2013-10-10
2014-01-06
河北省卫生厅课题(No.08282)
△通讯作者Tel:0311-86265724;E-mail:duanhj999@163.com

