人胰腺癌PANC-1细胞裸鼠移植瘤模型建立及其用于观察载siRNA纳米微粒体内效应的研究*
曾林涓, 李景果, 张秋波, 钱辰琛, 林 忠, 陈茵婷, 黄开红
(中山大学附属第五医院肿瘤内科,广东珠海 519000)
人胰腺癌PANC-1细胞裸鼠移植瘤模型建立及其用于观察载siRNA纳米微粒体内效应的研究*
曾林涓, 李景果, 张秋波, 钱辰琛, 林 忠, 陈茵婷△, 黄开红△
(中山大学附属第五医院肿瘤内科,广东珠海 519000)
目的:探讨建立人胰腺癌PANC-1裸鼠移植瘤模型的最佳实验方法,并应用该模型进行载基因纳米微粒体内效应的研究。方法:将不同数量PANC-1细胞悬液接种于BALB/c(nu/nu)小鼠右侧背部皮下,当肿瘤体积达100 mm3时尾静脉注射siRNACY5.5纳米复合物进行活体荧光成像。此外,于尾静脉注射负载siRNAKras纳米复合物,蛋白印迹及免疫组织化学染色法观察肿瘤组织Kras蛋白表达水平。结果:1×107cells/300 μL接种成瘤率达100%,成瘤时间<2周。荧光呈像及组织学检查显示载siRNA纳米微粒可靶向聚集在肿瘤组织发挥体内基因沉默效应。结论:本研究报道的人胰腺癌裸鼠移植瘤模型建立方法成瘤率达100%,成瘤时间短,是研究药物示踪和观察疗效的理想模型。
胰腺肿瘤;模型,动物;纳米微粒;RNA干扰
胰腺癌(pancreatic cancer,PA)是一类恶性度高、进展快、预后极差的消化道肿瘤,严重危害人类身体健康。早期根治性手术切除是可能治愈PA的唯一手段,但是,绝大多数PA患者就诊时已属晚期,失去手术机会,PA早诊率和长期生存率均不到5%。利用纳米载体靶向肿瘤组织进行化学药物治疗、基因治疗或者携带影像对比剂进行肿瘤诊断是近年来的研究热点[1]。建立动物移植瘤模型是进行纳米抗肿瘤研究中不可缺少的实验环节。在本实验中,我们通过确定最佳接种条件,使得人胰腺癌裸鼠移植瘤模型在2周内100%成瘤,为进一步实验奠定基础。
材料和方法
1 细胞株
人胰腺癌细胞株PANC-1购自上海细胞生物学研究所,用含10%胎牛血清、4 mmol/L L-谷氨酰胺、1×105U/L青霉素和100 mg/L链霉素的DMEM(高糖)培养基在37℃、5%CO2温箱中培养。
2 动物
4~5周龄雌性BALB/c(nu/nu)小鼠购自中山大学实验动物中心[许可证号为SCXK(粤)2011-0029]。实验过程中对动物的处置符合医学伦理学标准,并饲养于该实验中心SPF级屏蔽环境中,小鼠分笼饲养,4~5只/笼,自由饮水和进食。
3 主要试剂
纳米载体PEG-PLL由中山大学化工学院提供,具体合成方法及表征参见文献[2]。DMEM培养基购自Gibco,针对突变Kras基因siRNA(siKras)及阴性对照siRNA(scrambled control RNA,SCR)由上海吉玛公司设计合成,CY5.5标记的阴性对照 siRNA (siCY5.5)由广州锐博公司设计合成。KrasⅠ抗购自Gene Tex。
siKras正义链5’-AGUUGGAGCUGAUGGCGUA dTdT-3’,反义链3’-dTdT UCAACCUCGACUACCGCAU-5’;SCR正义链 5’-UUCUCCGAACGUGUCACGUTT-3’,反义链 3’-TTAAGAGGCUUGCACAGUGCA-5’。
4 主要方法
4.1 人胰腺癌BALB/c(nu/nu)小鼠皮下移植瘤模型的建立 将PANC-1细胞用PBS制成细胞悬液,分别取1×106cells/100μL PBS、5×106cells/100μL PBS、1×107cells/100μL PBS、1×107cells/300μL PBS液接种于BALB/c(nu/nu)小鼠右侧背部皮下,每3 d用游标卡尺测量肿瘤大小,肿瘤体积(mm3)= L×W2/2,其中L为肿瘤长径,W为与L垂直的最短径(单位均为mm),观察时间为5周。
4.2 活体荧光成像 当肿瘤体积达100 mm3时随机选取3只荷瘤鼠进行活体成像实验。小动物活体荧光成像仪(Carestream In Vivo Fx Pro.)用于观察PEG-PLL/siCY5.5纳米微粒(nanoparticles,NPs)在体内的分布。将75 μg PEG-PLL和20 μg siCY5.5混合,室温静置20 min以制备PEG-PLL/siCY5.5复合物(siCY5.5-NPs),然后将复合物用等量PBS稀释后经尾静脉缓慢注入。分别在注射前以及注射后2、6、24 h采集荧光图像,注射前采集的图像用以扣除动物自身发出的荧光。在预设的时点将动物安乐死,取出肿瘤组织和心、肝、肾等器官,再次进行荧光成像。
4.3 激光共聚焦显微镜观察 将肿瘤组织冰冻包埋,-20℃条件进行冰冻切片,连续制备6 μm组织切片,在激光共聚集显微镜(Zeiss)下观察荧光物质的分布。
4.4 载siRNA纳米微粒的体内效应 当肿瘤体积达100 mm3时随机选取18只荷瘤鼠随机分为3组(每组6只)进行体内基因沉默实验,分别于尾静脉注射(1)PBS;(2)PEG-PLL/SCR(SCR-NPs);(3) PEG-PLL/siKras(siKras-NPs),siRNA用量为每只动物20 μg。1周以后将荷瘤鼠安乐死,剖出肿瘤组织称重,并进行蛋白质印迹实和免疫组织化学染色观察肿瘤组织Kras蛋白表达水平。
4.4.1 蛋白质印迹法检测移植瘤中Kras蛋白的表达 常规方法抽提组织总蛋白,用BCA法进行蛋白含量测定,取50 μg蛋白于12%SDS-PAGE,后恒流60 min转移至PVDF膜,5%脱脂奶室温封闭2 h,加入目的蛋白和内参蛋白Ⅰ抗,于4℃摇床孵育过夜,加入HRP标记Ⅱ抗,室温孵育2 h,把PVDF膜置于曝光盒内,均匀涂上化学发光液,盖上胶片,暗室内曝光0.5~5 min后显影、定影,观察条带。用ImageJ软件对获得的条带进行灰度值分析,以GAPDH为内参照,以目的/内参照比值来比较其表达差异。
4.4.2 免疫组织化学染色 新鲜剥离的肿瘤组织用4%多聚甲醛固定,石蜡包埋,6 μm连续切片10张,分别进行HE染色及免疫组化染色。KrasⅠ抗工作液浓度为1∶100,以PBS代替第Ⅰ抗体作阴性对照,显色剂为DAB。
5 统计学处理
用SPSS 17.0统计软件分析。数据用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD法),以P<0.05为差异有统计学意义。
结果
1 人胰腺癌BALB/c(nu/nu)小鼠皮下移植瘤成瘤时间及体积
接种细胞数量及细胞悬液体积明显影响成瘤率及成瘤时间,5×106cells/100 μL PBS成瘤率低、成瘤时间长,1×107cells/100 μL PBS成瘤率有较大提高,但成瘤时间仍超过3周,以1×107cells/300 μLPBS接种成瘤效果最好,成瘤率达100%,成瘤时间短(<2周),见图1、2和表1。3周时移植瘤肉眼可见溃疡发生率为0%,而至5周时,则30%的移植瘤发生溃疡,见图3。
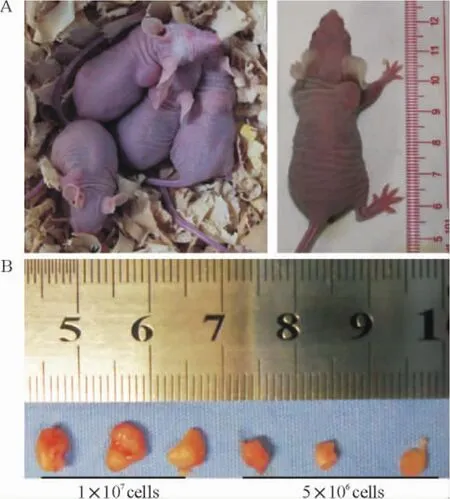
Figure 1.The subcutaneous PANC-1 xenograft model in BALB/c (nu/nu)mice.A:mice inoculated with PANC-1 cells (1×107cells/300 μL)for 2 weeks;B:the excised tumors after inoculated with PANC-1 cells(5×106cells/100 μL or 1×107cells/300 μL)for 3 weeks.图1 不同接种条件建立的裸鼠移植瘤模型
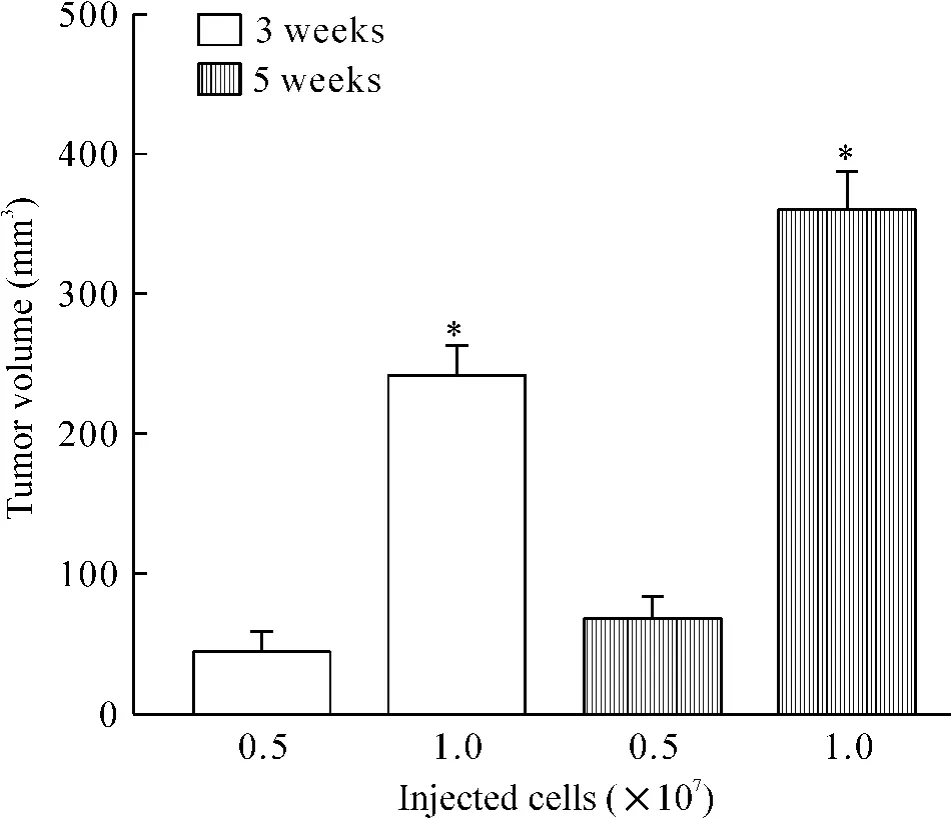
Figure 2.The number of inoculated PANC-1 cells affected the volume of xenograft tumor.Mean±SD.n=20.*P<0.05 vs 5×106cells.图2 接种不同数量PANC-1细胞3周和5周后移植瘤体积的变化

表1 不同接种条件的成瘤率及成瘤时间Table 1.Tumor development after injection with different numbers of PANC-1 cells

Figure 3.The xenograft tumors tended to necrosis(ulcer,black arrow)as the inoculation time prolonged图3 随成瘤时间延长,移植瘤发生溃疡增多
2 药物在肿瘤组织中的分布
如图4A所示,siCY5.5-NPs经尾静脉注射2 h后可清晰显示出肿瘤形态,提示纳米微粒在肿瘤区域聚集(红色箭头指示),至6 h,肝脏摄取的纳米微粒经代谢有所减少(白色箭头指示),但肿瘤组织中的荧光信号未见明显减弱,提示纳米微粒被阻滞在肿瘤组织中。至24 h,活体荧光成像采集的荧光强度已明显减弱,因此24 h为实验终点,将荷瘤鼠安乐死,剖出肿瘤组织及重要器官(如心脏、肝脏、脾脏、肾脏),用生理盐水清洗去除血液后再次进行荧光成像。如图4B所示,离体荧光成像显示肿瘤组织的荧光强度最强,经肝脏及肾脏排泄,心脏及脾脏中基本没有纳米微粒滞留,与活体荧光呈像结果一致。肿瘤组织切片的激光共聚焦显微镜检查进一步证实了siCY5.5-NPs在肿瘤细胞内的分布,见图4C。以上结果显示,载siRNA NPs可靶向聚集在肿瘤组织并将siRNA输送入肿瘤细胞。
3 药物的体内效应
为了证实以纳米载体导入的siRNA能够在体内诱导出基因干扰效应,3组荷瘤鼠(n=6)分别经尾静脉注射PBS(对照组)、SCR-NPs以及siKras-NPs。如图5所示,siKras-NPs处理组肿瘤组织重量和Kras蛋白表达水平较PBS和SCR-NPs处理组均降低,而SCR-NPs处理组对Kras表达没有影响。
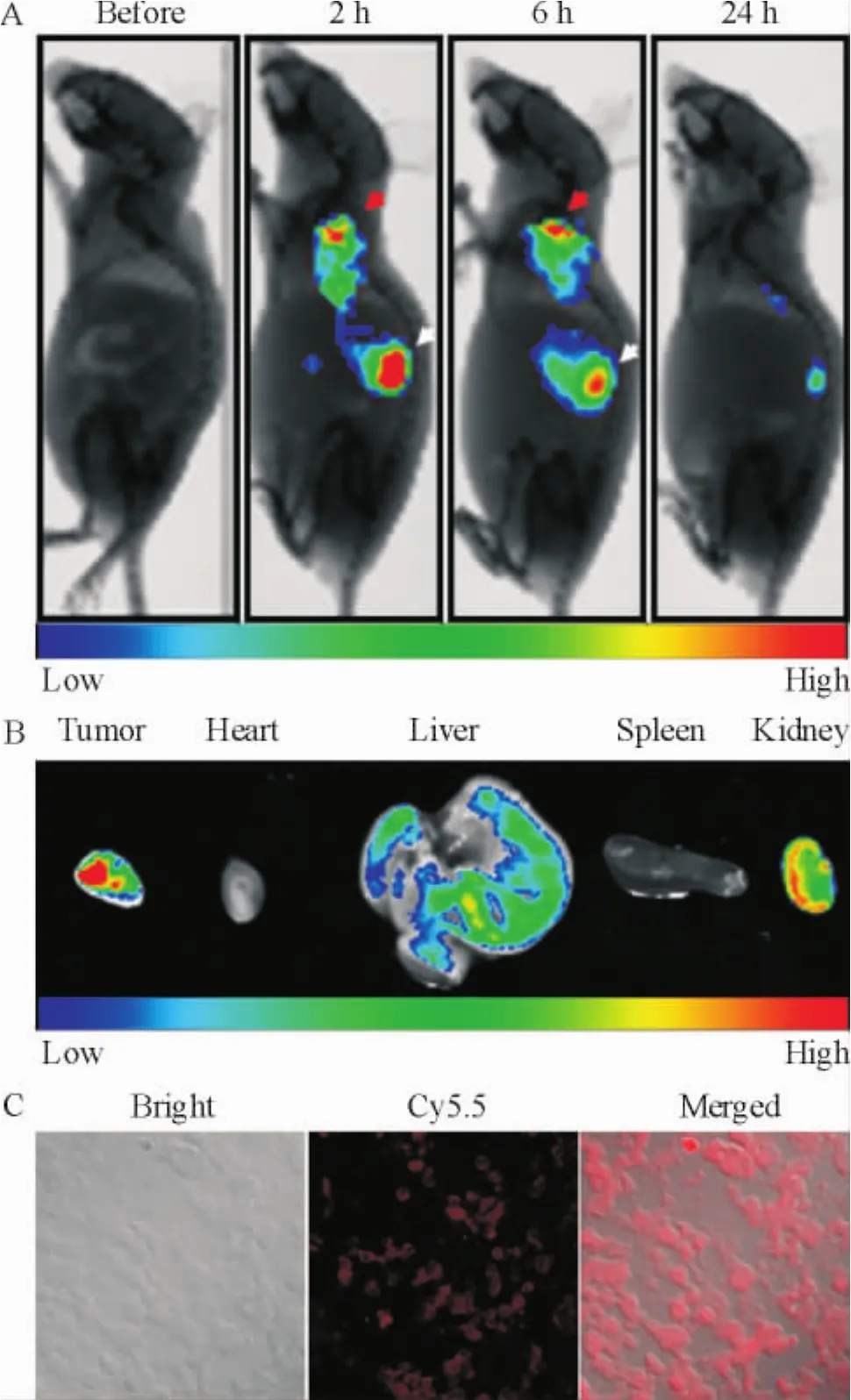
Figure 4.The biodistribution of siCY5.5-NPs in mice after injection through tail veins.A:in vivo imaging of tumorbearing mice injected with siCY5.5-NPs;B:siCY5.5-NPs accumulated in different organs;C:siCY5.5-NPs were captured by tumor cells as observed under a laser scanning confocal microscope.The color bars(from red to blue)indicate the change of fluorescence intensity from high to low.图4 尾静脉注射siCY5.5-NPs不同时点荷瘤鼠体内的分布
讨论
PANC-1细胞株是最常用的人胰腺癌细胞株之一,基因表型为Kras、p53和p16基因突变,其生物学特性包括较强的黏附、转移和侵袭能力;分泌较高水平的血管内皮生长因子等[3]。但是,根据已有的实验报道,PANC-1皮下移植瘤成瘤时间大于6周[4],甚至有长达4个月才成瘤者[5]。影响移植瘤成瘤的因素,除肿瘤细胞本身致瘤性强弱外,接种的细胞数量也是关键。我们的结果显示不同接种细胞数量成瘤率及成瘤体积1×107细胞>5×106细胞>1×106细胞。此外,我们的实验还发现用于接种的细胞悬液体积显著影响成瘤时间。尽管1×107cells/100 μL与1×107cells/300 μL最终都可达到目标肿瘤体积(100 mm3),但后者所用时间明显缩短,这可能是因为适当的液体环境,为肿瘤细胞提供了生长空间,更有利于移植瘤的种植。成瘤时间是影响实验结果的另一重要因素。实体瘤新生血管丰富,血管内皮结构、功能尚不完善,导致血管内皮细胞间隙较宽,因此大分子物质(如纳米微粒)具有选择性通过肿瘤组织血管内皮并在肿瘤组织中滞留的特性,这种现象称为“增强渗透和滞留效应”(enhanced permeability and retention effect,EPR effect)[6]。纳米微粒通过EPR效应在肿瘤组织中聚集,称为纳米微粒对肿瘤的“被动靶向性”。因此,移植瘤模型的血管密度、血管内皮间隙是影响纳米微粒在肿瘤组织中聚集的关键因素。研究表明,成瘤时间为3周以内的血管密度最高,随成瘤时间延长,移植瘤的新生血管密度下降[7]。另外,由于新生血管减少,当成瘤大于6周时肿瘤组织容易发生坏死,影响药效评价[7]。我们的结果也证实成瘤3周时无肉眼可见溃疡发生,但延长至5周则30%的移植瘤发生溃疡。因此,成瘤时间过长的移植瘤模型不适用于药效评价及影像学成像等实验。
当基因或药物被纳米载体输送至肿瘤细胞,要获得最大的基因沉默效应或细胞毒作用,最关键的一点是基因或药物能够被带入到每个肿瘤细胞内。临床上,很难在早期发现胰腺癌,而且对化疗反应性低下原因之一是胰腺癌周围致密肿瘤基质的保护作用。我们的结果证实,siRNA-NPs不仅能够聚集在肿瘤组织(图4B,肿瘤中心区域荧光最强),而且有效地进入到了肿瘤细胞内(图4C)。蛋白印迹及免疫组化检测进一步证实纳米载体携带的siRNAs在体内有效地发挥靶基因沉默效应。我们课题组利用此方法批量建立起来的胰腺癌皮下移植瘤模型,分别进行了靶向纳米砷剂抗胰腺癌的体内研究,和纳米砷联合siRNA治疗胰腺癌的体内研究[2,8]。两项研究均证实药物或siRNA可较长时间地聚集在肿瘤部位,发挥抗瘤效应。而另一实验则显示参考此方法建立的胃癌模型对MRI影像对比剂有良好的反应性[9]。
本研究结果显示,人胰腺癌裸鼠移植瘤模型建立方法成瘤率达100%,而且短期内即可成瘤,成瘤质量好,是研究药物示踪、观察疗效的理想模型,增加结果的可信性与可重复性,为今后的研究打下基础。
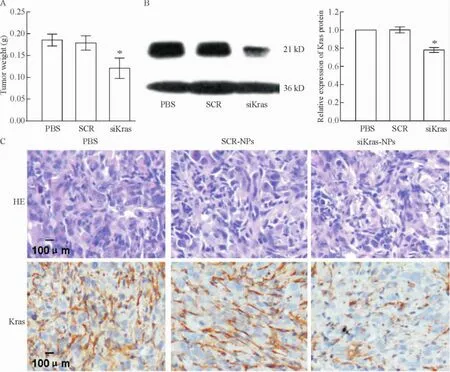
Figure 5.The in vivo effects of siRNA-NPs.A:seven days after treatment,the mice were sacrificed and the tumor weight was measured;B:Western blotting analysis of Kras expression in PANC-1 tumors;C:representative images of histopathological analysis of each dissected tumor tissue.Mean±SD.n=6.*P<0.05 vs SCR.图5 载siRNA纳米微粒的体内效应
[1]傅岳武,潘运龙,覃 莉,等.纳米金抑制Ang-2和RGS-5表达导致裸鼠肝癌血管正常化[J].中国病理生理杂志,2011,27(12):2247-2252.
[2]Zeng L,Li J,Wang Y,et al.Combination of siRNA-directed Kras oncogene silencing and arsenic-induced apoptosis using a nanomedicine strategy for the effective treatment of pancreatic cancer[J].Nanomedicine,2014,10 (2):463-472.
[3]Deer EL,Gonzalez-Hernandez J,Coursen JD,et al.Phenotype and genotype of pancreatic cancer cell lines[J].Pancreas,2010,39(4):425-435.
[4]Freeman JW,Mattingly CA,Strodel WE.Increased tumorigenicity in the human pancreatic cell line MIA PaCa-2 is associated with an aberrant regulation of an IGF-1 autocrine loop and lack of expression of the TGF-beta type RII receptor[J].J Cell Physiol,1995,165(1):155-163.
[5]Diaz VM,Planaguma J,Thomson TM,et al.Tissue plasminogen activator is required for the growth,invasion, and angiogenesis of pancreatic tumor cells[J].Gastroenterology,2002,122(3):806-819.
[6]Fang J,Nakamura H,Maeda H.The EPR effect:unique features of tumor blood vessels for drug delivery,factors involved,and limitations and augmentation of the effect[J].Adv Drug Deliv Rev,2011,63(3):136-151.
[7]Ho KS,Poon PC,Owen SC,et al.Blood vessel hyperpermeability and pathophysiology in human tumour xenograft models of breast cancer:a comparison of ectopic and orthotopic tumours[J].BMC Cancer,2012,12:579.
[8]Qian C,Wang Y,Chen Y,et al.Suppression of pancreatic tumor growth by targeted arsenic delivery with anti-CD44v6 single chain antibody conjugated nanoparticles[J].Biomaterials,2013,34(26):6175-6184.
[9]Chen Y,Lian G,Liao C,et al.Characterization of polyethylene glycol-grafted polyethylenimine and superparamagnetic iron oxide nanoparticles(PEG-g-PEI-SPION)as an MRI-visible vector for siRNA delivery in gastric cancer in vitro and in vivo[J].J Gastroenterol,2013,48(7): 809-821.
Establishment of human pancreatic tumor xenograft mouse model for evaluating tumor-homing and gene-silencing effects of siRNA-loading nanoparticles
ZENG Lin-juan,LI Jing-guo,ZHANG Qiu-bo,QIAN Chen-chen,LIN Zhong,CHEN Yinting,HUANG Kai-hong
(Department of Oncology,The Fifth Affiliated Hospital of Sun Yat-sen University,Zhuhai 519000,China.E-mail:chenyt58 @mail.sysu.edu.cn;huangkh@mail.sysu.edu.cn)
AIM:To establish an effective and rapid method to develop transplanted subcutaneous pancreatic carcinoma by inducing PANC-1 cells into nude mice,and then use this mouse model to evaluate the tumor-homing and gene-silencing effects of siRNA-loading nanoparticles in vivo.METHODS:Different numbers of PANC-1 cells in 100 μL or 300 μL PBS were inoculated subcutaneously into the right flank of BALB/c(nu/nu)mice.When the tumor volume reached 100 mm3,siRNACY5.5nanoparticles were injected through the mouse tail vein to perform in vivo imaging assay.Besides,the mice were randomly divided into 3 treatment groups treated with PBS,scrambled control RNA nanoparticles and siKras nanoparticles,respectively.The protein expression of Kras was detected by Western blotting and immunohistochemical staining.RESULTS:After inoculated with 1×107PANC-1 cells in 300 μL PBS,all mice developed tumors within 2 weeks.The in vivo results showed that siRNA-loading nanoparticles accumulated in the tumor tissues and exerted gene silencing effect.CONCLUSION:In the present study,an effective and rapid method was established for PANC-1 cells to induce transplanted subcutaneous pancreatic carcinoma in nude mice within 2 weeks,which is suitable for in vivo imaging and treatment evaluations as a reproducible and reliable way for the further experiments.
Pancreatic neoplasms;Models,animal;Nanoparticles;RNA interference
R363
A
10.3969/j.issn.1000-4718.2014.03.034
1000-4718(2014)03-0572-05
2013-10-16
2014-01-07
国家自然科学基金资助项目(No.81072045;No.81302140);广东省产学研资助项目(No.2009B090300277);珠
海市科技计划(No.2013D0401990026)
△通讯作者Tel:020-81332489;E-mail:陈茵婷chenyt58@mail.sysu.edu.cn;黄开红huangkh@mail.sysu.edu.cn

