VEGF在SD大鼠Walker-256肝转移瘤模型建立中的应用*
刘 妮, 杨建勇, 黄勇慧, 陈 斌, 陈 伟, 李家平
(中山大学附属第一医院放射介入科,广东广州 510080)
VEGF在SD大鼠Walker-256肝转移瘤模型建立中的应用*
刘 妮, 杨建勇, 黄勇慧△, 陈 斌, 陈 伟, 李家平
(中山大学附属第一医院放射介入科,广东广州 510080)
目的:探讨采用血管内皮细胞生长因子(VEGF)缩短SD大鼠Walker-256肝转移瘤成模时间的安全性与可行性,为抗VEGF靶向药物的研究提供更实用的模型。方法:将SD大鼠随机分为3组,每组各15只。生理盐水(NS)模型组:于建模前1周开始尾静脉注射生理盐水0.1 mL/d;20 mg/L VEGF模型组:于建模前1周开始尾静脉注射20 mg/L VEGF(0.1 mL/d);40 mg/L VEGF模型组于建模前1周开始尾静脉注射40 mg/L VEGF(0.1 mL/d)。各组均注射至建模当天。建模方法:暴露大鼠肝脏,将瘤块种植于肝包膜下。分别于建模后3 d、1周和2周用磁共振成像(MRI)观察肿瘤生长情况,并记存活时间。结果:建模成功,肝内肿块HE染色符合恶性肿瘤特点。大鼠肝脏MRI表现:肿块呈结节状,T2WI呈稍高信号,显示更为清楚,腹水于T2WI呈高信号。NS模型组和20 mg/L VEGF模型组各有1只动物于建模后1 d死亡,40 mg/L VEGF模型组有3只于建模1周后死亡。建模后3 d各组可观察到肿块的大鼠数分别为:NS模型组0只,20 mg/L VEGF模型组7只,40 mg/L VEGF模型组10只;建模后1周各组可观察到肿块的大鼠数分别为:NS模型组3只,20 mg/L VEGF模型组14只,40 mg/L VEGF模型组13只;建模后2周各组可观察到肿块的大鼠数分别为:NS模型组12只,20 mg/L VEGF模型组14只,40 mg/L VEGF模型组10只。20 mg/L VEGF模型组和40 mg/L VEGF模型组分别与NS模型组相比,3 d可观察到成瘤的老鼠数目差异均有统计学意义(P<0.05)。NS模型组与20 mg/L VEGF模型组大鼠存活时间差异无统计学意义(P>0.05),40 mg/L VEGF模型组存活时间短于NS模型组(P<0.01)。结论:20 mg/L VEGF能缩短SD大鼠肝转移瘤成模时间,对其存活时间无显著影响,且相较于传统模型,更适合应用于抗VEGF靶向药物的研究。
肝转移瘤;模型,动物;血管内皮生长因子
目前有大量动物实验研究为肝癌的临床治疗提供基础依据[1]。在这些研究中,肝癌动物模型一直是肝癌相关临床与基础研究工作的重要工具。理想的动物模型建立是研究肿瘤发生、发展、转移及疗效的重要手段。SD大鼠Walker-256肝转移瘤模型是常用的一种,目前此模型的建立已有较成熟的方法[2],但是如何在此基础上缩短成瘤时间,提高实验效率,近10年来并无较大进展。且随着血管内皮细胞生长因子 (vascular endothelial growth factor,VEGF)靶向药物的研究问世,VEGF在肿瘤发展中的作用越来越受到重视,如何使模型更适合抗VEGF药物的相关研究也并无报道。本文旨在探讨VEGF在SD大鼠Walker-256肝转移瘤模型中应用的安全性与可行性,以期缩短成瘤时间,并使其更接近地模拟肿瘤发展过程中VEGF的变化,为相关抗VEGF靶向药物的基础研究提供更实用的动物模型。
材料和方法
1 动物与瘤株
2周龄雄性Wistar大鼠2只,供腹腔传代用,80~100 g雄性Wistar大鼠2只,供大腿内侧接种癌性腹水用,200~250 g雄性SD大鼠45只,供接种肝内肿瘤用。以上大鼠均为SPF级,购自中山大学实验动物中心。Walker-256瘤细胞株购自中山大学动物实验中心细胞库。Recombinant Rat VEGF165试剂,规格为每支20 μg,购自Peprotech。医用明胶海绵购自南京金陵制药厂。磁共振成像(magnetic resonance imaging,MRI)使用Siemens Magnetom Avanto 3.0T超导磁共振扫描仪。
2 Walker-256瘤细胞的获取
Walker-256瘤细胞株复苏后,接种于出生2周龄雄性Wistar大鼠腹腔内。待7~14 d,大鼠有血性腹水后,用注射器抽取5 mL癌性腹水,离心5 min (离心半径5 cm,1 200 r/min)。将离心后试管内下层糊状浓缩的瘤细胞悬液接种于2只80~100 g雄性Wistar大鼠的大腿内侧皮下,每只注射一侧大腿量约1 mL(内约含2×107个瘤细胞)。待7~10 d,可见注射处皮下长出直径约1 cm左右肿瘤。
3 SD大鼠肝癌模型制作
取传代鼠大腿皮下肿瘤鱼肉样部分0.5~1.0 mm小块备用,模型鼠用200~250 g雄性SD大鼠,暴露肝脏,挤出1个肝叶,用眼科剪刺入肝叶表面约1/3,然后用眼科镊夹取上述小方块肿瘤组织插入肝内,剪5 mm×5 mm明胶海绵覆盖创面,把肝叶还纳,检查无渗血后即可关腹。将45只SD大鼠放回笼中继续饲养,4只Wistar大鼠脱颈椎处死。使用VEGF前将其离心30 s(离心半径 5 cm,10 000 r/min);使用去离子水100 μL溶解;最后使用PBS溶液稀释VEGF溶液至所需浓度,根据预实验初步探讨VEGF剂量。实验分组:生理盐水(normal saline,NS)模型组:于建模前1周开始尾静脉注射生理盐水0.1 mL/d;20 mg/L VEGF模型组:于建模前1周开始尾静脉注射20 mg/L VEGF(0.1 mL/d);40 mg/L VEGF模型组:于建模前1周开始尾静脉注射40 mg/L VEGF(0.1 mL/d)。各组均注射至建模当日。
4 影像学检查及病理学检查
根据预实验,VEGF组1周后磁共振扫描发现部分大鼠成瘤较大,故本次实验的Siemens Magnetom Avanto 3.0T超导磁共振扫描仪用小线圈,分别于建模后3 d、1周和2周对43只雄性SD大鼠进行扫描。扫描序列为T1WI和T2WI。实验后期从建模成功的大鼠中随机抽取3只大鼠,取出肝脏作病理学检查,采用HE染色,观察肝癌组织的病理特点,以验证肝内肿瘤种植是否成功。
5 统计学处理
使用SPSS 17.0统计学软件分析,对3组中3 d后可观察到肿块的大鼠数目使用Χ2检验分析其统计学意义,大鼠存活时间采用Kaplan-Meier法绘制生存曲线,log-rank检验评价存活时间差异有无统计学意义。以P<0.05为差异有统计学意义。
结果
1 建模成功与影像学检查
MRI检查可观察到各组大鼠建模成功率高。建模后第1天,NS模型组和20 mg/L VEGF模型组各有1只死亡。40 mg/L VEGF模型组有3只于建模后1周死亡。建模后2周各组分别有3只、5只和7只出现腹水。MRI表现:肿块呈结节状,T2WI呈稍高信号,显示更为清楚,腹水于T2WI呈高信号,见图1。肿块HE染色符合恶性肿瘤特点,见图2。

Figure 1.The magnetic resonance imaging(MRI)of the rat liver 2 weeks after modeling.A:NS group;B:20 mg/L VEGF group; C:40 mg/L VEGF group.The tumor(arrows)showed slightly hyperintense signals in T2WI.No significant difference among the 3 groups in tumor size and morphology was observed.C showed a hyperintense signal(T2WI)in the abdomen,suggesting there was some ascites.图1 肝脏MRI显示肿瘤形成
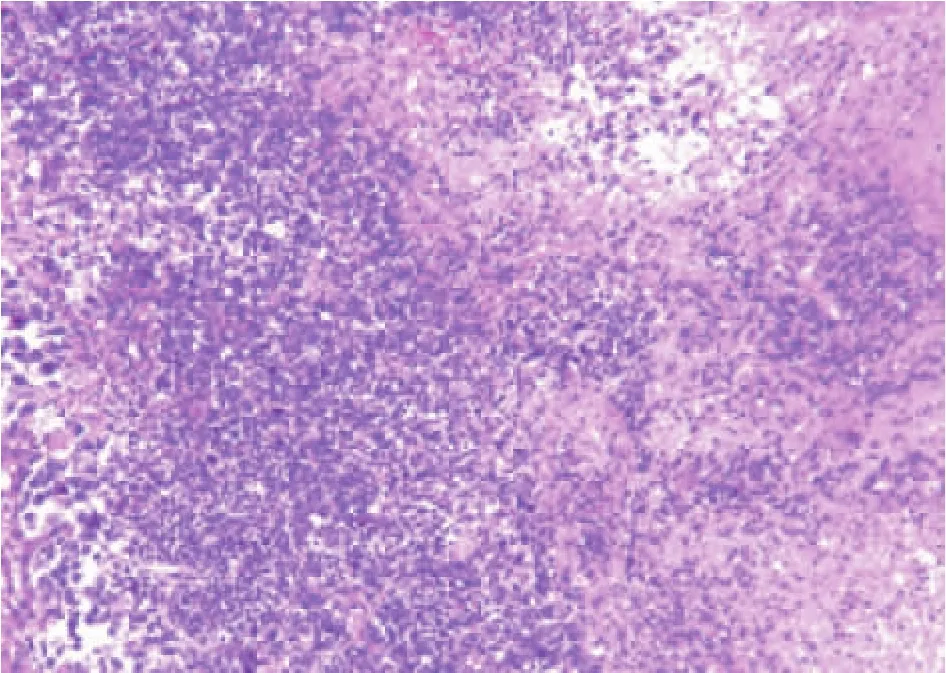
Figure 2.Morphological changes of liver tissue in the rat with liver metastatic tumor(HE staining,×200).图2 肝转移瘤模型大鼠肝脏光镜下形态
2 存活时间
43只大鼠继续饲养至死亡,观察大鼠的生存状态及终末生存时间,可以发现大鼠肝内种植初期形态、精神如常,NS模型组和20 mg/L VEGF模型组大鼠分别于建模后20 d和18 d出现体重下降,食量减小,行动减少,精神不佳,毛色无光泽,后期大部分出现腹部膨隆。40 mg/L VEGF模型组建模后1周3只大鼠因肿瘤进展死亡,剩余大鼠也有不同程度消瘦、腹部膨隆。3组大鼠存活时间见表1,中位存活时间分别是27 d(95%置信区间:25.18~28.82 d)、25 d(95%置信区间:22.25~27.75 d)和15 d(95%置信区间:13.11~16.89 d)。Log-rank检验评价NS模型组与20 mg/L VEGF模型组生存时间差异无统计学意义(P>0.05),NS模型组与40 mg/L VEGF模型组生存时间差异有统计学意义(P<0.01),且40 mg/L VEGF模型组生存时间小于NS模型组,见图3。
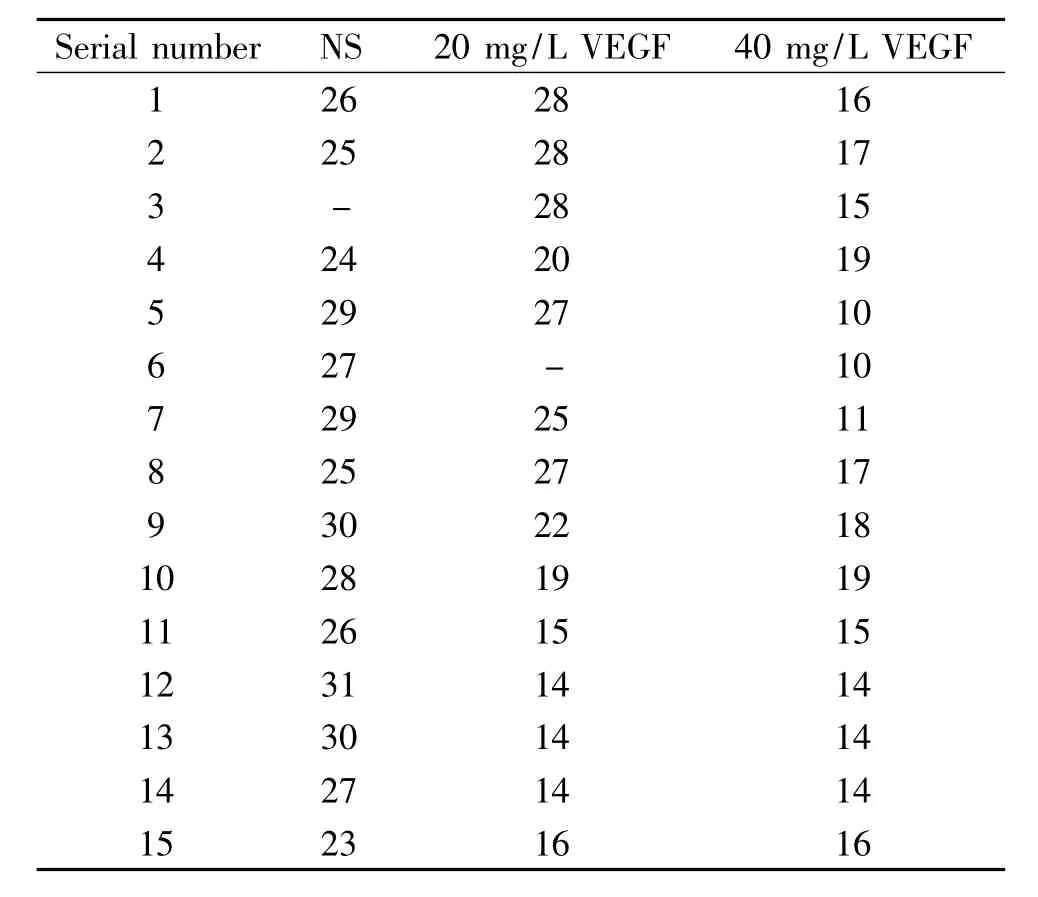
表1 45只大鼠终末生存期Table 1.The overall survival of the rats with different treatments (d)
3 VEGF建模的时间-效应关系
建模后3 d各组可观察到肿块的大鼠数分别为: NS模型组0只,20 mg/L VEGF模型组7只,40 mg/L VEGF模型组10只;建模后1周各组可观察到肿块的大鼠数分别为:NS模型组3只,20 mg/L VEGF模型组14只,40 mg/L VEGF模型组13只;建模后2周各组可观察到肿块的大鼠数分别为:NS模型组12只,20 mg/L VEGF模型组14只,40 mg/L VEGF模型组10只,见图4。卡方检验显示20 mg/L VEGF模型组与NS模型组、40 mg/L VEGF模型组与NS模型组3 d可观察到成瘤的大鼠数目差异均有统计学意义(均P<0.05)。
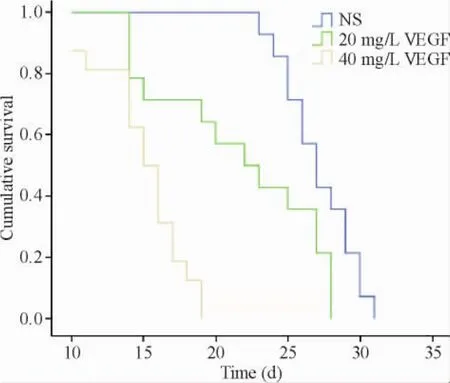
Figure 3.Survival curves of the rats in the 3 groups.The median survival time of the rats in the 3 groups was 27 d,25 d and 15 d,respectively.No significance in survival time was observed between NS group and 20 mg/L VEGF group by log-rank test(P>0.05),while the survival time in 40 mg/L VEGF group was less than that in NS group(P<0.01).图3 3组大鼠生存曲线
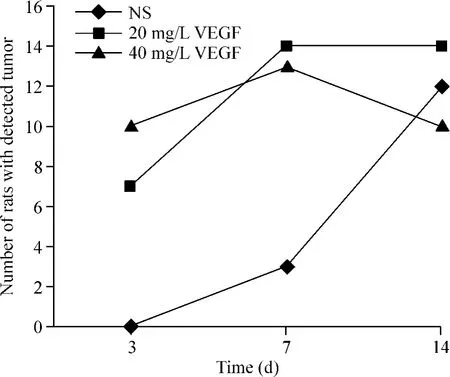
Figure 4.The relationship between the time of survival and the efficacy of tumor transplantation.图4 各组模型的时间-效应关系图
讨论
文献报道[3-4]肝脏是恶性肿瘤血源性转移最好发的部位,其中有25%~50%的原发肿瘤转移至肝脏,消化系统约60%~80%最终发生肝脏转移。肝脏转移是胃肠道恶性肿瘤治疗失败的最主要原因,不经治疗的肝转移患者,中位生存期仅6个月[4-5]。探索肝转移瘤的发生规律,寻求有效的预防和治疗措施一直是实验研究的热点。Walker-256肿瘤是大鼠自发的乳腺癌品系,由其构建的肝转移瘤动物模型具有取材方便、可控性强的特点,是研究肝转移瘤的常用模型[6]。根据传统成模方法,成功建立肝转移瘤模型需1个月左右时间,若能缩短成瘤时间,可节省实验时间,从而加快实验进度。VEGF作为血管生成的主要调控因子,特异性的作用于血管内皮细胞,促进血管生成,从而使肿瘤生长[7-8],在肿瘤进展、复发、转移中的作用日益受到重视。根据此药理机制,若提高血液中VEGF浓度可促进肿瘤生长,但浓度过低,可能观察不到效果,浓度过高,容易使肿瘤进展过快,适合的VEGF浓度是缩短成瘤时间的关键。本实验结果表明,在传统SD大鼠Walker-256肝转移瘤模型的方法上加用20 mg/L VEGF可以缩短成瘤时间。此举可提高实验效率,而且使用此浓度的VEGF并未造成老鼠生存期缩短,这也避免了后期对肿瘤进一步研究时因为生存时间缩短而造成肿瘤治疗时间缩短、疗效观察不佳等弊端。
VEGF与肿瘤,特别是胃肠道肿瘤本身的侵袭、转移密切相关[9],而肝转移瘤的介入治疗在使肿瘤坏死的同时,可以诱导产生大量VEGF,从而促进肿瘤复发[10]。目前临床上已有部分抗VEGF药物上市,如治疗肝细胞与肾癌的索拉非尼、治疗转移性结直肠癌的安维汀等。抗VEGF靶向药物的研究将是未来肿瘤治疗的一大方向。本实验在原有动物模型的基础上人为注射VEGF,增加大鼠血液VEGF浓度,相较于传统模型,更接近肿瘤转移、复发时VEGF升高的特点,更适合作为抗VEGF药物基础研究的动物模型。
关于VEGF在大鼠模型中的应用,如治疗重症胰腺炎、血管栓塞,国内外有相关文献报道,但多数采取一次性较高浓度注射以达到促进病变部位新生血管形成的目的[11-12]。本实验未套用上述研究的注射方法,依据肿瘤复发时VEGF浓度变化规律,改用低剂量连续静脉注射方法,以模拟肿瘤复发、转移过程中VEGF的变化,并在实验中观察到阳性结果,既往尚无文献报道。实验采用的 Recombinant Rat VEGF165试剂易于购得,保存方法简单,保存时间长,价格适中。实验根据相关文献报道[10]选择MRI检查作为评价肿瘤形态、大小的影像学标准,且后期病理学检查显示细胞可见明显异型性,其形态、大小与MRI检查结果相符。
综上所述,在传统肝转移瘤模型的基础上加用适当浓度的VEGF是安全可行的,提高了实验效率,且这一方法模拟了肿瘤转移、复发时VEGF升高的特点,更适合用于抗VEGF药物基础研究。本实验仅使用20 mg/L和40 mg/L VEGF进行研究,观察到浓度为20 mg/L VEGF是安全可行的,但最佳浓度需要更进一步实验探讨。
[1]Sperling J,Schafer T,Ziemann C,et al.Hepatic arterial infusion of bevacizumab in combination with oxaliplatin reduces tumor growth in a rat model of colorectal liver metastases[J].Clin Exp Metastasis,2012,29(2):91-99.
[2]Li X,Zheng CS,Feng GS,et al.An implantable rat liver tumor model for experimental transarterial chemoembolization therapy and its imaging features[J].World J Gastroenterol,2002,8(6):1035-1039.
[3]Thomassen I,van Geste YR,Lemmens VE,et al.Incidence,prognosis,and treatment options for patients with synchronous peritoneal carcinomatosis and liver metastases from colorectal origins[J].Dis Colon Rectum,2013,56 (12):1373-1380.
[4]Kodera Y,Fujitani K,Fukushima N,et al.Surgical resection of hepatic metastasis from gastric cancer:a review and new recommendation in the Japanese gastric cancer treatment guidelines[J].Gastric Cancer,2013,Sep 11.[Epub ahead of print]
[5] 邵永孚,高纪东.胃肠道癌肝转移瘤的治疗[J].中华胃肠外科杂志,2005,8(1):5-6.
[6]Zhang Y,Li M,Wei L,et al.Differential protein expression in perfusates from metastasized rat livers[J].Proteome Sci,2013,11:37.
[7]Roman AC,Carvajal-Gonzalez JM,Rico-Leo EM,et al.Dioxin receptor deficiency impairs angiogenesis by a mechanism involving VEGF-A depletion in the endothelium and transforming growth factor-beta overexpression in the stroma[J].J Biol Chem,2009,284(37):25135-25148.
[8]钱中清,曾耀英,王 通,等.VEGF诱导血管内皮细胞产生H2O2及其促增殖作用[J].中国病理生理杂志,2007,23(3):533-535.
[9]王瑞华,谢建国,陈 华,等.促血管生成素-2和血管内皮生长因子在结直肠癌组织中的表达[J].南方医科大学学报,2013,33(8):1236-1239.
[10]Fang J,Zheng C,Tao H,et al.Therapeutic effects of all trans-retinoic acid combined with transarterial chemoembolization on Walker-256 hepatoma in rats[J].Huazhong Univ Sci Technolog Med Sci,2010,30(1):113-118.
[11]Meng QY,Li XQ,Yu XB,et al.Transplantation of VEGF165-gene-transfected endothelial progenitor cells in the treatment of chronic venous thrombosis in rats[J].Chin Med J(Engl),2010,123(4):471-477.
[12]Nakajima T,Ueda T,Takeyama Y,et al.Protective effects of vascular endothelial growth factor on intestinal epithelial apoptosis and bacterial translocation in experimental severe acute pancreatitis[J].Pancreas,2007,34 (4):410-416.
Role of VEGF in establishment of Walker-256 transplanted liver cancer model in SD rats
LIU Ni,YANG Jian-yong,HUANG Yong-hui,CHEN Bin,CHEN Wei,LI Jia-ping
(Department of Interventional Radiology,The First Affiliated Hospital,Sun Yat-sen University,Guangzhou 510080,China.E-mail:13710397492@163.com)
AIM:To evaluate the safety and feasibility of using vascular endothelial growth factor(VEGF)in the establishment of Walker-256 transplanted liver cancer model.METHODS:SD rats(n=45)were divided into 3 groups:via the caudal vein,the rats in normal saline(NS)group were injected with 0.9%sodium chloride(0.1 mL/d),the rats in 20 mg/L VEGF group were injected with 20 mg/L VEGF(0.1 mL/d),and the rats in 40 mg/L VEGF group were injected with 40 mg/L VEGF(0.1 mL/d).All the injection began 1 week before transplantation of liver cancer,and stopped on the day the cancer model was established.Prepared tumor tissue was transplanted into the subcapsular space of the liver.Three days,1 week and 2 weeks after the transplantation,magnetic resonance imaging(MRI)was performed for analyzing the tumor growth and the characteristics.The overall survival of the rats was also recorded.RESULTS:Successful establishment of Walker-256 transplanted liver cancer model was achieved.Among 45 rats,1 rat died 1 d after implanting the tumor both in NS group and 20 mg/L VEGF group,while 3 rats died in 40 mg/L VEGF group 1 week after building the model,mainly because of the progression of tumors.Three days after modeling,the numbers of the rats in which the tumor was positively detected by MRI in 3 groups were 0,7 and 10,respectively;1 week after modeling,those were 3,13 and 13,respectively;2 weeks after modeling,those were 12,13 and 10,respectively.Between NS group and 20 mg/L VEGF group,the statistical significance existed in the number of the rats in which the tumor was positively detected by MRIafter 3 d of implanting,so did the NS group and 40 mg/L VEGF group.No statistical significance in the overall survival time between NS group and 20 mg/L VEGF group(P>0.05)was observed,but the significance existed between 40 mg/ L VEGF group and NS group(P<0.01).CfONCLUSION:The application of VEGF at dose of 20 mg/L and 0.1 mL/ d shortens the time to establish the transplanted liver cancer model without influence on the overall survival,which is a safe,feasible and efficient way,and is more suitable for anti-VEGF drug investigation.
Liver metastasis neoplasms;Models,animal;Vascular endothelial growth factor
R363
A
10.3969/j.issn.1000-4718.2014.03.033
1000-4718(2014)03-0567-05
2013-11-18
2014-01-13
广东省科技计划(No.2012B031800076)
△通讯作者Tel:020-87755766-8723;E-mail:13710397492@163.com

