转录因子YY1对口腔鳞癌细胞ITGB6基因表达的影响*
尹丽琴, 许铭炎, 陈锡和, 舒申友, 傅玉才, 邓小玲
(1厦门市口腔医院,福建厦门 361009;2汕头大学医学院细胞衰老实验室,广东汕头 515041;3厦门大学医学院基础医学部,福建厦门 361102)
转录因子YY1对口腔鳞癌细胞ITGB6基因表达的影响*
尹丽琴1,2, 许铭炎1△, 陈锡和2, 舒申友2, 傅玉才2, 邓小玲3△
(1厦门市口腔医院,福建厦门 361009;2汕头大学医学院细胞衰老实验室,广东汕头 515041;3厦门大学医学院基础医学部,福建厦门 361102)
目的:研究肿瘤相关转录因子YY1对口腔鳞癌细胞整合素β6(integrin β6,ITGB6)基因表达调控的影响。方法:用生物信息学方法预测分布在ITGB6启动子区域的转录因子YY1潜在的结合位点,构建萤光素酶报告基因质粒,利用双萤光素酶报告基因系统检测ITGB6启动子片段的转录活性;利用染色质免疫沉淀技术检测在天然染色质条件下转录因子YY1与ITGB6启动子的结合情况;采用定点突变方法检测YY1结合位点对ITGB6启动子活性的影响;利用RT-PCR方法检测过表达转录因子YY1对口腔鳞癌细胞ITGB6 mRNA表达水平的影响。结果:ITGB6启动子-421~-150 nt区域存在多个转录因子YY1潜在的结合位点。在口腔鳞癌细胞的天然染色质中,转录因子YY1结合于ITGB6启动子-421~-150 nt区域;定点突变YY1潜在结合位点对口腔鳞癌细胞中ITGB6启动子活性无显著影响。另外,过表达的YY1对口腔鳞癌细胞ITGB6 mRNA的表达水平也无影响。结论:转录因子YY1在口腔鳞癌细胞中结合于ITGB6基因启动子-421~-150 nt区域,但对ITGB6基因的基础转录水平无影响。
YY1转录因子;整合素β6;口腔肿瘤
整合素是一种位于细胞表面、由α亚基和β亚基组成的跨膜异二聚体,介导细胞间和细胞与胞外基质间的信号转导,其中由β6(integrin β6,ITGB6)亚单位和αv亚单位组成的整合素αvβ6只特异性在上皮组织中表达,不仅参与创伤愈合和炎症反应时上皮组织重塑,而且与包括口腔鳞癌在内的多种恶性上皮源性肿瘤的发生发展密切相关[1-3]。整合素αvβ6在口腔鳞癌组织样本中过度表达并位于侵袭组织的边缘[4],但正常口腔黏膜组织几无表达,提示高表达的αvβ6参与口腔鳞癌的进展,但调控其过度表达的具体机制未知。由于ITGB6亚单位只与αv亚单位组成整合素αvβ6,因此ITGB6是控制整个异二聚体αvβ6表达的关键性亚单位。有报道转录因子Ets-1[5]、STAT3[6]、Smad和AP-1[7]参与不同种类细胞中ITGB6过度转录,然而,其它与肿瘤侵润转移相关的转录因子是否参与调控ITGB6的表达尚未见报道。
转录因子YY1是锌指类转录因子Gli-Kruppel家族中的一员,也是polycomb group(PcG)蛋白家族中的一员,作为调控因子在多种组织中广泛表达,参与染色质重塑、胚胎形成、细胞组织分化及肿瘤发生发展等生物学过程[8]。鉴于整合素αvβ6和YY1均参与肿瘤的侵润和转移,本研究以口腔鳞癌细胞为细胞模型,探讨YY1对整合素αvβ6关键性亚单位ITGB6转录调控的影响。
材料和方法
1 细胞
人胚胎肾细胞株293T购买于武汉大学细胞典藏中心,口腔鳞癌细胞株SAS由哈尔滨医科大学郑金华教授惠赠。
2 主要试剂
高糖DMEM购自Invitrogen;胎牛血清购自Gibco;YY1、STAT3和β-actin抗体购于Santa Cruz。基因组DNA提取试剂盒、质粒提取试剂盒、凝胶回收试剂盒和总RNA提取试剂盒及RNA逆转录试剂盒购自天根生化有限公司;感受态细胞(DH5α)、T4连接酶、KpnⅠ内切酶、XhoⅠ内切酶、pGL2-Basi载体和双萤光素酶检测系统购自Promega;pCMV-YY1由哈佛大学SHI Yang教授惠赠;转染试剂METAFECTENE® EASY购自Biontex;细胞培养板购自Corning;引物合成及测序由北京六合华大基因有限公司完成。
3 主要方法
3.1 细胞培养 口腔鳞癌细胞SAS和293T细胞株均在5%CO2和37℃ 条件下,用含有10% 胎牛血清、1×105U/L青霉素和100 mg/L链霉素的高糖DMEM培养基培养。
3.2 ITGB6基因启动子序列的生物信息学分析 利用NCBI基因组数据库查找ITGB6基因序列(Ref-Seq:NC_000002.11/161056571…161057199),使用McPromoter及NNPP软件进行启动子预测,TESS(http://www.cbil.upenn.edu/cgi-bin/tess/tess)分析转录因子YY1潜在结合位点,确定ITGB6基因启动子片段区域。
3.3 ITGB6启动子萤光素酶报告基因质粒的构建提取口腔鳞癌细胞基因组DNA为模板,由ITGB6 -421F/ITGB6+208R、ITGB6-150F/ITGB6+208R和ITGB6(-421/-150)F/ITGB6(-421/-150)R分别组成3对引物(表1)扩增ITGB6 5'侧翼区,PCR反应条件:94℃ 5 min,95℃ 30 s,62℃ 30 s,72℃ 1 min,33个循环,72℃ 10 min。PCR产物和PGL2-Basic载体共同经KpnⅠ和XhoⅠ双酶切,凝胶回收,T4连接酶连接,转化,将转化的菌液涂板于氨苄青霉素抗性的LB平板上,培养筛选重组子。挑取阳性菌抽提质粒,双酶切,进行PCR,测序鉴定。重组质粒分别命名为pGL2-B6(-421/+208)、pGL2-B6(-150/ +208)和pGL2-B6(-421/-150)。
3.4 ITGB6-421~-150 nt区域点突变报告基因质粒的构建 首先利用上游引物引进突变位点方法构建YY1(1)和YY1(2)这2个位点的突变质粒:以质粒pGL2-B6(-421/-150)为模板,Mut YY1-1和 Mut YY1-2分别为上游引物、ITGB6(-421/-150)R为下游引物进行 PCR反应,PCR产物经酶切后克隆入pGL2-Basic载体中,构建重组质粒pGL2-B6-M-YY1 (1)和pGL2-B6-M-YY1(2)。其余3个位点的突变则使用重叠延伸法[9]构建:分别用 ITGB6(-421/ -150)F/Mut YY1-3R、ITGB6(-421/-150)F/Mut YY1 -4R、ITGB6(-421/-150)F/MutYY1-5R、ITGB6 (-421/-150)F/MutYY1-6R、MutYY1-3F/ITGB6 (-421/-150)R、Mut YY1-4F/ITGB6(-421/-150)R、Mut YY1-5F/ITGB6(-421/-150)R和 Mut YY1-6F/ ITGB6(-421/-150)R等引物进行PCR反应引入YY1突变位点,反应条件:94℃ 预变性5 min;95℃变性30 s,64℃退火30 s,72℃延伸1 min,35个循环;72℃10 min。PCR产物切胶回收并将相同突变位点的产物等量混合作为第2次PCR反应的模板,以ITGB6(-421/-150)F/ITGB6(-421/-150)R为引物,扩增出YY1位点的突变片段,经KpnⅠ/XhoⅠ双酶切后克隆入pGL2-Basic载体,构建重组质粒pGL2-B6-M-YY1(3)、pGL2-B6-M-YY1(4)、pGL2-B6-M-YY1 (5)和pGL2-B6-M-YY1(6)。PCR反应所用引物序列见表1。

表1 构建启动子报告基因质粒的引物序列Table 1.Primers for generating promoter reporter constructs
3.5 瞬时转染以及双萤光素酶活性检测 按照转染试剂说明书,消化细胞,计数,将细胞悬浮液(5× 109cells/L)种于孔板。另外,准备转染复合物,每孔质粒DNA与转染试剂按1∶3比例用10 μL 1×EASY buffer稀释,轻轻混匀,室温孵育15 min,将转染复合物逐滴滴入孔板中,每次试验设置3个复孔。48 h后,提取蛋白,或者裂解细胞,按照双萤光素酶检测系统(Dual-Glo®Luciferase Assay System)操作手册进行荧光检测。检测时间为10 s,重组质粒相对表达活性以萤火虫萤光素酶活性与海肾萤光素酶活性的比值来表示。
3.6 染色质免疫共沉淀[10]SAS细胞经胰酶消化离心后,用1%甲醛PBS交联固定蛋白质-DNA复合物8 min,1.25 mol/L甘氨酸终止交联5 min,2 800 r/ min 4℃离心10 min,PBS洗脱2次;加裂解液冰上裂解5 min,然后超声破碎(功率200 W,超声时间10 s,次数10次,间隔30 s),将其随机打断为200~500 bp的染色质小片段;之后,染色质与YY1、STAT3特异性抗体及磁珠4℃回旋(35 r/min)过夜,RIPA磁铁上洗脱3遍,68℃水浴2 h,苯酚氯仿抽提法提富集的DNA,PCR特异的扩增ITGB6启动子-289/ -150 bp区域,扩增条件:94℃ 4 min,94℃ 30 s,59℃ 30 s,72℃ 30 s,72℃ 5 min,30个循环。引物序列ITGB6(-289/-150)F:5’-TTCCTCATATATAGCCTATA-3’;ITGB6(-289/-150)R:5’-TAGAGAAAGTTAATATCTTTA-3’。
3.7 蛋白质免疫印迹 SAS细胞用预冷的PBS洗2次,加入 RIPA(以 1∶100的比例加入 PMSF 100 nmol/L)裂解液,细胞刮刮取细胞,冰上裂解30 min,每隔10 min振荡1次,之后用1 mL针头抽吸10~20次,12 000 r/min 4℃ 离心15 min,吸取上清,BCA法测蛋白浓度。蛋白进行SDS-PAGE电泳,电转到硝酸纤维膜上,10%脱脂牛奶封闭1 h,YY1和β-actin抗体以1∶3 000的比例4℃孵育过夜,TBST洗涤3次,每次10 min,Ⅱ抗室温1 h,TBST洗涤3次,每次10 min,ECL发光液显影。
3.8 总RNA提取和RT-PCR反应 SAS细胞转染48 h后,按总 RNA提取试剂盒操作步骤提取总RNA,用紫外吸收法测定RNA溶液浓度和纯度。按照逆转录试剂盒说明把RNA(1 μg)逆转录成cDNA。以cDNA为模板,进行PCR扩增。ITGB6上游引物序列为5'-GCAAGCTGCTGTGTGTAAGGA-3',下游引物序列为5'-CTTGGGTTACAGCGAAGATCAA-3';β2-微球蛋白(β2-microglobulin,β2-M)上游引物序列为5'-AATCCAAATGCGGCATCT-3',下游引物序列为5'-GAGTATGCCTGCCGTGTG-3'。
4 统计学处理
数据以均数 ±标准差(mean±SD)表示。用SPSS 13.0软件对每种细胞内每个片段的活性分别与组内相邻的组进行t检验。以P<0.05为差异有统计学意义。
结果
1 ITGB6基因启动子序列分析及启动子活性鉴定
通过生物信息学方法分析,发现ITGB6基因启动子近端(-421~+1)区域有6个YY1潜在结合位点(图 1A;转录起始位点为 +1,结合基序: TATTT)。根据YY1潜在位点的分布,构建重组质粒pGL2-B6(-421/+208)和pGL2-B6(-150/+208),转染293T细胞,检测相对萤光素酶活性,结果显示(图1B)当ITGB6启动片段从-421截短到-150时,启动子活性显著下降,提示YY1潜在的结合位点可能参与ITGB6启动子的转录调控。
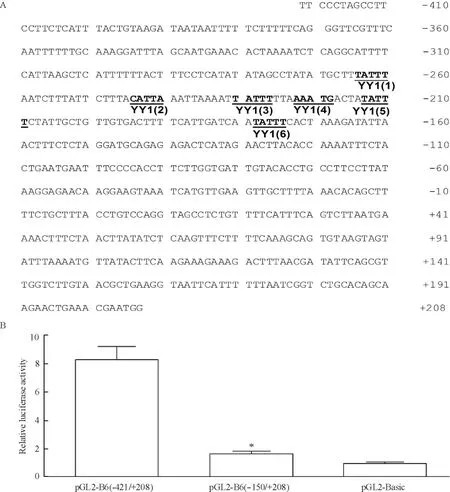
Figure 1.The sequence analysis of ITGB6 promoter and relative luciferase activity of the constructs.A:prediction of the potential YY1 binding sites in ITGB6 promoter;B:relative luciferase activity of the constructs.*P<0.05 vs pGL2-B6(-421/+208).图1 ITGB6基因启动子序列分析及活性鉴定
2 口腔鳞癌细胞中转录因子YY1结合于ITGB6基因启动子-289~-150 nt区域
为了验证口腔鳞癌细胞中转录因子YY1是否结合于 ITGB6基因的启动子区,分别使用 YY1和 STAT3(阳性对照)抗体进行染色质免疫共沉淀实验,用-289~-150 nt区域特异引物PCR扩增,结果如图2所示,在口腔鳞癌细胞中转录因子YY1结合于ITGB6基因启动子-289~-150 nt区域。

Figure 2.Chromatin immunoprecipitation assay for YY1 binding to the-421~-150 nt region of ITGB6 promoter.图2 染色质免疫共沉淀检测YY1与ITGB6基因启动子区-421~-150 nt体内结合情况
3 定点突变分析YY1结合位点对ITGB6基因启动子活性的影响
为了检验ITGB6启动子区中YY1潜在结合位点对ITGB6基因启动子活性的影响,我们构建了6个定点突变质粒,瞬时转染到293T细胞,检测突变YY1潜在结合位点对ITGB6基因启动子活性的影响,结果发现ITGB6启动子区6个YY1潜在结合位点的逐个突变对相对萤光素酶活性没有显著影响,提示ITGB6基因-421~-150 nt区域启动子活性并非依赖于该区域中单个YY1潜在结合位点(图3)。
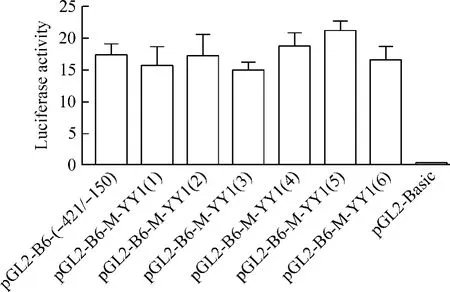
Figure 3.The effect of YY1 binding site mutants on ITGB6 transcriptional activity.图3 YY1结合位点突变对ITGB6启动子转录活性的影响
4 转录因子 YY1过表达对口腔鳞癌细胞ITGB6 mRNA表达水平的影响
为了进一步探讨YY1对口腔鳞癌细胞ITGB6表达的影响,将YY1表达载体pCMV-YY1和空载体pCMV,瞬时转染到口腔鳞癌细胞SAS中,48 h后,提取总蛋白,Western blotting法检测YY1在SAS细胞中过表达(图4A)。同样方法转染SAS细胞,提取总RNA,进行PCR,结果显示,过度表达的YY1对口腔鳞癌细胞ITGB6 mRNA表达水平无显著影响(图4B)。
讨论
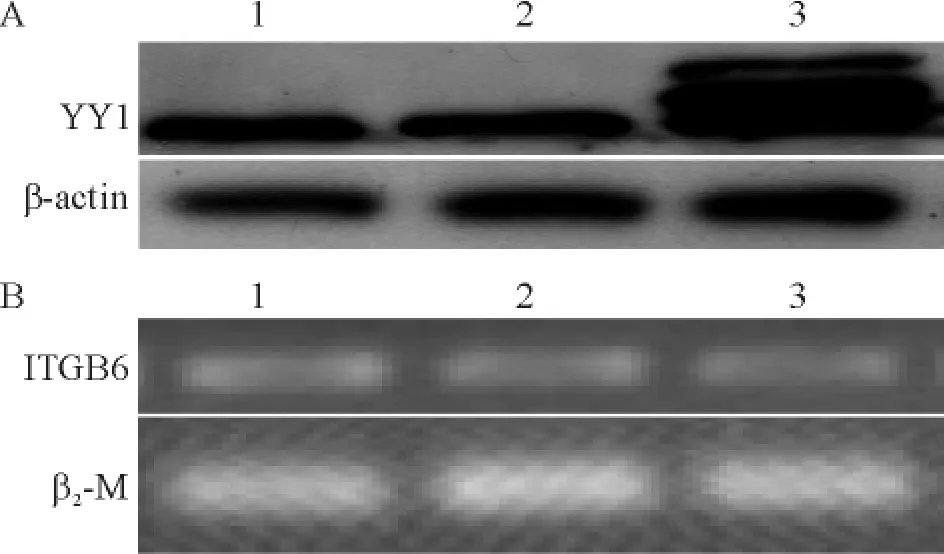
Figure 4.The effects of YY1 over-expression on ITGB6 mRNA expression.A:YY1 over-expression in SAS cells;B: ITGB6 mRNA expression in SAS cells.Lane 1:control;Lane 2:pCMV;Lane 3:pCMV-YY1.图4YY1过表达对ITGB6 mRNA水平的影响
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是一种常见的实体肿瘤,占所有恶性肿瘤的4%。在全世界范围内,每年都有超过10万人死于OSCC。有研究显示:口腔鳞状细胞癌的发病呈年轻化上升趋势[11]。肿瘤的侵袭和转移是造成患者死亡的主要原因,因此,探讨与侵袭和转移相关的整合素β6基因表达调控的机制具有重要的科学意义。
启动子作为基因表达调控的“开关”,决定基因的活动。本研究利用萤光素酶报告基因系统及生物信息学技术,发现ITGB6启动子区-421~+1之间有6个YY1潜在结合位点,进一步应用染色质免疫沉淀发现口腔鳞癌细胞中转录因子YY1可结合于ITGB6启动子-421~-150 nt区域,提示YY1可能参与口腔鳞癌细胞ITGB6基因的转录调控。接着,我们对ITGB6启动子区-421~-150 nt区域中YY1潜在结合位点分别进行定点突变,发现YY1潜在结合位点的突变对报告基因表达活性无显著影响,进一步在口腔鳞癌细胞中过表达 YY1,也未检测到ITGB6 mRNA表达水平的变化,所有结果提示转录因子YY1并不参与ITGB6基因的基本转录调控。有报道,转录因子可以结合在基因启动子区参与组成转录调控复合物,但是不参与基因转录激活[12],因此可以推测,转录因子YY1可能参与ITGB6基因转录调控复合物的形成,但是不参与ITGB6基因基本转录的激活。
此外,我们的研究是在基础情况下进行的,在其它诱导剂及细胞因子等影响下,转录因子YY1对口腔鳞癌细胞中ITGB6表达调控是否有影响,有待进一步研究。
[1]Bandyopadhyay A,Raghavan S.Defining the role of integrin αvβ6 in cancer[J].Curr Drug Targets,2009,10 (7):645-652.
[2]许铭炎,邓小玲,陈锡和,等.溶血磷脂酸对上皮细胞整合素β6表达的影响[J].中国病理生理杂志,2012,28(3):488-491.
[3]陈锡和,邓小玲,尹丽琴,等.口腔鳞癌细胞中ITGB6基因主要转录调控区域的定位分析[J].癌变·畸变· 突变,2013,25(3):190-193.
[4]Li HX,Zheng JH,Fan HX,et al.Expression of αvβ6 integrin and collagen fibre in oral squamous cell carcinoma: association with clinical outcomes and prognostic implications[J].J Oral Pathol Med,2013,42(7):547-556.
[5]Bates RC,Bellovin DI,Brown C,et al.Transcriptional activation of integrin β6 during the epithelial-mesenchymal transition defines a novel prognostic indicator of aggressive colon carcinoma[J].J Clin Invest,2005,115(2):339-347.
[6]Azare J,Leslie K,Al-Ahmadie H,et al.Constitutively activated Stat3 induces tumorigenesis and enhances cell motility of prostate epithelial cells through integrin β6[J].Mol Cell Biol,2007,27(12):4444-4453.
[7]Sullivan BP,Kassel KM,Manley S,et al.Regulation of transforming growth factor-β1-dependent integrin β6 expression by p38 mitogen-activated protein kinase in bile duct epithelial cells[J].J Pharmacol Exp Ther,2011,337(2):471-478.
[8]Zhang Q,Stovall DB,Inoue K,et al.The oncogenic role of Yin Yang 1[J].Crit Rev Oncog,2011,16(3-4):163-197.
[9]黄培堂,王嘉玺,朱厚础,等.分子克隆实验指南[M].第3版.北京:科学出版社,2002:1109-1113.
[10]Dahl JA,Collas P.A rapid micro chromatin immunoprecipitation assay(ChIP)[J].Nat Protoc,2008,3(6): 1032-1045.
[11]Zygogianni AG,Kyrgias G,Karakitsos P,et al.Oral squamous cell cancer:early detection and the role of alcohol and smoking[J].Head Neck Oncol,2011,3:2.
[12]Pfau JD,Taylor RK.Mutations in toxR and toxS that separate transcriptional activation from DNA binding at the cholera toxin gene promoter[J].J Bacteriol,1998,180 (17):
4724-4733.
Role of transcription factor YY1 in regulation of ITGB6 gene expression in oral squamous cell carcinoma
YIN Li-qin1,2,XU Ming-yan1,CHEN Xi-he2,SHU Shen-you2,FU Yu-cai2,DENG Xiaoling3
(1Xiamen Stomatological Hospital,Xiamen 361009,China;2Laboratory of Cellular Senescence,Shantou University Medical College,Shantou 515041,China;3Department of Basic Medicine,Xiamen University Medical College,Xiamen 361102,China.E-mail:myxu1972@yahoo.com;caseydxl@yahoo.com)
AIM:To explore the role of transcription factor YY1 in the regulation of integrin β6(ITGB6)gene expression in oral squamous cell carcinoma.METHODS:The distribution of the potential YY1 binding sites in ITGB6 promoter were predicted by bioinformatic methods.Series of 5'deletion of ITGB6 promoter luciferase reporter constructs containing potential YY1 binding sites were made and transfected into 293T cell line to detect the promoter activity.The binding activity of the transcription factor YY1 to ITGB6 promoter in the native chromatin environment was determined by chromatin immunoprecipitation(ChIP)assay.The role of the potential YY1 binding sites in the regulation of ITGB6 promoter activity was analyzed by substitution mutant analysis.The effect of YY1 over-expression on the mRNA expression of ITGB6 in oral squamous cell carcinoma cell line was measured by RT-PCR.RESULTS:Bioinformatics analysis revealed that there were several potential binding sites for YY1 in the region of-421~-150 nt in the ITGB6 promoter.ChIP assay showed that transcription factor YY1 bound to the ITGB6 promoter region of-421~-150 nt in the native chromatin environment.Substitution mutant analysis of potential YY1 binding sites in ITGB6 promoter did not affect the promoter activity of ITGB6.The over-expression of YY1 in oral squamous cell carcinoma cells did not affect the ITGB6 mRNA expression.CONCLUSION:The transcription factor YY1 binds to the region of-421~-150 nt in the ITGB6 promoter.However,it is not involved in the basic transcriptional regulation of ITGB6 gene in oral squamous cell carcinoma cells.
YY1 transcription factor;Integrin β6;Mouth neoplasms
R394.3
A
10.3969/j.issn.1000-4718.2014.03.002
1000-4718(2014)03-0394-06
2013-10-16
2014-01-24
国家自然科学基金资助项目(No.30900661;No.81072208;No.81370160);教育部留学回国人员科研启动基金资助项目;汕头大学医学院基础与临床科研基金资助项目
△通讯作者Tel:0592-2678587;E-mail:许铭炎myxu1972@yahoo.com;邓小玲E-mail:caseydxl@yahoo.com

