人参皂苷Rg1抑制叔丁基过氧化氢诱导的原代大鼠皮层神经元损伤*
逯 丹, 舒晓明, 张婵娟, 赵佳仪, 朱丽红, 戚仁斌, 王华东, 陆大祥
(暨南大学医学院病理生理学系,暨南大学脑科学研究所,国家中医药管理局重点科研实验室,广东广州 510632)
人参皂苷Rg1抑制叔丁基过氧化氢诱导的原代大鼠皮层神经元损伤*
逯 丹▲, 舒晓明▲, 张婵娟, 赵佳仪, 朱丽红, 戚仁斌, 王华东, 陆大祥△
(暨南大学医学院病理生理学系,暨南大学脑科学研究所,国家中医药管理局重点科研实验室,广东广州 510632)
目的:观察人参皂苷Rg1对叔丁基过氧化氢(t-BHP)诱导的原代大鼠皮层神经元损伤的改善作用,并探讨其可能机制。方法:将神经元随机分为正常对照组、10 μmol/L t-BHP组及10 μmol/L t-BHP+10 μmol/ L人参皂苷Rg1组,培养24 h。采用MTT检测不同浓度t-BHP处理的神经元活性,神经元三维重建研究神经元平均总纤维长度及总突起数量,免疫荧光检测caspase-3表达水平及免疫印迹方法检测Bcl-2、caspase-3以及磷酸化糖原合成酶激酶3β(pGSK-3β)蛋白表达水平。结果:10 μmol/L人参皂苷Rg1能够对抗10 μmol/L t-BHP引起的原代大鼠皮层神经元活性水平的降低,并且上调Bcl-2及pGSK-3β蛋白表达量,降低caspase-3活化为cleaved caspase-3的水平(P<0.05)。结论:人参皂苷Rg1可能通过提高GSK-3β自身磷酸化从而增强神经元的抗t-BHP损伤能力。
人参皂苷Rg1;叔丁基过氧化氢;糖原合成酶激酶3β
人参是祖国传统中药的珍品,含有多种有效成分,具有延年益寿滋补强身的功效。研究证实人参有效成分对动物的学习记忆功能有改善作用,且人参皂苷Rg1具有促智作用,可以显著改善脑缺血及淀粉样多肽等损害引起的学习记忆功能障碍,并对多种模型的学习记忆功能有保护作用[1]。人参皂苷Rg1作为人参药理作用的主要成分之一,能够提高机体内抗脂质过氧化体系活性从而延缓衰老,长期使用人参皂苷治疗能防止老年小鼠失忆症的发生,可改善记忆全过程[2],人参皂苷Rg1作为益智药的主要有效成分能够促进神经递质乙酰胆碱的释放[3]、阻止脑内脂质过氧化过程[4]等。本研究以叔丁基过氧化氢(tert-butyl hydroperoxide,t-BHP)诱导建立原代神经无损伤模型,观察人参皂苷Rg1处理对t-BHP作用后细胞生长的影响以及神经突起变化,并对其机制进行初探。
材料和方法
1 动物
新生24 h内健康Sprague-Dawley大鼠乳鼠,SPF级,雌雄不限,由南方医科大学实验动物中心提供,许可证号为4402101947。
2 主要试剂
人参皂苷Rg1(纯度≥96%)购自广东省药品检验所。DMEM/F12试剂培养基购自HyClone。Neurobasal购自Invitrogen。B27购自Gibco,胎牛血清(fetal bovine serum,FBS)购自HyClone。胰蛋白酶、左旋多聚赖氨酸和MTT购自Sigma。Caspase-3抗体、磷酸化糖原合成酶激酶3β(phosphorylated glycogen synthase kinase 3β,pGSK-3β)抗体和Bcl-2抗体均购自Cell Signaling Technology。AnnexinV-FITC/PI凋亡检测试剂盒购自南京凯基生物科技发展有限公司。大鼠神经元特异性微管相关蛋白2(microtubuleassociated protein 2,MAP-2)抗体购自 Millipore。TRICT标记山羊抗兔抗体以及FITC标记的驴抗兔抗体购自北京博奥森生物技术有限公司。其它生化试剂均为进口分装或国产分析纯。
3 主要方法
3.1 原代大鼠皮层神经元的的分离培养 用乙醇消毒新生鼠头部后,断头处死,无菌条件下打开颅腔,于PBS磷酸盐缓冲液分离出皮层,去除脑膜和血管,稍静置待组织沉入离心管底部,以上步骤均在4℃条件下进行,静止2 min后弃去上清,向组织内加入0.125%胰蛋白酶,消化10 min后加入添加血清的培养基终止其消化,用尖端抛光的玻璃管轻轻吹打至无可见的组织块,组织悬液移至15 mL离心管进行离心,离心5 min后弃去上清液,加入DMEM/ F12完全培养基(含10%FBS)用尖端抛光的玻璃管轻轻吹打数次,将吹打重悬后的沉淀通过200目筛网过滤后,用台盼蓝染色计数,调整细胞密度为2× 107/L接种于培养板中,置37℃、5%CO2、饱和湿度的培养箱中培养,接种4 h后的细胞用原代神经元Neurobasal完全培养基(含2%B27)全量换液。培养3 d后,原代神经元完全培养基全量换液。
3.2 MAP2免疫荧光染色鉴定神经元并显示其神经纤维形态 弃去培养基,用PBS洗1遍。用4%多聚甲醛溶液室温固定神经元20 min。PBS洗细胞2次。用0.1%Triton X-100室温透化处理细胞10 min(24孔板每孔加入500 μL)。用0.1%BSA室温封闭1 h。用封闭液中稀释MAP-2 Ι抗至工作浓度,置于湿盒内,4℃冰箱孵育过夜。除去Ι抗,用PBS洗3次(每次5 min)。图4A为TRICT标记的荧光Ⅱ抗临用前用PBS稀释至工作浓度,图4 B为FITC标记的荧光Ⅱ抗湿盒内室温孵育Ⅱ抗30 min。除去Ⅱ抗,用PBS洗细胞3次(每次5 min),加入500 μL PBS覆盖后镜下观察,神经纤维的三维重建通过Imaris software(BitPlane AG)检测。
3.3 实验分组 (1)正常对照组:不加任何处理因素;(2)模型组:加入10 μmol/L t-BHP作用于原代皮层神经元24 h;(3)人参皂苷Rg1保护处理组:加入10 μmol/L Rg1预保护4 h后再与10 μmol/L t-BHP共同作用于原代大鼠皮层神经元24 h。
3.4 MTT法测细胞活性 原代培养的皮层神经元接种于96孔培养板,每孔100 μL细胞悬液,待细胞生长5 d,用不同浓度t-BHP与人参皂苷Rg1对细胞处理,每组设5个复孔,24 h后,用磷酸盐缓冲液现配成初始浓度5 g/L的溶液,每孔加入100 μL MTT与培养基混合液,上述配液及加液过程需避光操作,之后置培养箱中37℃孵育4 h,在预热10 min的Bio-Rad酶标仪570 nm波长处进行吸光度(absorbance,A)测定。根据下列公式计算各组细胞活性:细胞活性 =(A处理组-A空白组)/(A对照组-A空白组) × 100%,实验重复3次。
3.5 流式细胞术检测细胞凋亡 培养细胞铺板6孔板,按照先前的实验分组,加入不同的损伤及保护处理药物后开始后续实验。达到作用时间后,吸出培养液,用PBS洗2次,每孔加入胰酶1 mL,放入培养箱消化3 min。轻轻吹打细胞使之悬浮于消化液中,在操作中要轻柔并且迅速,然后加含有血清的DMEM培养基终止消化。待细胞消化完全后,分组标记,配平。将消化好的细胞放入离心机中,1 000 r/min离心×5 min。轻轻吸取上清,将不同组间加入loading buffer 200 μL。用枪头吹打成单细胞悬液。然后在避光条件下加入PI及FITC染料各2 μL。避光反应15 min。轻轻吹打混匀后,上级检测各组细胞凋亡率。
3.6 免疫细胞化学法检测caspase-3的表达 弃去培养基,用PBS洗1遍。4%多聚甲醛固定细胞后,加过氧化氢甲醇溶液灭活内源性的过氧化物酶。正常山羊血清室温孵育10 min后,加PBST(含0.5% Triton的PBS磷酸盐缓冲液)稀释caspase-3 Ι抗,抗体4℃孵育过夜。加TRICT标记山羊抗兔IgG作用1 h,Hoechst 33342染核10 min后,洗片封片3次,每次5 min,显微镜下观察并摄片。
3.7 免疫印迹法检测Bcl-2、pGSK-3β和caspase-3表达 处理后的各组弃培养液,用预冷的PBS清洗2次,每孔加入60 μL细胞裂解液,冰面上裂解20 min,14 000×g、4℃离心10 min,取上清,Bradford法通过BCA定量试剂盒进行蛋白定量(碧云天)。以10%SDS-聚丙烯酰胺凝胶电泳分离,半干电转移法转移至PVDF膜,室温下用封闭液封闭PVDF膜1 h后,分别加入相应Ⅰ抗(1∶1 000稀释)于4℃ 孵育过夜,分别用相应的抗兔或鼠Ⅱ抗(1∶5 000稀释)室温孵育2 h,ECL发光液发光显色,X线底片曝光。β-肌动蛋白(β-actin)作为内参照。实验重复3次。
4 统计学处理
数据以均数±标准误(mean±SEM)表示,采用SPSS 13.0软件包分析,组间比较用单因素方差分析。以P<0.05为差异有统计学意义
结果
1 原代大鼠皮层神经元鉴定
新生大鼠皮质神经元采用无血清Neurobasal完全培养基(含2%B27)培养,以减少胶质细胞的影响。培养5 d后,采用MAP-2免疫荧光染色对神经元进行鉴定,见图1,可见所培养的细胞80%以上都为神经元,纯度较高,可用于后续实验。

Figure 1.Neuron identification.Analysis of MAP-2 protein expression and Hoechst 33342 in primary rat cerebrocortical neurons by immuncytochemistry.图1 原代大鼠皮层神经元鉴定
2 人参皂苷Rg1对由t-BHP诱导的原代神经元细胞损伤的活性影响
t-BHP对原代皮层神经元损伤有浓度依赖性,见图2A;10 μmol/L G-Rg1组处理24 h神经元活性为95.24%,较模型组有显著提高,见图 2B(P<0.05),说明人参皂苷Rg1在对抗t-BHP诱导的原代皮层神经元细胞活性降低时具有较好的改善作用。

Figure 2.G-Rg1 inhibited t-BHP-induced decrease in the viability of primary rat cerebrocortical neurons.Cell viability was measured by MTT assay.A:effects of different concentrations of t-BHP on cell viability;B:effects of G-Rg1 on t-BHP-induced cell viability.Mean±SEM.n=3.*P<0.05 vs control(0 μmol/L t-BHP);#P<0.05 vs 10 μmol/L t-BHP alone.图2 人参皂苷Rg1对t-BHP诱导的原代皮层神经元活性的影响
3 人参皂苷 Rg1对 t-BHP诱导的细胞凋亡及caspase-3和Bcl-2表达的影响
如图3所示,Q3区为正常细胞,Q2区为晚期凋亡细胞,Q4区为早期凋亡细胞。t-BHP损伤组与正常对照组相比,细胞凋亡有增加。10 μmol/L人参皂苷Rg1干预组凋亡细胞较t-BHP损伤组有降低。各组细胞经过相应处理后,Hoechst 33324染色结果显示正常对照组细胞核光滑,形态较均匀一致,基本上没有核固缩及核断裂。损伤组与正常对照组相比较,可以观察到大量神经元细胞核体积明显减小,有些细胞核形状不规则,其中一些有染色质浓缩、核固缩现象,边缘化等典型的凋亡形态特征,凋亡细胞率损伤组较对照组有显著增加。而人参皂苷Rg1组凋亡细胞率与 t-BHP损伤组相比较显著降低,通过荧光显微镜可以观察到有些细胞核体积缩小,有少量的核固缩,细胞核光滑,规则,基本均匀一致,少有核碎裂。对应的t-BHP损伤组caspase-3平均每个视野达到60.6%,与正常对照组的14.6%比较,有显著高表达;而人参皂苷Rg1处理后的caspase-3显著降低至36.4%,且与Hoechst 33324染色定位一致,见图4 A~C,提示人参皂苷Rg1抑制的细胞凋亡可能通过抑制caspase-3表达进行的。免疫印迹结果显示,t-BHP损伤引起的原代皮层神经元Bcl-2下调与caspase-3活化,经人参皂苷Rg1处理的神经元Bcl-2表达量显著升高,caspase-3活性显著降低(P<0.05),见图4D、E。
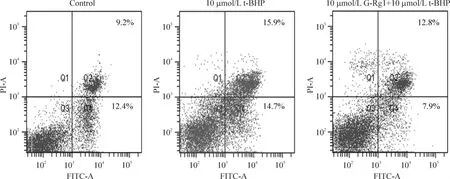
Figure 3.G-Rg1 reduced t-BHP-induced apoptosis in primary neurons.图3 人参皂苷Rg1对t-BHP诱导的原代皮层神经元凋亡的影响
4 人参皂苷Rg1提高神经元突起的抗损伤能力
如图5A所示,人参皂苷Rg1单独作用的神经纤维长度为1 086.53 μm,与正常对照组的894.9 μm相比较有略微增长,虽然无显著差异(P>0.05),但提示人参皂苷Rg1对神经元保护作用可能与其维持神经纤维生长有关。按实验分组处理后,10 μmol/L t-BHP损伤后神经纤维长度(146.25 μm)较正常对照组(854.6 μm)有显著损伤,而10 μmol/L t-BHP+ 10 μmol/L人参皂苷Rg1组的纤维总长度(354.35 μm)较 10 μmol/L t-BHP损伤后神经纤维长度(146.25 μm)有所延长(P<0.05),见图5B~E。免疫印迹检测显示,10 μmol/L t-BHP+10 μmol/L人参皂苷Rg1组pGSK-3β蛋白较t-BHP单独损伤组水平有增加(图5E),提示人参皂苷Rg1能够通过pGSK-3β途径稳定神经元纤维,从而抵抗t-BHP诱导的损伤。
讨论
氧化损伤引起的过多神经元丢失与神经退行性疾病有密切关系[5]。大量实验证实神经退行性疾病中,神经元丢失多是由于凋亡通路被激活后诱发凋亡所致[6]。其中Bcl-2家族蛋白质是线粒体凋亡途径的主要调控因子,上调Bcl-2成为抑制神经退行性疾病的细胞凋亡相关药物的一类重要靶标。凋亡通路中一个重要的半胱氨酸蛋白酶成员caspase-3一直被认为是凋亡发生的执行者,实验证实caspase-3被抑制后细胞能够抵抗来自多种损伤的凋亡[7-8]。同时,两者是氧化损伤线粒体途径的重要节点。人参皂苷Rg1在多种细胞中验证能够减少细胞凋亡,例如Aβ1-42引起的PC12凋亡、MPP+诱导SH-SY5Y细胞凋亡等等[9-10]。本实验用t-BHP建立原代皮层神经元的衰老损伤模型,神经元可呈现与凋亡有关的衰老的细胞特征:MTT法显示细胞活性降低;免疫荧光显示caspase-3活化细胞增多;Hoechst 33342染色显示异常细胞核增多。而人参皂苷Rg1显著减轻了以上的衰老变化。
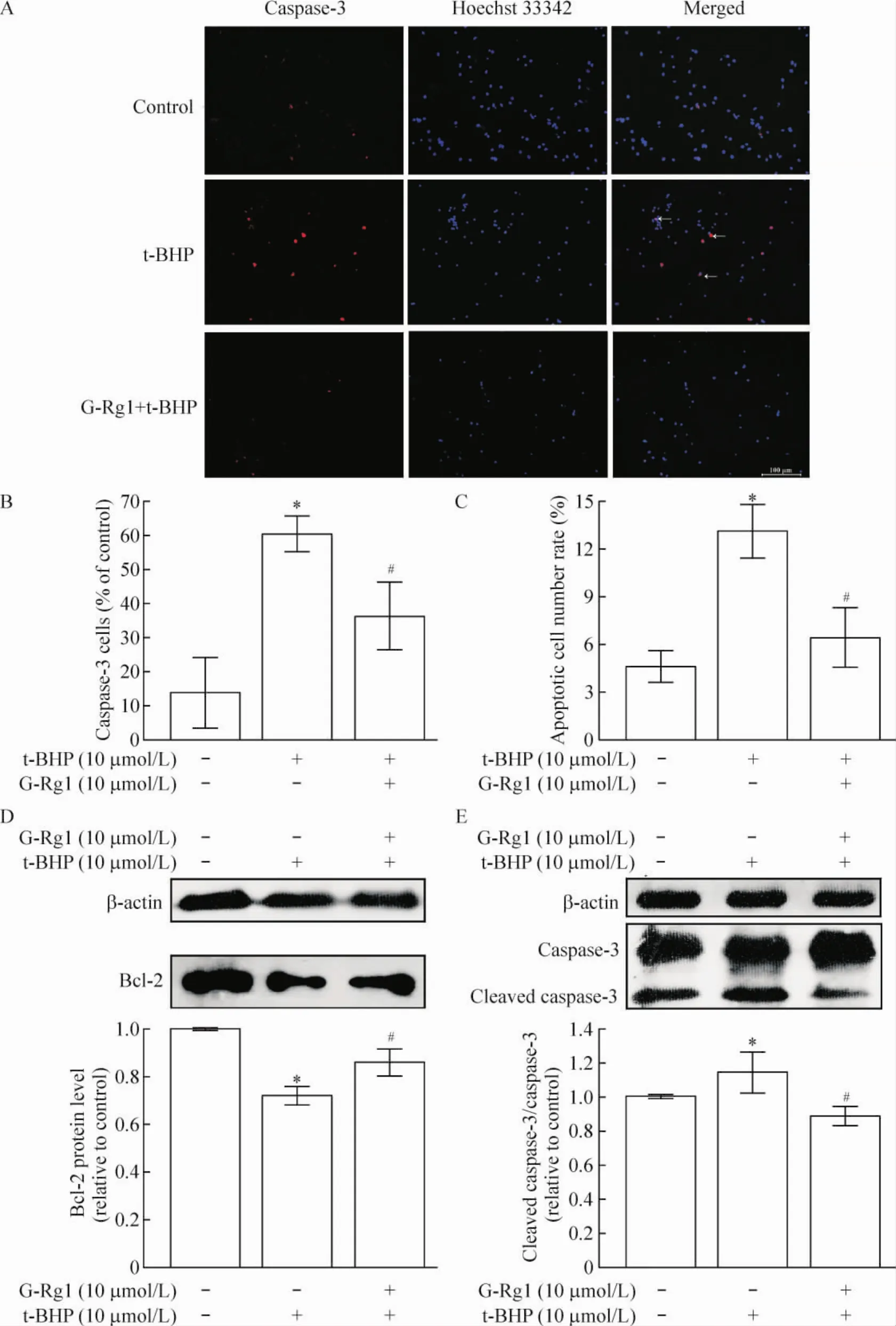
Figure 4.Effects of G-Rg1 on the activation of caspase-3 and the expression of Bcl-2 in t-BHP-induced primary rat cerebrocortical neurons.A~C:the immunofluorescence images showed remarkable changes using antibodies against caspase-3.The arrowheads pointed to examples of apoptotic cells marked by high intensity of blue fluorescence and nuclear condensation.D and E:Western blotting showed the expression of Bcl-2,cleaved caspase-3 and caspase-3.Mean±SEM.n=3.*P<0.05 vs control(no treatment);#P<0.05 vs t-BHP alone.图4 人参皂苷Rg1对t-BHP诱导的海马神经元caspase-3活化水平及Bcl-2蛋白表达的影响

Figure 5.Effect of G-Rg1 on the injuries of cerebrocortical neurons and pGSK-3β protein expression induced by t-BHP.A and B:neurons were treated with or without 10 μmol/L G-Rg1 for 24 h,and MAP-2 immunofluorescence staining was performed for quantitative analysis of total filament;C~E:neurons were treated with or without 10 μmol/L G-Rg1 and 10 μmol/L t-BHP,and their injuries were demonstrated using MAP-2 immunofluorescence staining;F:expression of pGSK-3β protein analyzed by Western blotting.Mean±SEM.n=3.*P<0.05 vs control(no treatment);#P<0.05 vs t-BHP alone.图5 人参皂苷Rg1对t-BHP诱导的大脑皮层神经元损伤及p-GSK-3β蛋白表达的影响
长时程增强是学习网络形成必不可少的神经系统活动,需要许多神经纤维被同时激活,神经元的纤维主要包括轴突树突,因此神经纤维的抗损伤能力越强,则越有利于神经网络的维持,而人参皂苷Rg1具有促进海马神经发生、增强学习和记忆力、抗衰老、提高神经可塑性的作用[11],学习记忆及神经可塑性方面的改善可能与其对神经纤维的影响有关,通过本实验以光镜观察及三维重建检测神经纤维长度及形态在模型组有明显损伤,而人参皂苷Rg1作用组神经纤维长度及形态有显著改善,证明人参皂苷Rg1对神经纤维生长有促进作用从而使神经系统网络的建立、树突轴突的成熟和稳定趋于完善。与生存有关的GSK-3蛋白主要有两种亚型,即GSK-3α和GSK-3β,GSK-3β还能作用于众多信号蛋白、结构蛋白和转录因子,调控糖原合成酶的活性,调节细胞的分化、增殖、存活和凋亡,而且活化的GSK-3β诱导tau蛋白的过度磷酸化,神经纤维过度缠结,神经元丢失,突触丢失,同时抑制GSK3β高表达能够稳定细胞微管的结构[12]。文献报道 pGSK-3β是抑制GSK-3β活化的调节方式,因此人参皂苷Rg1作用的神经元对抗t-BHP损伤与增加GSK-3β磷酸化有关。GSK3β本身能活化caspase-3,也可能是促使神经元细胞损伤(或凋亡)的一个重要机制[13-14]。本研究发现,人参皂苷Rg1组较t-BHP损伤组caspase-3蛋白活化的水平显著降低,进一步说明人参皂苷Rg1能够通过GSK-3β磷酸化升高而降低GSK-3β表达,从而抑制caspase-3的活化,达到抑制细胞凋亡的目的。另外,抑制GSK-3β,即磷酸化GSK-3β后,能够激活蛋白酶B通路,最终使得Bcl-2上调,引起凋亡抵抗[15-16]。本研究亦发现,人参皂苷Rg1组较t-BHP损伤组Bcl-2蛋白水平显著升高,细胞对抗t-BHP损伤的能力增强。
综上所述,人参皂苷Rg1能够通过磷酸化GSK-3β而抑制GSK-3β活性,从而在提高原代皮层神经元抗衰老和抗损伤方面具有重要的意义,但其作用途径及机制比较复杂,尚待进一步研究。
[1]王巧云,吴峰阶.人参皂苷Rg1对局灶性脑缺血再灌注大鼠脑组织NOS活性及蛋白表达的影响[J].中国病理生理杂志,2011,27(12):2328-2332.
[2]Fang F,Chen X,Huang T,et al.Multi-faced neuroprotective effects of Ginseno-side Rg1 in an Alzheimer mouse model[J].Biochim Biophys Acta,2012,1822(2):286-292.
[3]Wang Q,Sun LH,Jia W,et al.Comparison of ginsenosides Rg1 and Rb1 for their effects on improving scopolamine-induced learning and memory impairment in mice[J].Phytother Res,2010,24(12):1748-1754.
[4]Zhang JT,Qu ZW,Liu Y,et al.Preliminary study on antiamnestic mechanism of ginsenoside Rg1 and Rb1[J].Chin Med J(Engl),1990,103(11):932-938.
[5]Li WZ,Li WP,Zhang W,et al.Protective effect of extract of Astragalus on learning and memory impairments and neurons'apoptosis induced by glucocorticoids in 12-month-old male mice[J].Anat Rec(Hoboken),2011,294(6):1003-1014.
[6]Wines-Samuelson M,Schulte EC,Smith MJ,et al.Characterization of age-dependent and progressive cortical neuronal degeneration in presenilin conditional mutant mice[J].PLoS One,2010,5(4):e10195.
[7]Fuentealba RA,Liu Q,Kanekiyo T,et al.Low density lipoprotein receptor-related protein 1 promotes anti-apoptotic signaling in neurons by activating Akt survival pathway[J].J Biol Chem,2009,284(49):34045-34053.
[8]Gui C,Wang JA,He AN,et al.Heregulin protects mesenchymal stem cells from serum deprivation and hypoxia-induced apoptosis[J].Mol Cell Biochem,2007,305(1-2):171-178.
[9]Chang CS,Chang CL,Lai GH,et al.Reactive oxygen species scavenging activities in a chemiluminescence model and neuroprotection in rat pheochromocytoma cells by astaxanthin,beta-carotene, and canthaxanthin [J].Kaohsiung J Med Sci,2013,29(8):412-421.
[10] Chen XC,Fang F,Zhu YG,et al.Protective effect of ginsenoside Rg1 on MPP+-induced apoptosis in SHSY5Y cells[J].J Neural Transm,2003,110(8):835-845.
[11]Chu SF,Zhang JT.New achievements in ginseng research and its future prospects[J].Chin J Integr Med,2009,15 (6):403-408.
[12]Zhao MR,Li D,Shimazu K,et al.Fibroblast growth factor receptor-1 is required for long-term potentiation,memory consolidation,and neurogenesis[J].Biol Psychiatry,2007,62(5):381-390.
[13]Dewachter I,Ris L,Jaworski T,et al.GSK3beta,a centre-staged kinase in neuropsychiatric disorders,modulates long term memory by inhibitory phosphorylation at serine-9[J].Neurobiol Dis,2009,35(2):193-200.
[14]Goold RG,Owen R,Gordon-Weeks PR.Glycogen synthase kinase 3beta phosphorylation of microtubule-associated protein 1B regulates the stability of microtubules in growth cones[J].J Cell Sci,1999,112(Pt 19):3373-3384.
[15]Takashima A.GSK-3 is essential in the pathogenesis of Alzheimer's disease[J].J Alzheimers Dis,2006,9(3 Suppl):309-317.
[16]Pan JJ,Chang QS,Wang X,et al.Activation of Akt/ GSK3beta and Akt/Bcl-2 signaling pathways in nickeltransformed BEAS-2B cells[J].Int J Oncol,2011,39 (5):1285-1294.
Ginsenoside Rg1 protects primary rat cerebrocortical neurons against t-BHP-induced damage in vitro
LU Dan,SHU Xiao-ming,ZHANG Chan-juan,ZHAO Jia-yi,ZHU Li-hong,QI Ren-bin,WANG Hua-dong,LU Da-xiang
(Department of Pathophysiology,Institute of Brain Research,Key Laboratory of State Administration of Traditional Chinese Medicine,School of Medicine,Jinan University,Guangzhou 510632,China.E-mail:ldx@jnu.edu.cn)
AIM:To observe the effect of ginsenoside Rg1(G-Rg1)on tert-butyl hydroperioxideo(t-BHP)-induced injury in primary rat cerebrocortical neurons and their filaments.METHODS:Primary rat cerebrocortical neurons were randomly divided into normal group,10 μmol/L t-BHP induction group and 10 μmol/L t-BHP+10 μmol/L G-Rg1 treatment group.The MTT assay was used to detect the cell viability under various concentrations of t-BHP.3D cell reconstruction was performed to measure the filament length and number.The protein expression levels of Bcl-2,phosphorylated glycogen synthase kinase 3β(pGSK-3β)and caspase-3 were determined by the methods of immunofluorescence and Western blotting.RESULTS:G-Rg1 at concentration of 10 μmol/L reversed the decrease in cell viability,increased the protein expression level of Bcl-2 and pGSK-3β,and suppressed the activation of caspase-3 in t-BHP induction group(P<0.05).CONCLUSION:G-Rg1 increases the anti-stress ability of the neurons by increasing the pGSK-3β phosphoylation under the condition of t-BHP exposure.
Ginsenoside Rg1;Tert-butyl hydroperioxide;Glycogen synthase kinase 3β
R329.21
A
10.3969/j.issn.1000-4718.2014.03.017
1000-4718(2014)03-0479-07
2013-12-23
2014-01-20
国家重点基础研究发展计划(973计划)(No.2011CB707501);广州市科技计划项目重大专项(No.11BppZXaa2070006);国家自然科学基金资助项目(No.81371442)
△通讯作者Tel:020-85220004;E-mail:ldx@jnu.edu.cn
▲并列第1作者

