Tet-on调控的人HOXB4慢病毒载体构建
李秀英,白金萍,仲苓芝,李新娜,李文雪,李荣贵*
Tet-on调控的人HOXB4慢病毒载体构建
李秀英1,2,白金萍1,仲苓芝1,李新娜1,李文雪1,李荣贵1*
(1.吉林大学基础医学院病理学教研室,吉林长春130021;2.吉林大学中日联谊医院中心实验室,吉林长春130033)
目的 构建Tet-on调控的人HOXB4慢病毒载体,为体外扩增造血干细胞并保持其干细胞特性提供实验材料基础。方法 应用PCR技术从质粒TAT-HA-HOXB4-Full中扩增编码人HOXB4的cDNA,用限制性内切酶EcoRI分别酶切HOXB4基因片段和带有Tet-on开关的可调控慢病毒载体,经T4DNA连接酶连接获得慢病毒载体Teto-Fuw-hHOXB4。对构建的HOXB4慢病毒载体进行酶切片段凝胶电泳及DNA测序分析。结果 酶切片段电泳分析和DNA测序分析证明Tet-on调控的人HOXB4慢病毒载体构建成功。结论 正确构建了Tet-on调控的人HOXB4慢病毒载体,为后续的体外扩增造血干细胞及相关研究提供材料。
HOXB4;慢病毒载体,Tet-on
(Chin J Lab Diagn,2014:18:0175)
造血干细胞(hematopoietic stem cells,HSCs)移植是治疗血液系统疾病(如白血病、再生障碍性贫血等)、遗传代谢性疾病、淋巴瘤和自身免疫性疾病的重要手段之一[1]。目前,用于移植治疗的HSCs主要来源于骨髓和脐带血,但由于实际可获得的HSC数量有限,很难直接满足临床移植的需求。目前应用的旨在获得足量HSCs体外培养过程又极易导致HSCs向成熟血细胞分化而丧失其干细胞特性。因此,在体外培养过程中,保持HSCs自我增殖而防止其成熟分化是获取足量HSCs来满足临床移植需求的关键。
人HOXB4基因在HSCs中高表达,但是随着HSCs向成熟血细胞分化,其表达量逐渐降低[2]。研究表明,HOXB4表达可以促进胚胎干细胞向HSCs分化,并且可以防止造血干细胞向成熟血细胞分化[3,4]。这些研究结果表明:HOXB4在HSCs自我更新及多向分化选择过程中起开关作用,是决定人HSCs特定细胞表型的转录因子。然而到目前为止,通过调控HOXB4基因表达来决定体外培养中HSCs命运的研究却很少报道。
慢病毒介导的基因转导是最有效的将外源DNA导入真核细胞的方法之一,已被广泛用于那些通常应用质粒载体转染难以成功的各类细胞(其中包括HSC)的转导。根据需要对外源基因在受体细胞的表达能够进行实时调控是研究者追求的最理想的目标。Te-on是目前应用最广的基因表达调控系统,其特点是外源基因在未经诱导条件下几乎不表达,加入诱导剂(四环素或强力霉素)后其调控的基因表达很快达高水平,诱导剂本身在应用的剂量对受体细胞无任何毒副作用。本研究应用的载体骨架Teto-FUW为受tet调控的慢病毒载体,其优点是:对细胞转导效率高,且可根据需要调控基因表达。
本研究利用PCR、限制性酶切、DNA重组等分子生物学技术成功的构建了Tet-on调控的人HOXB4慢病毒载体Teto-FUW-hHOXB4,为在体外扩增造血干细胞及相关研究提供了实验材料。
1 材料与方法
1.1 材料
包含人HOXB4全长编码序列的质粒HOXB4-HA-TAT-tag pET由美国由瑞典卡罗林斯卡医学院祝捷教授惠赠,慢病毒载体Teto-FUW-OSKM、宿主工具大肠杆菌DH5a;Taq DNA聚合酶、T4 DNA连接酶、限制性内切酶EcoR I和DL2000 Marker均购自TaKaRa公司(大连,中国),PCR产物凝胶回收试剂盒和质粒提取试剂盒均购自Axygen(硅谷,美国)。
1.2 PCR反应
根据GenBank(NM_024015)中人HOXB4cDNA序列设计引物并分别在上游引物起始密码前及下游引物终止密码后引入EcoR I酶切位点。引物由上海生工生物技术服务有限公司合成。引物序列为:(上游引物5’-ACGTGAATTCATGGCTATGAGTTCTTTTTTGATCAAC-3’;下游引物:5’-ACGTGAATTCCTAGAGCGCGCGGGGGCCTC-3’)。PCR反应在25μl体系内进行。由1xPCR buffer,1.5μM MgCl2,0.8μM dNTP,0.2μM引物,12.5UTaq酶和100ng模板DNA组成。PCR反应程序为94℃预变性2min;94℃变性45s,60℃退火30s,72℃延伸1min,35个循环;72℃延伸5min。PCR产物经1.5%琼脂糖凝胶电泳,在紫外灯下分离目的条带并应用凝胶回收试剂盒按照厂家说明书回收PCR扩增产物。
1.3 质粒DNA的提取、酶切、连接及DH5α细胞的转化
1.3.1 质粒DNA的提取 挑取菌液,接种于4 mL含氨苄(50μg/ml)LB液体培养基中,37℃、300rpm·min-1振荡培养过夜。次日,菌液离心、集菌、倒掉上清液。按照Axygen质粒提取试剂盒说明书提取质粒DNA,进行1.5%琼脂糖凝胶电泳初步鉴定。
1.3.2 酶切及连接 用限制性内切酶EcoR I酶分别对PCR扩增的HOXB4基因片段、tet-on慢病毒载体及重组质粒进行酶切。酶切反应在37℃水浴中进行2小时后,将HOXB4编码区DNA片段及慢病毒载体酶切产物进行1.5%琼脂糖凝胶电泳,然后用凝胶回收试剂盒回收纯化酶切产物。将回收的酶切片段加入T4连接酶连接,16℃过夜连接。
1.3.3 DH5α细胞的转化 取一支E.coli DH5α感受态细胞,向其内加入连接产物,混匀后冰中放置30min,42℃热击60s,冰浴2-3min,再向感受态细胞中加入900μl LB培养基,37℃温和振荡细胞60 min后,6 000rpm/min离心45s,弃掉900μl培养基后混匀细胞,取100μl涂布于含氨苄(50μg/ml)的LB平板上,37℃倒置培养箱培养18h,观察菌落生长情况。
1.4 质粒DNA测序分析
将重组质粒送上海生工生物技术服务有限公司测序。引物为通用引物CMV,将测序结果与Gen-Bank中的HOXB4基因序列进行比对。
2 结果
2.1 获取编码人HOXB4全长cDNA
为载体构建的方便,分别在人HOXB4编码区两端引入EcoRI酶切位点。这一目的是通过设计特定引物并对HOXB4编码区进行PCR扩增来实现的。图1展示的是PCR产物的琼脂糖凝胶电泳图。图中清晰可见单一的PCR产物,其分子量约为750bp,与人HOXB4编码区的长度相符,表明成功地获得了载体构建所需的人HOXB4编码区的cDNA片段。
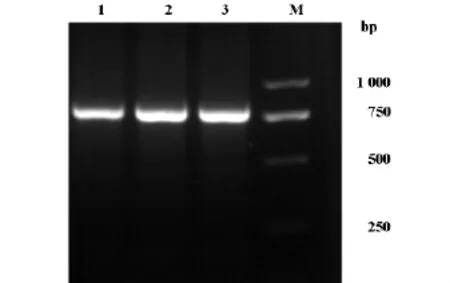
图1 HOXB4基因琼脂糖凝胶电泳图
2.2 获取阳性克隆
为减少获取阳性转化细胞克隆筛查的工作量,本研究直接以菌体作为模板进行PCR扩增,图2展示的是两个阳性细菌克隆PCR产物的电泳图。图3是从两个阳性克隆提取的质粒DNA经EcoRⅠ酶切后的电泳图。图中清晰可见两条酶切片段。其分子量大小分别与插入片段(750bp)及空载(8 300 bp)相符,表明HOXB4编码区cDNA片段已经成功插入空载体。
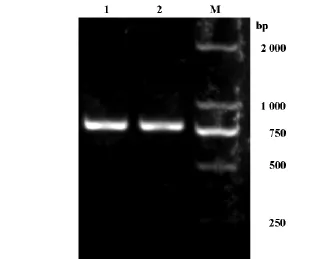
图2 重组质粒阳性克隆PCR产物琼脂糖电泳

图3 HOXB4重组质粒经EcoRⅠ酶切凝胶电泳图
2.3 DNA测序分析确证tet-on调控的人HOXB4慢病毒载体构建成功
由于采用同一限制性内切酶(EcoRI)对慢病毒载体及HOXB4编码DNA片段进行酶切,插入成分的两端均以EcoRI粘性末端与载体碱基互补链接,这就使得在连接过程中存在反向连接的可能。另外由于Taq DNA聚合酶的低保真性,在其催化的PCR反应中也会偶发碱基配对错误。为排除反向连接及PCR反应中偶发的碱基配对错误的可能,确定构建载体的正确性,对Teto-Fuw-hHOXB4进行了DNA测序分析。其测序结果与GenBank关于人HOXB4cDNA序列完全一致(如图4所示)。根据测序分析所用引物与HOXB4插入成分的比邻关系证明插入方向的正确性。这一结果表明编码人HOXB4全长cDNA)已成功地按设计要求插入表达载体中,即成功地完成了Tet-on调控的人HOXB4慢病毒表达载体的构建。
3 讨论
慢病毒表达载体Teto-FUW-hHOXB4具有可调控目的基因表达和转导效率高等优点,其转导HSCs后,可以在体外大量扩增HSCs的同时防止其分化,可解决临床应用中HSCs数量不足的问题。
目前应用的将外源DNA导入真核细胞的载体有病毒载体和非病毒载体,非病毒载体因转染HSCs效率极低而无法应用。病毒载体又包括腺病毒、逆转录病毒和慢病毒载体。原始HSCs细胞本身缺乏腺病毒受体,因此腺病毒载体不能直接使目的基因导入HSCs细胞内。与逆转录病毒相比,慢病毒载体具有更广的转导细胞范围,因而有更广泛的应用价值,更容易获得的各种来源的间充质干细胞。故本研究选择慢病毒载体作为载体的骨架。
本研究采用的Tet-on系统是一个比较成熟的真核生物外源基因诱导表达系统,具有高效、无毒、开关较严密等优点。Teto-FUW慢病毒载体的结构包括FUW慢病毒骨架、强力霉素(四环素相似物)操纵基因和Tet-on开关。感染细胞后可以通过强力霉素DOX来调控目的基因表达,调控后可做自身对照进而避免插入位置不同所引起的表达差异。
HSCs在体外扩增过程中会难以避免地发生分化,并且扩增后造血细胞的自我更新能力和重建造血能力均有所降低[6]。研究表明,如果HOXB4在脐血CD34+细胞中高表达,可以使其在体内获得竞争性生长的优势,并且不影响CD34+细胞向成熟血细胞分化的功能[7]。还有研究表明,用逆转录病毒载体感染小鼠CD34+细胞,高表达HOXB4的CD34+细胞在体外培养两周后扩增出约40倍的具有造血功能的HSCs,扩增出的造血干细胞向成熟血细胞分化能力未受到影响[3]。正是由于HOXB4的表达与维持HSC自我更新等干细胞特性相关,故本研究构建了Tet-on调控的人HOXB4慢病毒载体Teto-FUW-hHOXB4。体外转染Teto-FUW-hHOXB4可以大量扩增HSCs,且可通过DOX来调控HOXB4的表达。
骨髓和脐血是HSCs的主要来源。骨髓造血干细胞获得具有侵入性,而脐血干细胞中HSCs数量有限,故HSCs来源不足限制了其临床应用。在体外,如果采用慢病毒载体Teto-FUW-hHOXB4感染HSCs,使其在体外大量扩增不分化,将缓解临床中HSCs不足的问题。

图4 测序结果与GenBank序列blast结果
本实验应用PCR,DNA重组等分子生物学技术构建出安全、稳定、高表达的慢病毒载体,经酶切和DNA测序鉴定目的基因HOXB4正确插入慢病毒载体内,为后续体外扩增HSCs提供实验材料。
[1]Tsuji Y.Hematopoietic stem cell transplantation for 30patients with primary immunodeficiency diseases:20years experience of a single team[J].Bone Marrow Transplant,2006,37(5):469.
[2]Sauvageau G.Differential expression of homeobox genes in functionally distinct CD34+subpopulations of human bone marrow cells[J].Proc Natl Acad Sci USA,1994,91(25):12223.
[3]Antonchuk J,G Sauvageau,and RK Humphries.HOXB4-induced expansion of adult hematopoietic stem cells exvivo[J].Cell, 2002,109(1):39.
[4]Bowles KM.HOXB4overexpression promotes hematopoietic development by human embryonic stem cells[J].Stem Cells,2006,24(5):1359.
[5]Li Z.Murine leukemia induced by retroviral gene marking[J].Science,2002,296(5567):497.
[6]Shih CC.Long-term ex vivo maintenance and expansion of transplantable human hematopoietic stem cells[J].Blood,1999,94(5):1623.
[7]Schiedlmeier B.High-level ectopic HOXB4expression confers a profound in vivo competitive growth advantage on human cord blood CD34+cells,but impairs lymphomyeloid differentiation[J].Blood,2003,101(5):1759.
The construction of Tet-on regulating lentiviral vector Containing Human Gene HOXB4
LI Xiu-ying1,2,BAI Jin-ping1,ZHONG Ling-zhi1,et al.
(1.Department of Pathology,School of Basic Medical Sciences,Jilin University,Changchun130021,China;2.Central laboratory,China-Japan union hospital,Jilin University,Changchun130033,China)
Objective The recombined lentiviral vector which containing Tet-on and Human HOXB4was constructed in order to provide the material basis for proliferating of hematopoietic stem cells and maintaining properties of stem cells in vitro.Methods Polymerase chain reaction(PCR)was used to amplify HOXB4gene from the plasmid TATHA-HOXB4-Full.Both HOXB4gene and the lentiviral vector containing Tet-on were digested by EcoRI,recovered,and ligated through T4DNA ligase to obtain Teto-Fuw-hHOXB4.The recombinant lentiviral vector was checked by restriction enzyme digestion and DNA sequencing.Results Both restriction enzyme digestion and DNA sequencing demonstrated that the HOXB4gene was inserted into the lentiviral vector correctly.Conclusion The Teto-Fuw-hHOXB4 lentiviral vector is constructed,and provided the material basis for proliferating of hematopoietic stem cells in vitro.
HOXB4;Lentiviral vector;Tet-on
Q5
A
李秀英(1986-),女,在读医学博士。
2013-10-18)
1007-4287(2014)02-0175-04
国家自然科学基金资助项目(21277057)
*通讯作者
——一道江苏高考题的奥秘解读和拓展

