重组人促红细胞生成素对兔耳皮肤缺损创面愈合的影响
韩凌宇,刘麒麟,孙 宾,刘士维,卢 浩,张 伟
重组人促红细胞生成素对兔耳皮肤缺损创面愈合的影响
韩凌宇,刘麒麟,孙 宾,刘士维,卢 浩,张 伟*
(吉林大学口腔医学院口腔颌面外科,吉林长春130021)
促红细胞生成素(erythropoietin,EPO)是哺乳动物体内的一种糖蛋白激素,其主要功能是促进红系祖细胞增殖、分化及成熟。EPO主要由肾脏合成,除此以外,人类皮肤毛囊也可以合成EPO,并表达EPO受体(EPOR),可见皮肤不但是EPO的合成器官,也是EPO的靶器官。本实验,我们通过建立兔耳皮肤缺损创面,将rHuEPO局部应用于皮肤创面,与金因肽(重组人表皮生长因子)作对照,观察rHuEPO对皮肤缺损创面愈合及上皮化的作用。为皮肤缺损创面愈合治疗寻找一种新的药物及给药途径提供理论依据。
1 材料与方法
1.1 材料
1.1.1 动物 清洁级健康日本大耳白兔24只,体重2.5-3.0kg,雌雄不限,由吉林大学动物实验中心提供,动物分笼饲养,统一饲料。
1.1.2 药物及试剂 济脉欣(3000IUEPO注射液)华北制药金坦生物技术有限公司,国药准字S20000026;金因肽(重组人表皮生长因子)2000IU深圳市华生元基因工程有限公司,国药准字S20010037.北京博奥森生物技术有限公司生产的VEGF血管内皮生长因子羊抗兔多克隆抗体(编号:bs-0279R),抗体工作比例为1∶50。1.1.3 主要仪器 显微镜:日本奥林巴斯(BX51TPHD-J11);多功能真彩色细胞图象分析管理系统:美国Media Cybernetics公司Image-Pro Plus.
1.2 方法
1.2.1 动物模型制作及分组 速眠新0.1mg/kg肌注麻醉,显效后,剔除兔耳腹侧及背侧毛发,碘伏消毒,常规铺巾,于每只兔耳腹侧面同一部位画出直径为1cm的圆,并切除圆内皮肤全层,保留软骨膜及软骨。创面缺损模型共计48个,24只白兔每6只兔子为一组,随机分为4组,其中A组为生理盐水组1次/日,B组为低浓度300IUrHuEPO组1次/日,C组为3000IUrHuEPO组1次/日,D组为2000IU/ml金因肽(重组人表皮生长因子)组1次/日。
术后创面每日换药一次,每次每创面均匀滴敷1滴(0.3ml),40万IU庆大霉素注射液肌注5天,各组实验动物喂养期间活动及进食水良好。
1.2.2 取材 术后3d,12d用空气栓塞法处死实验用兔。沿创面边缘外0.5cm切取兔耳全层组织,沿圆形创面中间纵行剖开,10%福尔马林固定,石蜡包埋,制片备用,行组织学检查。
1.2.3 免疫组化 UltraSensitiveTM S-P法,采用生物素标记的第二抗体与链霉菌抗生物素蛋白连接的过氧化物酶及底物色素混合液来测定细胞和组织中的抗原。①石蜡切片脱蜡和水化后,用PBS(pH=7.4)冲洗3次,3次×3min;②1%甲醇双氧水,室温10min,蒸馏水洗1次,0.1MPBS洗3次× 5min;③将切片放入抗原修复液中加热至97度,保持15min后自然冷却,PBS洗3次,3次×3min;④切片上滴加正常山羊血清封闭液,室温20min。甩去多余液体,不洗;⑤切片上滴加切片上滴加一滴VEGF血管内皮生长因子抗体(1∶50),4℃过夜,0.1MPBS洗3次×5min。⑥切片上滴加生物素化羊抗兔的IgG(1∶50),37℃20min,0.1MPBS洗3次×5min;⑦切片上滴加辣根酶标记链霉卵白素工作液(S-A/HRP),37℃20min,0.1MPBS洗3次× 5min;⑧DAB显色。
1.3 检测指标
1.3.1 创面形态学观察及创面愈合率 分别术后3d,12d随机选取12只兔子对24个创面进行摄影。应用AUTO CAD软件测出各创面面积,并计算伤口愈合率:伤口愈合率=[(原始创面面积一未愈合创面面积)/原始创面面积]×100%[1]。
1.3.2 组织病理学观察 造模后3d、12d光下观察HE染色切片组织病理学变化,并参照Eldad等[2]与都义日[3]等所采用的方法。制定皮肤创面愈合的组织病理学评价标准,见表1。

表1 组织病理学评价标准
1.3.3 免疫组织化学检测 VEGF阳性判定标准:VEGF阳性表达以胞浆、胞膜有棕黄色颗粒为准。VEGF含量的判定:采用计算机自动图像分析系统,在高倍镜下(400倍)随选取创面及创周5个不同的视野,测定其阳性细胞所占比例,以及阳性细胞显色的强度,以二者的乘积IHS=A×B来表示抗原表达量[4]。评分标准:A为阳性细胞数分级0~1%=0、1~10%=1、10~50%=2 50~80%=3、80~100%=4;B为阳性细胞显色强度分级0(阴性)、1(弱阳性)、2(阳性)、3(强阳性)。
1.4 统计学处理
采用SPSS17.0统计学软件进行统计学分析,实验数据以_x±s表示,组间比较采用One-way ANOVA。
2 结果
2.1 创面形态学观察及创面愈合率
2.1.1 大体观察 观察期间(0-12d),皮肤创面随时间增加愈合率在提高。造模后第3d,各组创面均有渗出并结痂,结痂下可见毛细血管新生,各个创面均未见明显上皮覆盖(如图1);造模后12d,B组,D组创面迅速缩小,愈合明显较A组及D组快(如图2)。
2.1.2 创面愈合率 造模后3d,各组创面愈合率差异不明显(P>0.05)。造模后12d,C组和B组的创面愈合率均明显高于A组(P<0.01),见图3。
2.2 组织学检查结果
2.2.1 HE光镜检查结果 造模后第3天,各组创面以渗出和出血为主,肉芽组织生长较少。各组创面组织学评分未见明显差异;造模后第12天,D组较多肉芽均匀覆盖创面,有大量胶原形成,上皮细胞及成纤维细胞增生明显。C组上皮细胞沿创缘覆盖部分创面,B组与A组上皮化速度较慢,但毛细血管增生活跃。B组C组及D组创面组织学评分均较A组高(P<0.01)。造模后第3,12d,各组创面组织学评分见图4。
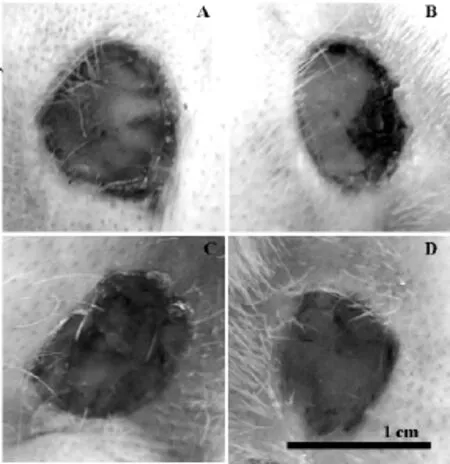
图1 造模后3 d各组创面愈合
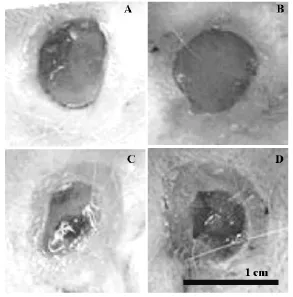
图2 造模后12 d各组创面愈合

图3 各组创面愈合率

图4 各组创面组织病理学评分比较
2.3 创面组织VEGF的表达情况 造模后3d创面周边及创面内部各组VEGF阳性细胞面积比B组C组明显高于A组及D组(P<0.01)(见图5);造模后12d,B组C组D组均较A组高(P<0.01)(见图6)。造模后3d,12d创面VEGF的表达评分结果见图7。
3 讨论
皮肤创面修复是机体应答皮肤损伤所表现的一个复杂的生物学过程,主要包括局部炎症反应阶段,细胞增殖分化阶段和组织重建阶段。局部微环境的变化包括创伤局部各种细胞,细胞外基质及生长因子等的相互作用,对创面愈合有极大影响。促红细胞生成素(EPO)主要作用于监管血细胞的生成,但也存在各种各样的非造血功能。最近的数据显示[5],促红细胞生成素与保护各种器官组织遭受缺血和再灌注损伤以及改进组织再生有关,尤其是皮肤组织。

图5 造模后3 d(100倍)光镜下VEGF免疫组化染色结果

图6 造模12 d(100倍)光镜下VEGF免疫组化染色结果

图7 各组VEGF阳性细胞面积×染色强度
本实验结果证明:高剂量rHuEPO组可以加快创面上皮化。伤口愈合的早期(3d),各组间差异不大,此时创面以充血渗出为主,伤口愈合的中晚期(12d),伤口细胞处于快速增殖期,使用高剂量rHuEPO组创面封闭面积明显大于生理盐水组和使用低剂量rHuEPO组。研究证实,角质细胞的再上皮化被认为是皮肤伤口愈合过程中的重要环节,角质细胞是高剂量应用外源性促红细胞生成素后最可能的靶细胞。Farhani和Kloth[6]认为创面愈合率与由于EPO创造的抗凋亡环境可能解释其加速愈合的能力。因此,局部使用高剂量rHuEPO能明显加快上皮化,可能与它能降低凋亡程度和组织的凋亡敏感度有关。
通过创面各组织病理学观察结果:造模后12d使用低剂量rHuEPO组创面肉芽组织较生理盐水组生长良好,创面毛细血管腔明显增多,较多深染的成纤维细胞,少量胶原纤维散在于新生肉芽组织之间。成功的组织修复需要在早期愈合阶段有肉芽组织的生成,以及后期阶段肉芽组织的吸收,目前大多学者[7]研究认为EPO加速肉芽组织的吸收,加快新生真皮层的改建,这可能与减少细胞多样性,特别是降低炎症细胞水平有关。
VEGF是血管内皮生长因子,其在创面的表达含量能够反映新生血管及淋巴管的能力,从而促进创面愈合[8]。具有新功能的毛细血管组织的形成包括内皮细胞活化、迁移、细胞排列、增殖、小管形成,出现分支,吻合,成熟的间隙连接以及周围的基底膜,这其中每个阶段都受VEGF影响。Jaquet[9]的实验表明EPO与VEGF具有相当的促血管形成作用,且在这一过程中,EPO可能作为一种直接的促血管新生物质起作用。本实验结果与Buemi[10]报道一致,局部使用rHuEPO可以提高创面VEGF的含量,并且随浓度的增高而增加,并且认为血管增生可以为创面胶原合成提供更多的氧气及营养物质。本实验表明rHuEPO通过刺激毛细血管新生,增加VEGF表达并抑制细胞凋亡来改善创面愈合。此外,EPO可能促进创面愈合起着间接的作用,比如影响血液和免疫系统,需要进一步实验阐明确切机制。
综上,局部使用rHuEPO能上调创面VEGF表达水平,提高创面愈合速度和质量。
[1]郑高云,吴 旭,李钰珑,等.促进伤口愈合的蜕皮甾酮乳膏的制备及量效分析[J].南方医科大学学报,2008,28(5):828.
[2]Eldad A,Weinberg A,Breiterman S,et al.Early nonsurgical removal Of chemically injured tissue enhances wound healing in partial thickness burns[J].Bums,1998,2(24):166.
[3]都义日,付小兵,李存保,等.碱性成纤维细胞生长因子复合骨髓间充质干细胞的促创面愈合作用[J].中华创伤杂志,2005,21(4):290-293.4.
[4]Soslow R,Dannenberg A,Rush D,et al.Cox-2is expressed in human?pulmonary,colonic,and mammary tumors Cancer[J].2000,12(89):2637.
[5]Heiko S,Yves H,Christian K.The Nonhematopoietic Effects of Erythropoietin in Skin Regeneration and Repair:From Basic Research to Clinical Use[J].Medicinal Research Reviews,2012,1(1):1.
[6]Farahani R,Kloth L.The hypothesis of biophysical matrix contraction:wound contrction revisited[J].Int Wound,2008,5(3):477.
[7]Buemi M,Vaccaro M,Sturiale A,et al.Recombinant human erythropoietin influences revascularization and healing in a rat model of random ischaemic flaps[J].Acta Derm Venereol,2002,82(6):411.
[8]Eming SA,Krieg T,Davidson JM.Inflammation in wound repair:Molecular and cellular mechanisms[J].Invest Der matol,2007,127(9):514.
[9]Jaquet K,Krauae K,Tawakol-Khodai M,et al.Erythropoietin and VEGF exhibit equal angiogenic potential[J].Microvascular,2002,64(2):326.
[10]Buemi M,Galeano M,Sturiale A,et al.Recombinant human erythropoietin stimulates angiogenesis and healing of ischemic skin wounds[J].Shock 2004;22(6):169.
2013-02-10)
1007-4287(2014)02-0191-04
*通讯作者

