新型钾通道开放剂(QO-58)在大鼠体内药代动力学研究
刘灿仿,祁金龙,张海林,贾庆忠
QO-58化合物是河北医科大学药理学实验室经过高通量筛选发现一个结构全新的钾通道开放剂,对电压依赖性M通道(KCNQ2/3通道)有良好开放活性。细胞学实验结果显示QO-58开放KCNQ213通道的 EC50为0.06μmol·L-1,优于国外已上市的第一个抗癫痫KCNQ通道开放剂retigabine(EC50,0.43μmol·L-1)[1-2]。初步药理毒理学实验结果表明,该化合物对小鼠戊四唑诱发的癫痫和电刺激引发的惊厥均有较好的治疗作用,对缓激肽诱导的炎性疼痛也有效[3],且未见明显毒性。QO-58为吡唑并[1,5-a]嘧啶酮类化合物,由于其结构新颖,生物活性高,我们已经申请了中国及美国专利保护[4-5],继续研究有望获得一种具有完全自主知识产权的抗癫痫、镇痛一类新药。为了弄清楚该化合物在体内的吸收、分布规律,并指导进一步的药理毒理学研究中动物给药剂量及方式,同时作为新药临床前研究的一部分,我们建立RP-HPLC法,对QO-58在大鼠体内的药代动力学特征进行了研究。
1 材料与方法
1.1 材料
1.1.1 仪器和器材 岛津LC-20A高效液相色谱系统:包括 LC-20AT二元泵,CTO-20A柱温箱,SPD-M20A检测器,SIL-20A自动进样器,LC-solution色谱工作站。Eppendorf centrifuge 5417R型高速离心机。
1.1.2 主要试剂[6]QO-58结晶高纯品由河北医科大学新药开发研究室提供(批号:2010003),纯度为99.5%;色谱纯乙腈和甲醇由德国Merck(Honeywell)公司提供;聚氧乙烯蓖麻油为注射级(Cremophor ELP),由河北医科大学药厂提供;尼群地平标准品:中国药品生物制品鉴定所提供(批号:100585-200602)。
1.1.3 实验动物 健康成年的清洁级SD大鼠,共24只,♀♂各半,体质量220~250 g,购于河北省实验动物中心,合格证号:110305。实验前禁食12 h,自由饮水。
1.2 方法
1.2.1 灌胃用QO-58溶液 取QO-58原料药适量,用适量溶剂(N,N-二甲基乙酰胺 ∶聚氧乙烯蓖麻油=1∶9)溶解,得到备用溶液。
1.2.2 色谱条件[7]色谱柱:Shim-pack VP-ODS C18(250 mm×4.6 mm,5μm);乙腈 ∶0.2 mol·L-1乙酸铵 =43∶57等度洗脱;流速 1 ml·min-1;检测波长285 nm;柱温:35℃;进样量:20μl。
1.2.3 给药与血浆样品采集 大鼠禁食12 h,取“1.2.1”所配 QO-58溶液按25、50、100 mg·kg-1剂量灌胃,分别于给药后 0.5、1、2、4、6、9、12、18、24、36、48、72 h由眼眶静脉丛取血0.5 ml,收集于肝素化的离心管内,4 000 r·min-1离心 10 min,分离出血浆并于-20℃冻存待测。
为计算灌胃不同剂量的QO-58的绝对生物利用度,按15 mg·kg-1大鼠尾静脉注射给予QO-58溶液,于给药后 0.083、0.167、0.333、0.666、1、1.5、2、3、4、8、12、24 h由眼眶静脉取血0.5 ml,处理过程同上。另取同批次大鼠6只,制备空白血浆。
1.2.4 血浆样品处理 取大鼠血浆200μl,加入内标尼群地平的乙腈溶液(220 mg·L-1)30μl,加入乙腈 800μl,涡旋混匀,12 000 r·min-1离心 10 min,取上清液900μl,室温氮气吹干,残渣加100μl乙腈溶解,超声处理5 min,12 000 r·min-1离心 10 min,取上清20μl进样分析。
1.2.5 数据分析 将所得血药浓度-时间数据用药动学软件DAS2.1.1版软件处理进行拟合,求算QO-58在大鼠体内经灌胃给药和静脉给药后的药动学参数。
2 结果
2.1 方法的专属性 取大鼠空白血浆,除不加内标溶液外,其余按照“1.2.4”项下方法处理并分析,获得空白样品的色谱图(Fig 1A);将规定浓度的QO-58标准溶液和内标溶液加入大鼠空白血浆,获得模拟生物样本色谱图。QO-58的保留时间7.8 min,内标尼群地平保留时间为10.0 min(Fig 1B);取大鼠灌胃给药后的血浆样品,同法操作,得色谱图(Fig 1C),样品峰和内标完全分离,且血浆中的内源性物质及其他杂质不影响样品的分离及测定。
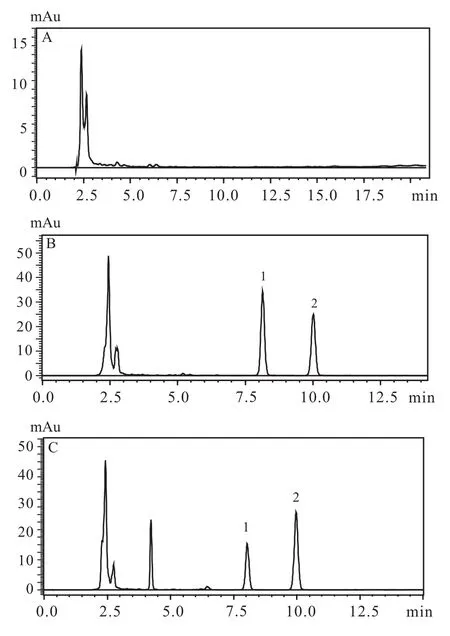
Fig 1 HPLC chromatograms of QO-58 in rat plasma
2.2 标准曲线制作 取空白血浆200μl,精密加入含计算量QO-58的等体积对照品贮备液,配制成质量浓 度为0.1、0.5、2、5、10、20、40、160mg·L-1的样品。按血浆样品的处理项下方法依法操作,进样20μl,记录色谱图。以药物的浓度为横坐标X,药物和内标物峰面积比值为纵坐标Y,用加权最小二乘法进行回归运算,求得直线回归方程即为标准曲线。
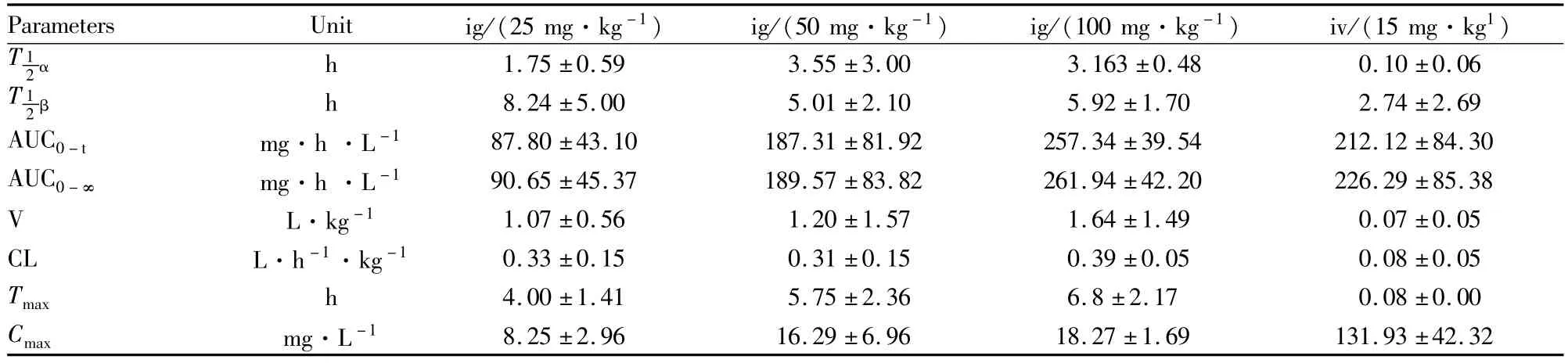
Tab 1 Pharmacokinetic parameters of QO-58 in four groups(¯x±s)
在0.1~160 mg·L-1范围内,QO-58血浆药物浓度与QO-58和内标的色谱峰面积比线性关系良好,线性回归方程为:Y=0.0337X-0.0018,(r=0.9989)。
2.3 最低定量限(LOQ) QO-58的检测限、定量限分别在信噪比 S/N=3和S/N=10的标准下测定,该方法的定量限为0.1 mg·L-1,检测限为0.025 mg·L-1。
2.4 精密度和准确度 制备低、中、高(0.3、20、160 mg·L-1)3种浓度的 QO-58的质控(QC)样品,每个浓度平行测定5份,连续测定5 d。日内精密度RSD(n=5)分别为 6.89%、4.06%、6.01%;日间精密度 RSD(n=5)分别为 17.06%、5.69%、11.34%,准确度RE%均小于20%,符合药动学研究要求[8]。
2.5 提取回收率实验 按“1.2.4血浆样品处理”项下方法配制QO-58在血浆中的低、中、高3个浓度的QC样品,以提取后的色谱峰面积与未经提取直接进样获得的色谱峰面积之比,考察样品的提取回收率。每一浓度进行6样本分析。3种浓度下提取平均回收率分别为89.56%、101.38%、99.42%,符合药动学研究要求。
2.6 稳定性 按照前述血浆样品处理方法制备低、中、高3种浓度的QO-58的QC血浆样品各3份,测定浓度的平均值,分别考察在室温放置2 h、4℃放置1周和-20℃放置18 d,及3次冻融循环处理后在室温条件下的稳定性。结果表明:低、中、高3个浓度血浆样品浓度的RSD均小于9.38%,表明血浆样品稳定性良好。
2.7 QO-58在大鼠体内的药物动力学 大鼠分别按照 25、50、100 g·kg-1剂量灌胃和 15 mg·kg-1剂量尾静脉注射给予QO-58后,不同时间点取血测量得到血药浓度数据。血药浓度-时间曲线图见Fig 2、3。DAS2.1.1版软件拟合QO-58在大鼠体内药代动力学均符合二室模型,处理所得药动学参数见Tab 1。
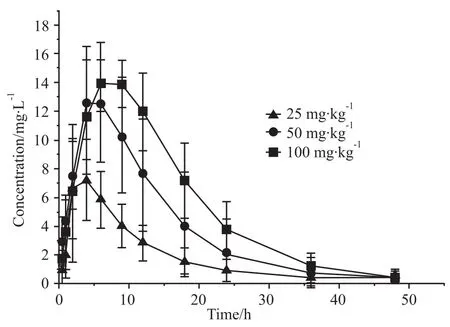
Fig 2 Mean plasma concentration-time curves of QO-58 after oral administration of 25 mg·kg-1,50 mg·kg-1 and 100 mg·kg-1 QO-58(n=6)
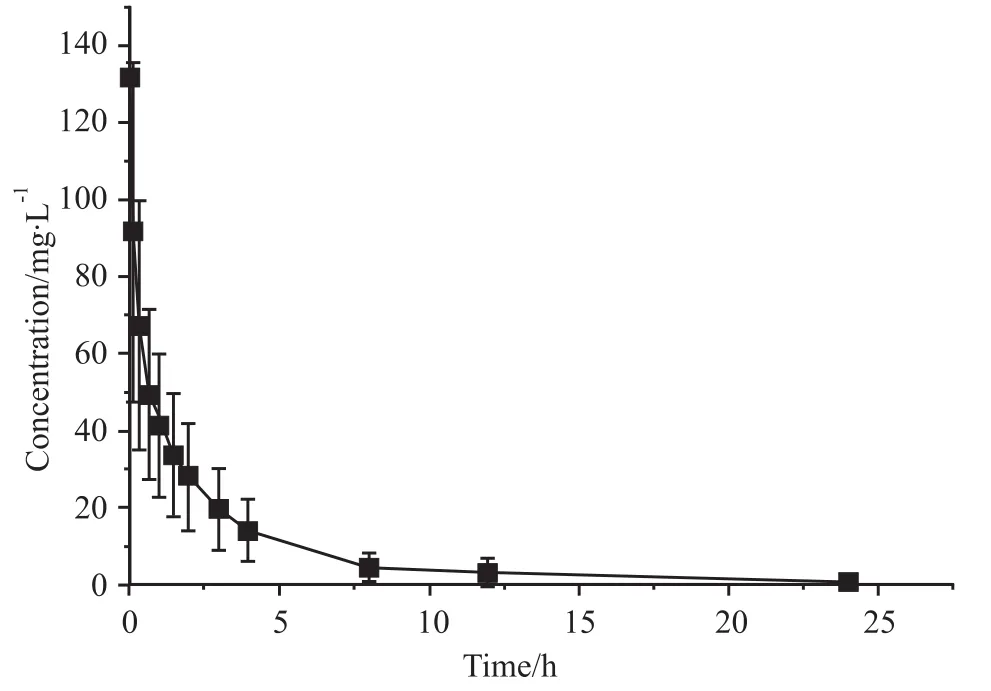
Fig 3 Mean plasma concentration-time curves of QO-58 after intravenous administration of 15 mg·kg-1 QO-58(n=6)
大鼠灌胃 25、50、100 mg·kg-1剂量 QO-58与相对静脉注射15 mg·kg-1剂量QO-58的绝对生物利用度分别为24.84%、26.49%、18.20%。
3 讨论
血浆样品中QO-58的含量测定采用乙腈直接沉淀蛋白,操作简单、方便、回收率达到生物样品分析要求。经过流动相配比及选择后确定采用乙腈∶0.2 mol·L-1乙酸铵 =43∶57等度洗脱,不但可以获得较短的保留时间,同时又可以与杂质峰分离。QO-58经紫外扫描,在285 nm处有最大吸收峰,且在此波长处内标尼群地平也有很强吸收,所以选择285 nm作为色谱检测紫外测定波长来测定QO-58含量。该方法具有灵敏、简便、准确、特异性强、重复性好等特点,可作为QO-58血药浓度检测的常规手段。
药代动力学参数对实验动物给药具有重要的指导意义,QO-58的消除半衰期较长,特别是口服达到了8.24 h,Tmax大于4 h,提示该化合物吸收及代谢均较慢,因此可以适当减少给药次数。口服给药剂量由 50 mg·kg-1提高到 100 mg·kg-1体重后Cmax未见明显增大,且AUC0-t仅仅增大约37%左右,提示在50 mg·kg-1以后单纯靠提高给药剂量可能药效学效果不佳。口服低、中、高3个剂量QO-58的生物利用度均相对较低,推测可能与QO-58在水中溶解度极低有关。总之,药代动力学结果表明,该化合物起效较慢,药效持续时间较长,在进一步的临床研究过程中我们需要通过化合物成盐或者通过制剂等手段来改善其药代动力学参数。
参考文献:
[1] Qi J,Zhang F,Mi Y,Fu Y,et al.Synthesis and biological activity of pyrazolo[1,5-a]pyrimidin-7(4H)-ones as novel Kv7/KCNQ potassium channel activators[J].Eur J Med Chem,2011,46(3):934-43.
[2] Jia C,Qi JL,Zhang F,et al.Activation of KCNQ2/3 potassium channels by novel Pyrazolo[1,5-a]pyrimidin-7(4H)-OneDerivatives[J].Pharmacology,2011,87(5-6):297-310.
[3] Zhang F,Mi Y,Qi JL,et al.Modulation of Kv7 potassiumchannels by a novel opener pyrazolo[1,5-a]pyrimidin-7(4H)-one compound QO-58[J].British J Pharmacol,2013,168:1030-42.
[4] 张海林,祁金龙,张嫡群,等.吡唑并[1,5-a]嘧啶酮衍生物及其药物组合物以及其用途[P].ZL:200910074653.3,2013-01-16.
[4] Zhang H L,Qi JL,Zhang D Q,et al.Pyrazolo[1,5-a]Pyrimidones Derivatives and Pharmaceutical Compositions and Uses Thereof[P].ZL:200910074653.3,2013-01-16.
[5] Zhang H L,Qi JL,Zhang DQ,et al.Pyrazolo[1,5-a]Pyrimidones Derivatives and Pharmaceutical Compositions and Uses Thereof US[P].PubNo:2012/0088775 A1
[6] 刘灿仿,祁金龙,张海林,贾庆忠.新型钾通道开放剂(QO-58)在大鼠体内组织分布研究[J].中国药理学通报,2012,28(1):66-9.
[6] Liu C F,Qi JL,Zhang H L,Jia Q Z.Study of tissue distribution on a new potassium channel opener(QO-58)in rats[J].Chin Pharmacol Bull,2012,28(1):66-9.
[7] Singh A K,Chaurasiya A,Jain GK,et al.High performance liquid chromatography method for the pharmacokinetic study of bicalutamide SMEDDSand suspension formulations after oral administration to rats[J].Talanta,2009,78(4-5):1310-4.
[8] 杨秀伟,桂方晋,田建明.人参皂苷-Rg2在大鼠体内的药代动力学[J].中国药理学通报,2009,25(7):967-70.
[8] Yang X W,Gui F J,Tian JM,et al.Pharmacokinetics of ginsenoside Rg2 in rats[J].Chin Pharmacol Bull,2009,25(7):967-70.

