缓激肽对转化生长因子-β1诱导的肺动脉平滑肌细胞迁移的影响*
冯文静,赵刚,徐西振,赵俊杰,董若兰,凃玲,姚济华
(1.华中科技大学同济医学院附属同济医院老年医学科,武汉 430030;2.山东大学附属省立医院心血管内科,济南 250021;3.华中科技大学同济医学院附属同济医院心血管内科,武汉 430030)
缓激肽对转化生长因子-β1诱导的肺动脉平滑肌细胞迁移的影响*
冯文静1,赵刚2,徐西振3,赵俊杰1,董若兰1,凃玲1,姚济华1
(1.华中科技大学同济医学院附属同济医院老年医学科,武汉 430030;2.山东大学附属省立医院心血管内科,济南 250021;3.华中科技大学同济医学院附属同济医院心血管内科,武汉 430030)
目的 观察缓激肽对转化生长因子-β1(TGF-β1)诱导的肺动脉平滑肌细胞(PASMCs)迁移的影响及其可能机制。方法原代培养PASMCs,应用Transwell小室检测缓激肽对PASMCs跨膜迁移能力的影响,同时应用划痕修复实验检测缓激肽对PASMCs横向迁移能力的影响。结果TGF-β1显著增加了跨膜迁移的PASMCs数目(P<0.05),缓激肽显著减少了PASMCs的跨膜迁移(P<0.05),而B2受体抑制剂(HOE-140)对缓激肽抑制TGF-β1诱导的PASMCs的跨膜迁移作用无显著改变(P>0.05)。缓激肽显著降低PASMCs的划痕愈合指数(P<0.05),而HOE-140对缓激肽抑制TGF-β1诱导的PASMCs的横向迁移能力无显著改变(P>0.05)。结论缓激肽可以抑制TGF-β1诱导的PASMCs跨膜和横向迁移能力,而这一效应可能不通过缓激肽B2受体介导。
缓激肽;肺动脉平滑肌细胞;转化生长因子-β1;迁移
肺动脉高压是一类严重的进展性疾病,其主要特征是肺血管阻力进行性升高,持续发展可导致患者右心衰竭而死亡[1]。肺血管重构是肺血管阻力进行性升高的重要病理生理基础,肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells,PASMCs)由中层至内膜层的迁移,导致了肺动脉中膜增厚和非肌性血管肌化,最终导致血管硬化和阻塞,从而使肺动脉压力持续升高[2]。研究表明,多种肺动脉高压动物模型均存在PASMCs中转化生长因子-β1(transforming growth factor-β1,TGF-β1)表达增加并刺激PASMCs迁移,促进肺血管重构的发生和发展[3]。
缓激肽(bradykinin,BK)是一种血管活性九肽,通过自分泌-旁分泌机制释放,与受体结合后发挥扩张血管、降低血压、增加局部血流、调节平滑肌松弛和收缩、增加血管通透性等多种生物学效应[4]。研究表明,激肽释放酶可以通过增加缓激肽水平从而抑制血小板源性生长因子诱导的大鼠主动脉平滑肌细胞迁移[5],然而,BK是否能抑制TGF-β1诱导的PASMCs迁移及其可能的分子机制尚不清楚。因此,笔者研究肺血管重构的病理生理机制,旨在探讨BK对TGF-β1诱导的PASMCs迁移的影响,为临床肺血管重构的治疗提供新的理论依据。
1 材料与方法
1.1 试剂 猪肺动脉购自武汉市血清制品厂,胎牛血清(fetal bovine serum,FBS)、达尔伯克必需基本培养液(Dulbecco′s minimum essentialmedium,DMEM)、胰酶均购自Hyclone公司。10%DMEM为含有10%胎牛血清、0.146 g·L-1L-谷氨酰胺、1×105U·L-1青霉素和1×105U·L-1链霉素的DMEM培养液。BK、TGF-β1、缓激肽B2受体抑制剂HOE-140购自美国Sigma公司。牛血清清蛋白购自碧云天生物技术研究所。Transwell小室购自美国Corning公司,其余试剂均为国产分析纯试剂。
1.2 方法
1.2.1 原代培养PASMCs 无菌操作下取猪肺动脉,分离肺组织中的3~4级肺小动脉,钝性分离法剥除肺动脉外膜后,立即用大量含有双抗的磷酸盐缓冲液(phosphate buffered solution,PBS)冲洗。纵向剪开肺动脉,刮除肺动脉内皮细胞,并用PBS清洗掉残留的肺动脉内皮细胞。将肺动脉中膜组织在含有少量10%FBS的DMEM培养液中剪成1 mm3大小的组织块后转移到细胞培养瓶中,翻转培养瓶,置于37℃、5%二氧化碳培养箱中倒置培养4~6 h。组织块贴壁后补充适量含10%FBS的DMEM培养液并轻轻翻转培养瓶,正置培养5~7 d,可见少量细胞从组织块边缘爬出。每2~3 d更换培养液,换液时去除漂浮的组织块。用0.02%乙二胺四乙酸-0.25%胰蛋白酶消化传代,实验采用第2~6代细胞。
1.2.2 PASMCs鉴定 分别采用倒置相差显微镜下观察和免疫荧光染色检测抗α-平滑肌肌动蛋白(αsmoothmuscle actin,α-SMA)的方法[6]对所培养的细胞进行鉴定,从而明确是否为PASMCs。细胞纯度在95%以上用于实验。
1.2.3 实验分组 培养板中的细胞随机分为6组:对照组、溶媒组、TGF-β1组、TGF-β1+HOE-140组、TGF-β1+BK组及TGF-β1+BK+HOE-140组,干预前换0.4%FBS的DMEM培养液同步化处理12 h。为研究可能机制,给予BK前1 h加用缓激肽B2受体抑制剂HOE-140(10-5mol·L-1)、BK干预作用30min后,加入TGF-β1(10 ng·mL-1)。每次实验至少重复3次。
1.2.4 Transwell小室检测PASMCs的跨膜迁移能力细胞跨膜迁移能力按文献所述的方法进行[7]。常规胰酶消化收集PASMCs,1 000 r·min-1离心(德国贺利氏Fresco台式高速离心机)10 min,用无血清DMEM培养液重悬PASMCs,使细胞密度达到5×105·mL-1,每个Transwell小室均匀滴加细胞悬液200μL(1×105个),下室加入无血清DMEM培养液600μL。按照上述实验分组和干预时间点将BK、HOE-140加入Transwell上室,TGF-β1作为诱导迁移的细胞趋化因子加入Transwell下室诱导PASMCs迁移。将24孔板置于37℃、5%CO2培养箱中孵育6 h。干预结束后用棉签轻轻擦去上室内的细胞,并用4%多聚甲醛固定30 min,0.1%结晶紫室温下染色10 min,纯化水漂洗干净,显微镜下随机选取5个高倍视野(×200)计数每个Transwell小室迁移的细胞数目并摄相。
1.2.5 划痕修复实验检测PASMCs的横向迁移能力 细胞划痕修复实验按文献所述的方法进行[8]。将PASMCs接种于6孔板,加入含10%FBS的DMEM培养液继续培养,待细胞长至完全融合时,用无菌的200μL枪头在6孔板的底面上沿直线轻轻进行划痕,用PBS洗3次将悬浮的细胞洗掉,加入无血清DMEM培养液继续培养并按分组加入相应的药物干预,分别在0,24 h于倒置显微镜下(×100)观察细胞迁移情况,随机选择划痕区5个视野摄相,测量不同时间点的划痕宽度,比较各组间划痕愈合的差异并计算划痕愈合指数。划痕愈合指数=(初始划痕宽度-愈合后划痕宽度)/初始划痕宽度。
2 结果
2.1 PASMCs形态及鉴定 肺动脉中膜组织块移植于培养瓶后,培养5~7 d可见少量细胞从组织块边缘爬出,细胞呈不规则多角形,并逐渐伸展成梭形或长梭形。部分区域可见PASMCs融合呈梭形重叠生长,呈现典型的“谷与峰”样特征。免疫荧光染色结果见图1所示,95%以上细胞抗α-SMA阳性,细胞质显示呈绿色荧光标记的肌动蛋白结构,细胞核呈椭圆形位于细胞中央被染成蓝色。
2.2 BK对TGF-β1诱导的PASMCs跨膜迁移能力的影响 按上述实验分组和干预方法,应用Tanswell检测BK对TGF-β1诱导的PASMCs跨膜迁移能力的影响。如图2,3所示,与对照组和溶媒组比较,TGF-β1组PASMCs跨膜迁移的细胞数目显著增加(P<0.05)。与TGF-β1组比较,TGF-β1+BK组显著减少了TGF-β1诱导的PASMCs跨膜迁移的细胞数目(P<0.05)。而合用缓激肽B2受体抑制剂HOE-140后,BK抑制TGF-β1诱导的PASMCs的迁移作用无显著改变。说明BK可以抑制TGF-β1诱导的PASMCs的跨膜迁移能力,而这一效应可能不通过缓激肽B2受体介导。

图1 PASMCs免疫荧光染色(×200)A.细胞核;B.细胞质α-SMA染色阳性;C.PASMCs组合图Fig.1 Immunofluorescent staining on PASMCs(×200)A.nucleus;B.positiveα-SMA expression in cytoplasm by staining;C.merged PASMCs
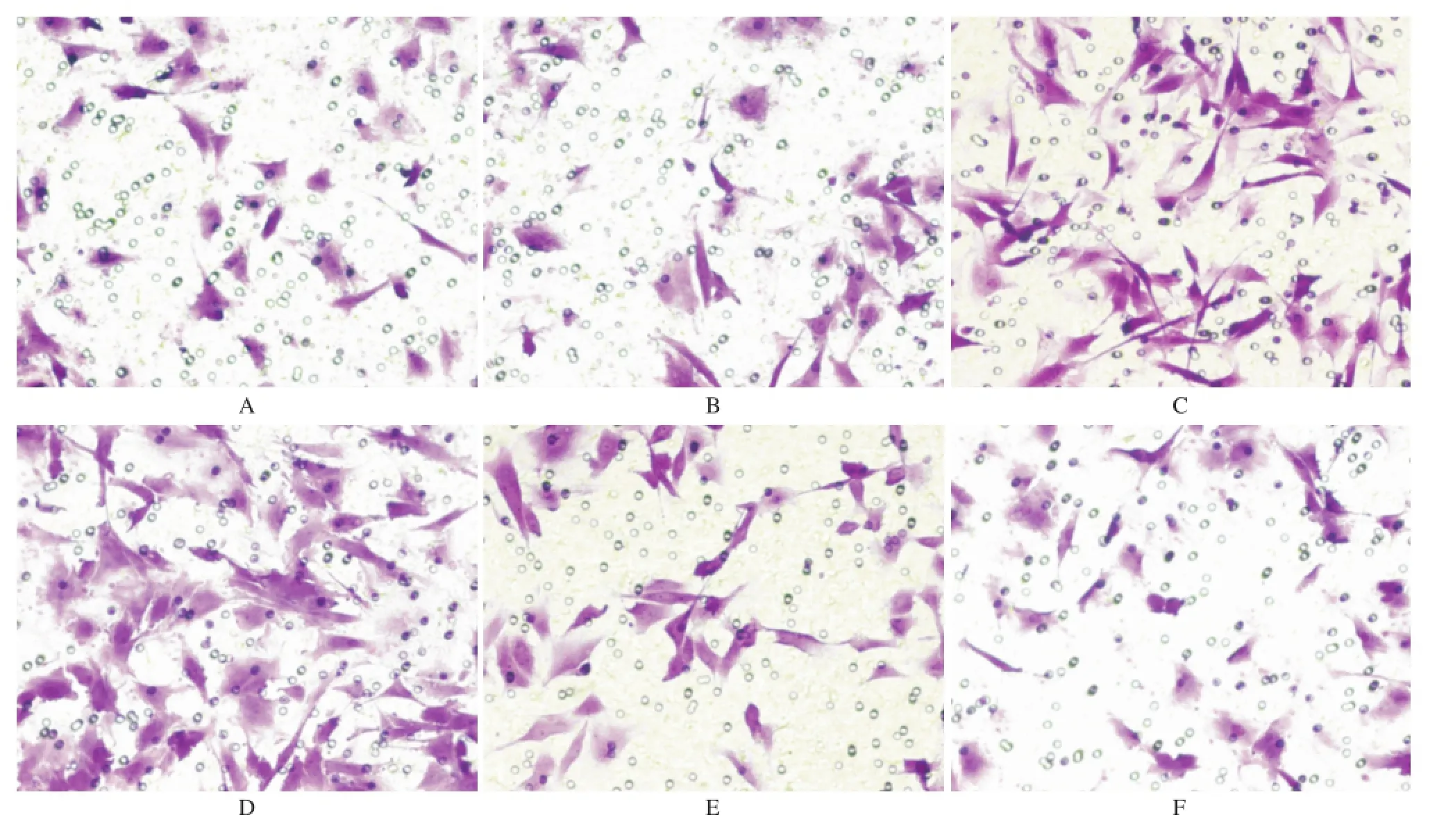
图2 6组细胞迁移图(×200)A.对照组;B.溶媒组;C.TGF-β1组;D.TGF-β1+HOE-140组;E.TGF-β1+BK组;F.TGF-β1+BK+HOE-140组Fig.2 Transition diagram of six groups of cells(×200)A.control group;B.vehicle group;C.TGF-β1group;D.TGF-β1plus HOE-140 group;E.TGF-β1plus BK group;F.TGF-β1,BK plus HOE-140 group
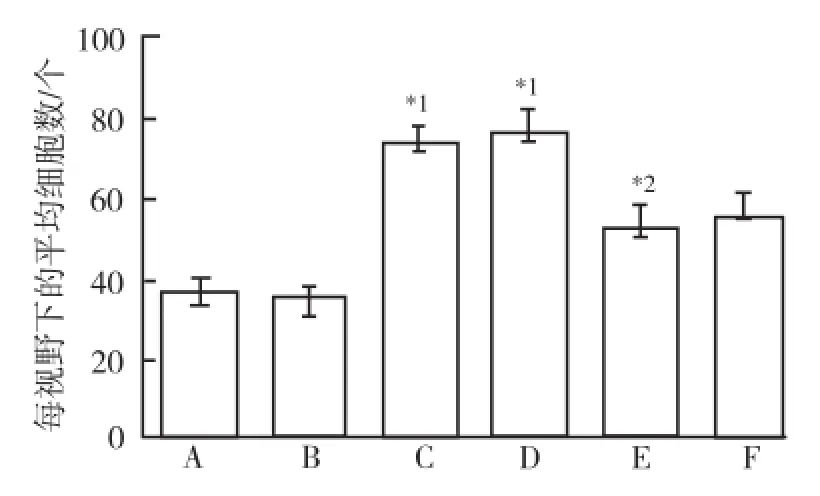
图3 6组细胞每视野下的平均细胞数目直方图A.对照组;B.溶媒组;C.TGF-β1组;D.TGF-β1+HOE-140组;E.TGF-β1+BK组;F.TGF-β1+BK+HOE-140组;与对照组和溶媒组比较,*1P<0.05;与TGF-β1组比较,*2P<0.05Fig.3 Histogram of average cell number under per visual field in six groups of cellsA.control group;B.vehicle group;C.TGF-β1group;D.TGF-β1plus HOE-140 group;E.TGF-β1plus BK group;F.TGF-β1,BK plus HOE-140 group;compared with the control group and vehicle group,*1P<0.05;compared with TGF-β1group,*2P<0.05
2.3 BK对TGF-β1诱导的PASMCs横向迁移能力的影响 按上述实验分组和干预方法,应用划痕修复实验检测BK对TGF-β1诱导的PASMCs横向迁移能力的影响。如图4,5所示,单层细胞划痕实验24 h后,与对照组和溶媒相比较,TGF-β1组PASMCs划痕愈合指数显著增加(P<0.05)。与TGF-β1组比较,TGF-β1+ BK组PASMCs划痕愈合指数显著降低(P<0.05)。而合用缓激肽B2受体抑制剂HOE-140后,BK抑制TGF-β1诱导的PASMCs的横向迁移作用无显著改变。说明BK可以抑制TGF-β1诱导的PASMCs的横向迁移能力,而这一效应可能不通过缓激肽B2受体介导。
3 讨论
肺血管重构主要包括肺动脉内膜损害、中膜肥厚和外膜增厚,肺血管内皮细胞凋亡参与肺动脉高压发病的重要起始环节[9]。SAKAO等[10]研究发现,凋亡的肺血管内皮细胞可以分泌一系列细胞因子(血管内皮生长因子、TGF-β1等)作用于PASMCs,促进肺血管重构。STURROCK等[11]研究发现,肺动脉高压发病过程中TGF-β1表达显著增加。多种肺动脉高压动物模型均存在PASMCs中TGF-β1表达增加并刺激PASMCs迁移,促进肺血管重构的发生和发展[3]。PASMCs由中层至内膜层的迁移,导致肺动脉中膜增厚和非肌性血管肌化,最终导致血管硬化和阻塞[2]。本实验应用TGF-β1诱导原代培养的猪PASMCs迁移,结果显示: TGF-β1可以显著诱导PASMCs迁移,这与文献[3]报道一致,说明TGF-β1诱导PASMCs迁移模型制作成功,可以用于研究BK对TGF-β1诱导的PASMCs的迁移作用。
本实验中,Tanswell结果显示,TGF-β1显著增加了跨膜迁移的PASMCs数目,BK显著减少了TGF-β1诱导的PASMCs的跨膜迁移,而HOE-140对BK抑制TGF-β1诱导的PASMCs的跨膜迁移作用无显著改变。划痕修复实验也显示,BK显著降低了TGF-β1诱导的PASMCs的划痕愈合指数,而HOE-140对BK抑制TGF-β1诱导的PASMCs的横向迁移能力无显著改变。说明BK可以抑制TGF-β1诱导的PASMCs跨膜和横向迁移能力,而这一效应可能不通过缓激肽B2受体介导。

图4 6组细胞划痕修复图(×100)A.对照组;B.溶媒组;C.TGF-β1组;D.TGF-β1+HOE-140组;E.TGF-β1+BK组;F.TGF-β1+BK+HOE-140组Fig.4 Scratch-restoration of six groups of cells(×100)A.control group;B.vehicle group;C.TGF-β1group;D.TGF-β1plus HOE-140 group;E.TGF-β1plus BK group;F.TGF-β1,BK plus HOE-140 group

图5 6组细胞愈合指数直方图A.对照组;B.溶媒组;C.TGF-β1组;D.TGF-β1+HOE-140组;E.TGF-β1+BK组;F.TGF-β1+BK+HOE-140组;与对照组和溶媒组比较,*1P<0.05;与TGF-β1组比较,*2P<0.05Fig.5 Healing index histogram of six groups of cellsA.control group;B.vehicle group;C.TGF-β1group;D.TGF-β1plus HOE-140 group;E.TGF-β1plus BK group;F.TGF-β1,BK plus HOE-140 group;compared with the control group and vehicle group,*1P<0.05;compared with TGF-β1group,*2P<0.05
BK是激肽释放酶-激肽系统(kallikrein-kinin system,KKS)中的重要活性物质,主要通过自分泌-旁分泌机制释放,与受体结合后发挥扩张血管、降低血压、增加局部血流、调节平滑肌松弛和收缩、增加血管通透性,改善肾功能等多种生物学效应[4]。B2受体是一种跨膜G-蛋白耦联受体,广泛表达于大多数组织。已有研究报道,重组腺病毒介导的人组织激肽释放酶基因转染可明显抑制血小板源性生长因子诱导的自发性高血压大鼠血管平滑肌细胞迁移[5]。本研究发现, BK抑制TGF-β1诱导的PASMCs的迁移作用,而HOE-140对BK抑制TGF-β1诱导的PASMCs的迁移作用不产生影响,因此推测BK抑制PASMCs的迁移作用不通过缓激肽B2受体介导。
综上所述,BK可抑制TGF-β1诱导的PASMCs的迁移作用,这一效应不通过缓激肽B2R介导。这可能为肺血管重构的发生和发展提供了新的理论依据,为预防和治疗肺血管重构提供了新的思路,但还有待于进一步对其具体机制进行研究。
[1]RABINOVITCH M.Molecular pathogenesis of pulmonary arterial hypertension[J].JClin Invest,2008,118(7): 2372-2379.
[2]KOURI F M,QUEISSER M A,KONIGSHOFF M,et al. Plas-minogen activator inhibitor type 1 inhibits smooth muscle cell proliferation in pulmonary arterial hypertension[J].Int JBiochem Cell Biol,2008,40(9):1872-1882.
[3]LONG L,CROSBY A,YANG X,et al.Altered bone morphogenetic protein and transforming growth factor-beta signaling in ratmodels of pulmonary hypertension:potential for activin receptor-like kinase-5 inhibition in prevention and progression of disease[J].Circulation,2009,119(4): 566-576.
[4]MAURER M,BADER M,BASM,et al.New topics in bradykinin research[J].Allergy,2011,66(11):1397-1406.
[5]余惠珍,谢良地,朱鹏立,等.人组织激肽释放酶基因转移对血管平滑肌细胞迁移的影响[J].南方医科大学学报,2010,30(4):746-749.
[6]TIAN X,VROOM C,GHOFRANIH A,et al.Phosphodiesterase 10A upregulation contributes to pulmonary vascular remodeling[J].PLoSOne,2011,6(4):e18136.
[7]MERLO S,FRASCA G,CANONICO P L,et al.Differential involvementof estrogen receptor alpha and estrogen receptor beta in the healing promoting effect of estrogen in human keratinocytes[J].JEndocrinol,2009,200(2):189-197.
[8]XU C,GUIQ,CHENW,et al.Small interference RNA targeting tissue factor inhibits human lung adenocarcinoma growthin vitroandin vivo[J].J Exp Clin Cancer Res, 2011,30(1):63-65.
[9]TEICHERT-KULISZEWSKA K,KUTRYK M J,KULISZEWSKIM A,et al.Bone morphogenetic protein receptor-2 signaling promotes pulmonary arterial endothelial cell survival:implications for loss-of-function mutations in the pathogenesis of pulmonary hypertension[J].Circ Res, 2006,98(2):209-217.
[10]SAKAO S,TARASEVICIENE-STEWART L,WOOD K,et al.Apoptosis of pulmonary microvascular endothelial cells stimulates vascular smooth muscle cell growth[J].Am J Physiol Lung Cell Mol Physiol,2006,291(3):362-368.
[11]STURROCK A,CAHILL B,NORMAN K,et al.Transforming growth factor-beta1 induces Nox4 NAD(P)H oxidase and reactive oxygen species-dependent proliferation in human pulmonary artery smoothmuscle cells[J].Am J Physiol Lung Cell Mol Physiol,2006,290(4):661-673.
DOI 10.3870/yydb.2014.01.003
Effects of Bradykinin on Migration of Pulmonary Artery Smooth Muscle Cells Induced by TGF-β1
FENGWen-jing1,ZHAO Gang2,XU Xi-zhen3,ZHAO Jun-jie1,DONG Ruo-lan1,TU Ling1,YAO Ji-hua1
(1.Department of Geriatrics,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China;2.Department of Cardiology,Shandong Provincial Hospital,Shandong University,Jinan 250021,China;3.Department of Cardiology,Tongji Hospital,Tongji Medical College, Huazhong University of Science and Technology,Wuhan 430030,China)
Objective To study the effects of bradykinin(BK)on pulmonary artery smooth muscle cells(PASMCs) migration induced by transforming growth factor-β1(TGF-β1)and their possible mechanisms.MethodsThe transmembrane migration of BK on primary PASMCs with TGF-β1treatmentwas exam ined by transwell assay,and the lateralm igration of BK on primary PASMCs with TGF-β1was determined by healing of surface scratch assay.ResultsTGF-β1significantly increased the number of PASMCs migrating across the membrane(P<0.05).BK significantly reduced TGF-β1-induced PASMCs transmembranemigration(P<0.05),which was not prevented by the B2 receptor(B2R)inhibitor HOE-140(P>0.05). Furthermore,BK significantly reduced TGF-β1-induced PASMCs lateralmigration(P<0.05),while the effectwas not blocked by the B2R inhibitor HOE-140(P>0.05).ConclusionBK can significantly inhibit TGF-β1-induced PASMCs transmembrane and lateralmigration.However the inhibitory effects ofmigrationmay notbemediated by bradykinin B2 receptor.
Bradykinin;Pulmonary artery smoothmuscle cell;Transforming growth factor-β1;Migration
R972;R965
A
1004-0781(2014)01-0008-05
2013-04-10
2013-06-27
*国家自然科学基金资助项目(30971247, 81170111)
冯文静(1986-),女,山东日照人,博士,从事肺动脉高压的发病机制及药物对其保护作用研究。电话:027-83662533,E-mail:wenjing.8687@163.com。
姚济华(1965-),男,湖北武汉人,副教授,学士,研究方向:肺动脉高压发病机制与治疗。电话:027-83662606,E-mail:jhyaott@hotmail.com。

