α-MnO2纳米线的合成及对刚果红的吸附热力学、平衡研究
任铜彦,何平
(1.川北医学院化学教研室,四川 南充 637000;2.西华师范大学化学化工学院,化学合成与污染控制四川省重点实验室,四川南充 637009)
近年来,我国的染料工业取得了巨大的发展,然而发展的同时也带来了严重的环境污染问题。很多染料具有毒性,对于水生物种和人类会引起致癌,诱导有机体突变和产生畸变的作用,因此,废水的处理刻不容缓。
吸附法广泛应用于染料废水的处理,颗粒活性炭(GAC)或粉末活性炭(PAC)是吸附染料普遍采用的吸附剂[1]。然而,生产高质量的活性炭仍然存在成本高的问题,而活性炭的再生和废炭的处理也存在困难,除非吸附是通过固定的过程来进行,否则将有大量的炭损失在废污泥里。这些问题都促进了各种各样的吸附剂的使用。以二氧化锰为代表的高价态锰氧化物纳米材料因较强的除污染能力,在染料废水领域中有较多的应用。
本研究以硫酸锰和过硫酸铵在水热条件下制得了二氧化锰纳米材料,并测试了该纳米材料对刚果红的吸附平衡及热力学。结果表明,二氧化锰在环境处理方面有着较好的应用前景。
1 实验部分
1.1 试剂与仪器
硫酸锰(MnSO4)、过二硫酸铵[(NH4)2S2O8]、刚果红均为分析纯。
AE-200型电子天平;DHG-9101-1SA型电热恒温鼓风干燥箱;Ultima IV X射线粉末衍射仪;JSM-6510LV型扫描电镜;SHZ-82型恒温振荡器;UV-2550型紫外分光光度计。
1.2 α-MnO2纳米线的制备
称取3 mmol MnSO4和3 mmol(NH4)2S2O8溶于15 mL蒸馏水中,形成无色透明溶液,在室温下搅拌30 min,将其转移至25 mL的聚四氟乙烯内衬反应釜中密封,150℃下加热8 h。冷却至室温,洗涤、干燥,得到产品。
1.3 吸附性能实验
取10 mg加入到10 mL初始浓度为50,100,200,300,350 mg/L 的刚果红溶液中,分别于 25,35,45℃下恒温振荡,取样离心,测定平衡时刚果红的残留浓度。

式中 m——吸附剂的质量,g;
qe——平衡吸附量,mg/g;
c0——初始浓度,mg/L;
ce——平衡浓度,mg/L;
V ——体积,L。
2 结果与讨论
2.1 XRD和SEM分析
样品的XRD图谱见图1。

图1 产物的XRDFig.1 XRD pattern of the product
由图1可知,该样品有9个特征峰,其对应晶面为(110)、(101)、(200)、(111)、(210)、(211)、(220)、(002)、(310)、(301)峰值与 JCPDS 卡 65-2821中峰的位置一致,且没有杂峰出现,表明样品为纯的α-MnO2。
图2为α-MnO2的SEM电镜图。

图2 产物的SEM照片Fig.2 SEM pattern of the product
由图2可知,该样品是由许多微小的二氧化锰纳米粒子聚合在一起的,且是线状的、直径约为100 nm,长度为4~5 μm,分散性好,并交织成网的纳米材料。
2.2 温度的影响及平衡曲线研究
温度对吸附量的影响见图3。
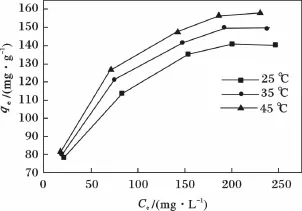
图3 吸附刚果红的温度影响曲线Fig.3 Effect curve of temperature on the adsorption of Congo red
由图3可知,随着温度从25℃升高到45℃,最大吸附量从140 mg/g升高到157 mg/g,即温度升高,增加了刚果红从溶液到α-MnO2表面的能力,平衡吸附量增加,故温度上升,有利于α-MnO2吸附刚果红,说明该吸附反应是吸热反应。
用吸附等温线模型 Langmuir[2]和Freundlich模型[3]分析实验数据。Langmuir吸附等温线线性方程:

式中 qe,qm——平衡吸附量和最大吸附量,mg/g;
ce——平衡时浓度,mg/L;
b——常数,表示α-MnO2对刚果红的结合力的大小,b越大,结合力越强,L/mg。
Langmuir吸附等温线用一个无量纲的分离常数RL表示本质特征[4],即:

式中,c0是刚果红的初始浓度,RL在0~1表示吸附容易发生。
Freundlich吸附等温线线性方程:

式中,kF是大约指示吸附容量,1/n是表示吸附的强度[5]。
α-MnO2吸附刚果红的 Langmuir(见图4a)和Freundlich(见图4b)的相关数据总结见表1。由表1可知,对于Langmuir随着温度升高,qm增大,b增大,在 25,35,45 ℃ 最大吸附量依次为 155.04,164.74,173.61 mg/g,说明高温易吸附,同时 RL在0~1,表明吸附容易进行;Freundlich模型并不能得到最大吸附量,可是 kF值在25,35,45℃时分别为37.24,38.21,39.19,也说明易发生吸附,且温度升高,吸附能力呈增大趋势。同时,n在1~10,一样说明α-MnO2对刚果红的吸附能力较强;由R2可知,该吸附反应用Langmuir模型更适合拟合刚果红在α-MnO2上的吸附。
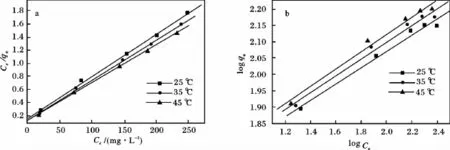
图4 在不同温度下吸附刚果红的平衡曲线(a)Langmuir和(b)FreundlichFig.4 Langmuir(a)and Freundlich(b)isotherm plots for the adsorption Congo red at different temperatures

表1 二氧化锰吸附刚果红的平衡曲线相关参数Table 1 Adsorption isotherms constants for the adsorption of CR on α-MnO2
2.3 热力学研究
吸附热力学的相关参数,吉布斯自由能变化(ΔG°)、焓变(ΔH°)和熵变(ΔS°)用以下公式进行计算[6]:

式中 R——理想气体常数[8.314 5 J/(mol·K)];
T ——温度,K;
b ——Langmuir常数,L/mg;
ΔG°——吉布斯自由能,kJ/mol;
ΔH°——焓变,kJ/mol;
ΔS°——熵变,J/(mol·K)。
热力学参数的计算结果见表2。
由表2可知,ΔH°>0(吸热),是由于随着温度的升高吸附量在增加;ΔG°<0表示吸附是自发进行的;ΔS°>0则表明在吸附的过程中混乱度在增加。因此,α-MnO2吸附刚果红是自发的、吸热过程。

表2 不同温度下的热力学参数Table 2 Thermodynamic parameters at different temperatures
3 结论
通过水热法一步合成了α-MnO2纳米线,并用于对刚果红的吸附,吸附平衡更适合Langmuir模型,吸附量随着温度的升高而增大,最大吸附量达到了173.61 mg/g;热力学表明,吸附刚果红是自发的、吸热过程。
[1]Chern J M,Wu C Y.Desorption of dye from activated carbon beds:Effects of temperature,pH,and alcohol[J].Water Res,2001,35:4159-4165.
[2]Cheng W,Wang S G,Lu L,et al.Removal of malachite green(MG)from aqueous solutions by native and heattreated anaerobic granular sludge[J].Biochem Eng J,2008,39:538-546.
[3]Erdal E.Removal of lead ions by Unye(Turkey)bentonite in iron and magnesium oxide-coated forms[J].J Hazard Mater,2009,165(1/2/3):63-70.
[4]Weber T W,Chakkravorti R K.Pore and solid diffusion models for fixed-bed adsorbers[J].AIChE J,1974,20:228-238.
[5]Tamia W,Ahmad A L,Hameed B H.Adsorption isotherms,kinetics,thermodynamics and desorption studies of 2,4,6-trichlorophenol on oil palm empty fruit bunch-based activated carbon[J].J Hazard Mater,2009,164(2/3):473-482.
[6]Gupta V K,Rastogi A.Biosorption of lead from aqueous solutions by green algae Spirogyra species:Kinetics and equilibrium studies[J].J Hazard Mater,2008,152:407-414.

