应用于氧化还原电池的Fe3+/Fe2+电解液研究
张清,周德璧,秦牡兰
(1.中南大学化学化工学院,湖南长沙 410083;2.中南大学材料科学与工程学院,湖南长沙 410083)
液流电池最早由美国航空航天局资助设计,30多年来,多国学者通过变换2个氧化-还原电对,提出了多种不同的液流电池体系。通常将其分为液相和沉积型两类。液相体系有Ti/Fe、Cr/Fe、V/Ce、全钒、全铬、全铀及第二代全钒(V/Br2),全钒(硫酸钒)体系。沉积型体系分为半沉积型和全沉积型。半沉积型典型的有锌溴电池、锌铈电池等,全沉积型典型的有新型铅酸液流储能电池和单液流锌/镍储能电池等[1-4]。
目前,世界各国学者研究较多的是全钒液流电池,其标准电压为1.250 V,反应物的交叉污染较小,但由于钒的价格昂贵,限制了其大规模的应用[5]。Fe3+/Fe2+电对的交换电流密度高,价格低廉,在酸性溶液中稳定,溶解度高。铁铬液流电池中,铁电解液为盐酸体系,盐酸的腐蚀性高,易挥发,Cl2/Cl-的标准电势约为1.360 V,过充时,容易析出Cl2。铁的硫酸体系中,硫酸不易挥发,且S/S2的标准电势约为2.010 V,不易使电解液分解。与锌组成锌铁电池,其标准电压为1.533 V,正负极液浓度高,负极动力学性能好,溶液稳定,且无污染,性价比高,是将来液流电池新的研究方向。
本文使用循环伏安、交流阻抗、充放电等方法,研究了硫酸亚铁在不同硫酸浓度下的动力学性能,并就最佳硫酸浓度下测试了硫酸亚铁的标准电势和扩散系数,测试了其在0.37 V时,不同酸度的电化学阻抗,组装并测试了锌铁电池的充放电性能。
1 实验部分
1.1 试剂与仪器
硫酸亚铁、硫酸均为分析纯。
CHI660A电化学工作站;CT-3008W-5V3A-S1充放电仪。
1.2 电解液的配制
称取FeSO4和H2SO4,加入20 mL去离子水溶解,冷却,定容至50 mL,分别得到溶液为1.00 mol/L FeSO4+0.25 mol/L H2SO4、1.00 mol/L FeSO4+0.50 mol/L H2SO4、1.00 mol/L FeSO4+0.75 mol/L H2SO4、1.00 mol/L FeSO4+1.00 mol/L H2SO4的电解液。
1.3 电化学测试
采用三电极体系,饱和甘汞电极(SCE)为参比电极,4 cm2铂电极为对电极,工作电极为纯石墨电极,电解液采用 1.00 mol/L FeSO4+0.25 mol/L H2SO4、1.00 mol/L FeSO4+0.50 mol/L H2SO4、1.00 mol/L FeSO4+0.75 mol/L H2SO4、1.00 mol/L FeSO4+1.00 mol/L H2SO4。循环伏安扫描范围0.1~0.9 V,扫描速度为 100,80,50,30,10,5 mV/s,从0.1 V向正扫描到0.9 V,再由正向负扫描。交流阻抗测试时,按上述方法组装三电极体系,测试1.00 mol/L FeSO4+0.50 mol/L H2SO4电解液,研究电位为0.37 V,扫描频率范围为10-1~105Hz,从高频向低频区扫,交流信号幅度为5 mV。锌铁电池的充放电测试在充放电仪上进行,将所用的电解槽、隔膜(质子交换膜)、电解液(正极液的体积为13.5 mL)、碳素电极组装成静态单电池,充放电电流密度均为20.00 mA/cm2,循环充放 30 min,放电终止电压为0.1 V,循环110次,整个测试在室温下进行。
2 结果与讨论
2.1 循环伏安分析
不同扫描速率下的循环伏安曲线见图1。
由图1可知,阴阳极峰2个峰形状较对称,阳极峰电流出现在0.500~0.600 V,阴极峰电流出现在0.350~0.400 V。随着扫描速率的增加,氧化还原峰电流都增大,其峰电压见表1。

图1 不同扫描速率下的循环伏安曲线Fig.1 The cyclic voltammograms under different potential sweep rate
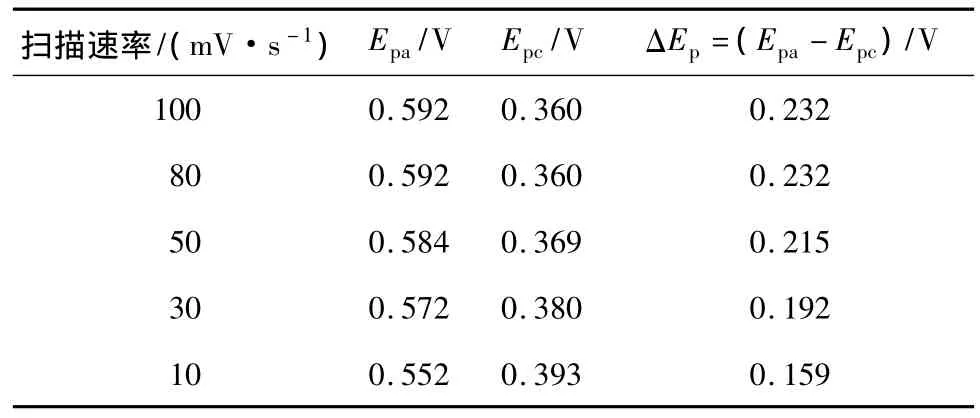
表1 不同扫描速率下的峰电位Table 1 The peak current of different sweep rate
反应的标准电极电位可以由阴阳极峰电位计算得到[6]:

由此可知,Fe(Ⅲ)/Fe(Ⅱ)的电位(vs.SCE)为0.43 V。而 ΔEp>0.059 V,随着扫描速率的增大,ΔEp逐渐增大,氧化峰电位正移,还原峰电位向负移,氧化还原峰电位差逐渐增大,由此可以说明Fe2+/Fe3+电对在纯石墨电极上的氧化还原反应是准可逆反应。
图2表明阳极峰电流ipa与扫描速率方根v1/2呈线性关系,ipa/v1/2的值为 6.078。

图2 ipa与v1/2的关系图Fig.2 The relationship diagram of the peak current ipa and the sweep rate v1/2
对于准可逆体系,峰电流和扫速平方根[4]有:

T=303 K 时,ip=2.67 ×105(n)3/2AC*D1/2v1/2,其中,A为Pt电极面积,cm2;C*为铁离子浓度,mol/L;v为扫描速率,V/s;D为氧化反应的扩散系数,cm2/s;n为电子转移数。由此得铁离子在硫酸介质中的扩散系数为 2.276 ×10-6cm2/s。
图3是不同硫酸浓度下Fe2+/Fe3+的循环伏安曲线。
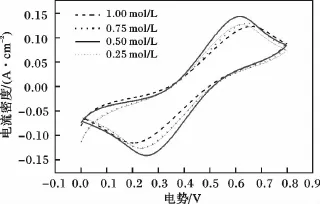
图3 不同硫酸浓度下Fe2+/Fe3+的循环伏安曲线Fig.3 Cyclic voltammograms of Fe2+/Fe3+in H2SO4 with different concentrations
由图3可知,当硫酸的浓度由0.25 mol/L增大到0.50 mol/L时,阳极峰电流从0.10 A增加到0.15 A左右,阴极峰电流则从0.12 A增加到0.15 A左右,峰差减小;当硫酸浓度从0.75 mol/L增加到1.00 mol/L时,阴阳极电流峰都减小,峰差增大。峰电压差在硫酸浓度为0.50 mol/L时最小。可能是随着H+离子浓度的增加,有利于加速溶液的传质,使峰电流增大,峰电位差减小;但同时,溶液的粘度也随着增加,溶液传质阻力对电极的影响增大,使峰电流减小,峰电位差增大。当硫酸浓度小于0.50 mol/L时,前者发生主要作用;当大于0.50 mol/L时,后者占主要作用。当硫酸浓度为0.50 mol/L时,电解液的峰电流最大,峰差最小。
2.2 交流阻抗分析
图4 是 1.00 mol/L FeSO4+0.50 mol/L H2SO4电解液的交流阻抗图谱。
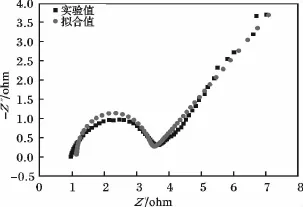
图4 1.00 mol/L FeSO4+0.50 mol/L H2SO4电解液的交流阻抗图谱Fig.4 AC Impedance spectra of 1.00 mol/L FeSO4+0.50 mol/L H2SO4electrolyte
由图 4可知,在石墨电极上,当电解液为1.00 mol/L FeSO4+0.50 mol/L H2SO4,电 位 为0.37 V时,在高中频区出现一个半圆弧,半圆直径约为2.238 Ω,对应于Fe(Ⅲ)的还原反应的电荷传递电阻Rct,低频区呈一条直线。根据电化学交流阻抗理论,交流阻抗图谱在低频区的斜率为45°直线是典型的 Warbrug阻抗特征[7-9]。
运用电化学程序对实验数据用等效电路进行拟合处理,拟合的等效电路见图5。

图5 Fe(Ⅲ)/Fe(Ⅱ)还原反应的等效电路图Fig.5 Equlvalent ciruit of Fe(Ⅲ)/Fe(Ⅱ)
R1为工作电极和参比电极之间的欧姆阻抗,包括了电极和电解液的接触电阻、电解液电阻等;Q是常相位元件,与电极界面的双电层电容有关,受电流密度不均匀分布引起的弥散作用影响;Rct是氧化还原反应的电化学极化阻抗,即电荷传递电阻,反映了电极过程中电荷穿过电极和电解质两相界面的转移过程的阻力[10];W代表Warbrug阻抗,对应于反应物中的半无限扩散过程。
表2为拟合处理得到的交流阻抗参数。

表2 交流阻抗参数Table 2 The parameters of AC impedance
Y为导纳,它的大小和电导、电纳和扩散有关,n的值可反映对应的等效元件。n=0,Q相当于纯电阻;n=0.5,相当于 Warburg阻抗;n=1,相当于理想电容。因此,Q主要表现为电容。
R1表现为参比电极和工作电极间欧姆阻抗,对Fe(Ⅲ)/Fe(Ⅱ)的反应影响很小。Rct表示电荷传递电阻,是决定还原反应速率的重要因素,Rct越小,反应越快。
图6是不同硫酸浓度下Fe2+/Fe3+的交流阻抗图谱。

图6 不同硫酸浓度下Fe2+/Fe3+的交流阻抗图谱Fig.6 AC Impedance of Fe2+/Fe3+in H2SO4with different concentrations
由图6可知,当硫酸为0.50 mol/L时,电化学阻抗相对较小,与循环伏安测试所得数据一致。因此,当硫酸为0.50 mol/L时,电解液的电化学阻抗最小。
2.3 充放电测试
以1.00 mol/L的硫酸亚铁和0.50 mol/L硫酸为正极液,负极液为锌溶液,碳素电极为正负极材料,国产质子交换膜为隔膜,组成小电池,在20.00 mA/cm2进行循环充放电,得图7和图8。
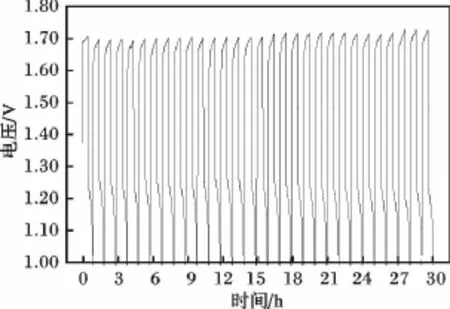
图7 303 K时,锌铁电池充放电曲线Fig.7 Typical charge-discharge curves of the Zn/Fe cell at 303 K

图8 效率与循环次数的关系图Fig.8 The relationship diagram of efficiency and cycle number
由图7、图 8 可知,充电电压在 1.65 ~1.72 V,放电电压在1.11~1.25 V,能持续稳定循环充放电110个循环。随着循环次数的增加,电流效率逐渐减小,而电压效率略有升高。由于负极沉积的锌在酸性条件下会自动溶解,造成自放电,使得电流效率降低,同时,正极液中逐渐积累三价铁离子,使得电压有所升高。
3 结论
用循环伏安、交流阻抗、充放电等方法研究了Fe(Ⅲ)/Fe(Ⅱ)的动力学性能。循环伏安显示,Fe(Ⅲ)/Fe(Ⅱ)氧化还原反应是准可逆反应,当硫酸亚铁的浓度为1.00 mol/L时,硫酸的浓度为0.50 mol/L,其峰电流最大。交流阻抗表明,其电化学阻抗小,动力学性能很好。与锌组成电对,其充放电表明,其标准电压高于全钒液流电池,能持续稳定充放电高达110个循环,且无污染,性价比高,是很好的氧化还原电对。
[1]Skyllas-Kazacos M,Chakrabarti M H,Hajimolana S A,et al.Progress in flow battery research and development[J].Journal of the Electrochemical Society,2011,158:55-59.
[2]Tokuda N,Kanno T,Hara T,et al.Development of a redox flow battery system[J].SEI Technical Review,2000,50:88-94.
[3]Skyllas-Kazacos M,Rychcik M,Robins P G,et al.New all-vanadium redox flow cell[J].Journal of the Electrochemical Society,1986,133:1057-1058.
[4]Rychcik M,Skyllas-Kazacos M.Evaluation of electrode materials for vanadium redox cell[J].Journal of Power Sources,1987,19:45-54.
[5]Skyllas-Kazacos M,Grossmith F.Efficient vanadium redox flow cell[J].Journal of the Electrochemical Society,1987,134:2950-2953.
[6]Walsh F C.Electrochemical technology for environmental treatment and clean energy conversion[J].Pure and Applied Chemistry,2001,73:1819-1837.
[7]曹楚南,张鉴清.电化学阻抗谱导论[M].北京:科学出版社,2002:26.
[8]Xie Z P,Xiong F J,Zhou D B.Nitroso-R-salt in aqueous solutions for redox flow battery application[J].Advanced Materials Research,2011(239/240/241/242):2813-2816.
[9]Cheng J,Zhang L,Yang Y S,et al.Preliminary study of single flow zinc-nickel battery[J].Electrochemistry Communications,2007,9:2639-2642.
[10]Xu Y,Wen Y H,Cheng J,et al.Study on a single flow acid Cd-chloranil battery[J].Electrochemistry Communications,2009,11:1422-1424.

