微波辅助离子液体中铜掺杂TiO2光催化剂的制备及微波强化光催化活性
王雷清,施忠芬,毕先钧
(1.云南师范大学化学化工学院,云南昆明 650500;2.云南农业职业技术学院畜牧兽医系,云南昆明 650031)
水污染日益成为困扰我国环境工作者的主要问题,国家相关部门也在污水治理方面竭尽全力,但目前全国的污水处理率仅为20%[1]。半导体催化剂TiO2可以吸收紫外光发生本征激发,形成电子-空穴对,电子和空穴分别向催化剂表面转移,与有机物发生氧化还原反应,使其最终降解为无机小分子,达到污水处理的目的[2]。但是,TiO2的禁带较宽(Eg=3.2 eV),对可见光的响应差,因此,部分研究者希望通过金属掺杂、非金属掺杂、金属或非金属元素共掺杂、复合材料负载等方法实现:①拓展TiO2对可见光的响应,使其吸收波长从紫外光区向可见光区移动;②提高TiO2光催化效率,使该项技术能用于处理大气环境污染物、工业废水和生活污水中的有机污染物[3-9]。
近年来,微波在处理环境污染物如染料、酚等有机污染物中的应用越来越广泛。微波本身降解效果不理想,与紫外光等其他物理场协同作用时效果较好[10]。Yang等[11]用微波、紫外光协同效应降解五氯酚废水,以双氧水为催化剂,降解效果较好,双氧水产生的羟基增强了微波、紫外光的协同降解效能。郭雅静等[12]用微波-紫外辐射降解苯酚,机理研究表明,苯酚降解时苯环生成苯氧类及苯醌类,后开环形成小羧酸分子,最终降解为二氧化碳和水,降解率可达到65%左右。此外,微波是一种先进的体相加热手段,被广泛用于材料制备。在微波炉中微波以2 450 MHz的振荡频率穿透物质,微波炉内的极性分子,如水、有机污染物等以每秒24.5亿次的速度快速振荡,并且分子极性越大,振荡的幅度越大,升温速度越快。
离子液体的表面张力小,可以均匀成核,形成的颗粒比表面积大,作为一种新型溶剂在纳米材料的制备中被广泛采用。此外,有文献报道,在离子液体中制备纳米TiO2,由于离子液体的存在,可以抑制TiO2由锐钛矿型向金红石型的转变,同时增大催化剂的比表面积和表面羟基含量[11-14]。
本课题组开展了微波辅助离子液体介质中金属离子掺杂TiO2光催化剂的制备,以及微波强化光催化活性的研究,旨在进一步提高TiO2催化剂的光催化活性[15-16]。根据文献报道,金属离子Cu2+掺杂能够使TiO2催化剂的光催化性能得以提高[17]。本文进一步研究微波辅助离子液体介质中Cu2+掺杂TiO2光催化剂的制备,并考察在紫外光照降解条件下,微波辐射对其降解甲基橙的强化作用,以求进一步改善金属离子掺杂型TiO2催化剂的光催化性能。
1 实验部分
1.1 试剂与仪器
硝酸铜、钛酸丁酯、1-甲基咪唑、溴代正丁烷均为分析纯。
XH-300UL电脑微波超声波紫外光组合催化合成仪;XH-200A电脑微波固液相合成/萃取仪;NOVE2000-e型表面分析仪;XL30ESEM-TMP型扫描电子衍射显微镜;Ten Sor27型红外光谱仪。
1.2 TiO2-Cu催化剂的制备
TiO2-Cu催化剂的制备过程为,在250 mL烧杯中加入17.5 mL乙醇、一定量离子液体、3.4 mL钛酸丁酯,混合搅拌均匀,得混合液。将一定量的硝酸铜溶于二次蒸馏水中,逐滴加入上述混合液中搅拌1 h,得白色溶胶。抽滤、洗涤,得白色凝胶,微波干燥后进行煅烧,即得不同条件下制备的TiO2-Cu催化剂,置于干燥器中备用。
1.3 光催化活性的测定
光催化降解反应在电脑微波超声波组合催化合成仪中进行。每次实验向盛有50 mL 10 mg/L甲基橙溶液的250 mL烧杯中加入50 mg TiO2-Cu催化剂,放入催化合成仪中,恒温(25℃)条件下,分别在微波(500 W)、250 W高压汞灯(波长为365 nm)和微波(500 W)-高压汞灯(250 W)(分别简写为MW、UV和MW-UV)3种条件下作用2 h(反应器距紫外光源15 cm)。反应完成后取5 mL降解液转入洁净离心管中,放入离心机以4 000 r/min两次离心,离心时间为20 min。取上层清液用可见分光光度计于最大吸收波长(464 nm)处测定吸光度A,计算降解率η=(A0-A)/A0×100%(其中A0为甲基橙降解前的吸光度,A为甲基橙降解后的吸光度)。
催化剂的可见光光催化测试:将甲基橙溶液放入烧杯中,加入一定量的光催化剂后,将其置于昆明市呈贡区云南师范大学校园内的合适地方,在中午12:00至下午4:00时间段的太阳光下照射后,参照以上分析步骤计算甲基橙降解率。
空白实验表明,在没有催化剂只有光照的情况下,甲基橙溶液的浓度不变;在有催化剂存在而无光照时,室温下放置相同时间后,甲基橙溶液的浓度也无明显变化。考察催化剂样品重复使用次数时,把静置1 d的降解液除去上层清液后,首先将样品进行烘干,然后在一定温度下进行煅烧处理,以除去催化剂表面吸附的杂质后,再重复前面的降解步骤。
2 结果与讨论
2.1 离子液体用量对TiO2-Cu光催化活性的影响
离子液体用量对催化剂的光催化活性影响见图1。

图1 离子液体加入量对TiO2-Cu光催化活性的影响Fig.1 The influence of volume of the ionic liquids on TiO2-Cu photo-catalytic activity
由图1可知,随着离子液体加入量的增加,甲基橙的降解率先迅速升高后略有下降。当离子液体加入量为5.6 mL时,甲基橙的降解率达到极大值,在MW、UV、MW-UV 3种条件下,甲基橙降解率分别为3.78%,92.98%,98.39%,并且 3 种降解条件下的降解率始终是MW-UV>UV>MW,这说明在用紫外光照降解甲基橙时,微波辐射具有强化TiO2-Cu催化降解甲基橙的作用;当离子液体加入量大于5.6 mL时,由于离子液体用量的增多,使催化剂表面的羟基更易于形成氢键,致使TiO2-Cu光催化活性反而下降。因此,离子液体最佳加入量为5.6 mL。
离子液体用量分别为 2.8,5.6,7.0 mL 条件下制得的TiO2-Cu催化剂IR图,见图2。

图2 不同离子液体用量制备TiO2-Cu红外谱图Fig.2 IR spectrum of TiO2-Cu at different ionic liquid dosageA.2.8 mL;B.5.6 mL;C.7.0 mL
由图 2可知,3条曲线在 3 421.6 cm-1和1 631.7 cm-1均有分别属于羟基的伸缩振动和弯曲振动吸收峰,且峰面积从上到下先增大后减小。由于催化剂中羟基的数目增加,致使TiO2-Cu的光催化活性得以提高;但当离子液体量达到7.0 mL时,曲线C出现了氢键特征吸收峰,这表明催化剂中羟基的数目减少,导致催化剂光催化活性降低。相关文献报道,羟基是活性物种,可以引起物质的氧化反应,是主要氧化剂之一。催化剂中羟基数目的增多,紫外光照时易形成活性羟基,其催化活性就较高;在紫外光照射条件下,若同时再施以微波辐射作用,则微波电磁场的作用会使反应体系温度快速升高(催化降解反应属于分解反应,为吸热反应),从而加快了光催化反应的进行,必然会产生更多的中间体;另一方面,中间体在微波场的作用下,发生高速振动,导致中间体的键断裂,形成小分子,促进了自由基反应的进行,从而使催化剂的光催化活性得以提高。
2.2 微波干燥功率对TiO2-Cu光催化活性的影响
图3为微波干燥功率对TiO2-Cu光催化活性的影响。

图3 微波干燥功率对TiO2-Cu光催化活性的影响Fig.3 The influence of microwave drying power on TiO2-Cu photo-catalytic activity
由图3可知,随着微波干燥功率的增加,甲基橙的降解率先迅速增加后略有下降,当微波干燥功率为210 W时,甲基橙的降解率达到极大值。微波干燥主要是除去凝胶中的水分,水分子是极性分子,微波作用时极性分子的剧烈运动产生相互碰撞,摩擦生热,使液态水迅速升温气化而达到干燥的目的。微波是体加热,使催化剂内部和外部可以均匀受热,此功率下催化剂可以有效干燥,去除自由移动的水分,利于研磨,使所得到的催化剂的粒径比较均匀,团聚较少,催化剂的比表面积增大,进而促进催化剂与甲基橙溶液充分接触,提高了催化剂对甲基橙的降解率。但微波功率过大时,催化剂表面自由移动的水分出去后,结合水及表面的羟基会继续失水,造成催化剂表面的羟基数目减少,活性位点降低,致使催化剂的光催化活性下降[15-16]。因此,最佳微波干燥功率为210 W。
2.3 微波干燥时间对TiO2-Cu光催化活性的影响
图4为微波干燥时间对TiO2-Cu光催化活性的影响。

图4 微波干燥时间对TiO2-Cu光催化活性的影响Fig.4 The influence of microwave drying time on TiO2-Cu photo-catalytic activity
由图4可知,随着干燥时间增加,甲基橙的降解率先增加后下降,当微波干燥时间为20 min时,甲基橙的降解率达到极大值。微波干燥时间较短时,凝胶中的水分不能充分汽化,研磨就不能充分进行,粒子团聚现象就严重,导致所制得的催化剂在紫外光照时形成的电子-空穴对易堆积发生复合;但微波干燥时间过长时,水分完全汽化,凝胶表面的Ti─OH键会发生断裂,致使分子脱水,制得的催化剂表面的Ti─OH键数目减少,紫外光照射时,Ti─OH键断裂形成的活性羟基数目少,微波辐射时活性位点减小,从而导致催化剂的光催化活性降低。因此,最佳微波干燥时间为20 min。
2.4 煅烧温度对TiO2-Cu光催化活性的影响
图5为煅烧温度对TiO2-Cu光催化活性的影响。

图5 煅烧温度对TiO2-Cu光催化活性的影响Fig.5 The influence of calcined temperature on TiO2-Cu photo-catalytic activity
由图5可知,煅烧温度对催化剂活性的影响较大,随着煅烧温度升高,甲基橙的降解率先增大后减小,当煅烧温度为500℃时,甲基橙的降解率达到极大值,在MW、UV、MW/UV 3种条件下,甲基橙降解率分别为 3.78%,92.98%,98.39%,并且 3 种降解条件下的降解率始终是MW/UV>UV>MW,这进一步说明在用紫外光照降解甲基橙时,微波辐射具有强化TiO2-Cu催化降解甲基橙的作用。分析其原因为:当煅烧温度恰当时,催化剂中TiO2主要以锐钛矿型存在(2θ:25.459,37.900,48.141,54.117,55.104,62.918,68.842,70.405,75.195 与标准比色卡84-1286锐钛矿型二氧化钛特征衍射角一致),锐钛矿型TiO2表面有更多的羟基与钛元素相连,经紫外光照射时,锐钛矿型催化剂可以吸收紫外光子的能量发生电子的跃迁,产生电子-空穴对;再加上微波辐射作用时,可以使催化剂表面的羟基迅速受热,生成游离基团,同时微波可以抑制电子-空穴对的复合,催化剂表面温度升高,羟基和空穴成为活性位点,使有机污染物被氧化,生成小分子的化合物[11-12,14-16]。因此,最佳煅烧温度为 500 ℃。
图6为煅烧温度分别为 475,500,550℃时TiO2-Cu催化剂的红外谱图。

图6 不同煅烧温度下TiO2-Cu红外谱图Fig.6 IR spectrum of TiO2-Cu at different calcined temperatureA.475 ℃;B.500 ℃;C.550 ℃
由图6可知,3个温度条件下,羟基的伸缩振动特征吸收峰分别出现在 3 421.6,3 421.6,3 419.7 cm-1处(1 350.1 cm-1处的吸收峰属于Ti─OH的特征吸收峰),而Ti─O─Ti键的伸缩振动吸收峰分别出现在634.6,646.1,592.1 cm-1处,这表明温度低于500℃时,温度升高,羟基的伸缩振动吸收峰没有发生变化,Ti─O─Ti键的伸缩振动吸收峰向高波数方向移动,催化活性增强;温度高于500℃时,随着温度升高,羟基和Ti─O─Ti键的伸缩振动吸收峰均向低波数方向移动,催化活性随之下降。
2.5 煅烧时间对TiO2-Cu光催化活性的影响
图7为煅烧时间对TiO2-Cu光催化活性的影响。
由图7可知,随着煅烧时间的增长,甲基橙的降解率先增加后降低,当煅烧时间为2 h时,甲基橙的降解率达到极大值,在MW、UV、MW/UV 3种条件下,甲基橙降解率分别为 3.78%,92.98%,98.39%,并且3种降解条件下的降解率始终是MW/UV>UV>MW,这同样说明在用紫外光照降解甲基橙时,微波辐射具有强化TiO2-Cu催化降解甲基橙的作用。当煅烧时间为2 h时,催化剂颗粒没有出现烧结现象,其拥有较高的比表面积,可以与溶液充分接触,致使催化剂具有较高的光催化活性;而煅烧时间过长时,催化剂颗粒出现过度烧结现象,晶型被破坏,表面的羟基也会发生变化,使晶面的催化活性位点减少,甚至消失,导致其光催化活性降低。因此,最佳煅烧时间为2 h。

图7 煅烧时间对TiO2-Cu光催化活性的影响Fig.7 The influence of calcined time on TiO2-Cu photo-catalytic activity
2.6 铜掺杂量对TiO2-Cu光催化活性的影响
图8为铜掺杂量TiO2-Cu光催化活性的影响。

图8 铜掺杂量对TiO2-Cu光催化活性的影响Fig.8 The influence of n(Cu)/n(Ti)mole ratio on TiO2-Cu photo-catalytic activity
由图8可知,随着铜掺杂量的增多,甲基橙的降解率先升高后下降,在铜掺杂量为n(Cu)/n(Ti)=0.025时,甲基橙的降解率达到极大值,在MW、UV、MW/UV 3种条件下,甲基橙降解率分别为3.78%,92.98%,98.39%,并且3种降解条件下的降解率始终是MW/UV>UV>MW。其原因可能是铜掺杂量较低时,铜元素掺入到TiO2晶格的间隙位,Cu2+的价电子排布为d9,易得电子,形成稳定结构,故成为电子的接受体,延长了TiO2中电子-空穴的复合时间,使其光催化活性提高。
不同铜掺杂量条件下制备的TiO2-Cu催化剂的红外光谱,见图9。
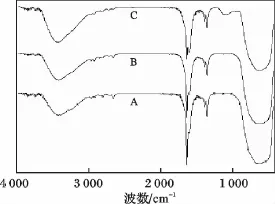
图9 不同铜掺杂量条件下制备TiO2-Cu的IR谱图Fig.9 IR spectrum of TiO2-Cu at different Cu/Ti molar ratioA.n(Cu)/n(Ti)=0;B.n(Cu)/n(Ti)=0.010;C.n(Cu)/n(Ti)=0.025
由图9可知,铜掺杂量n(Cu)/n(Ti)分别为0,0.010,0.025 条件下,羟基的伸缩振动吸收峰依次出现在 3 419.7,3 421,3 421 cm-1处,这表明铜掺杂后,羟基的伸缩振动吸收峰向高波数方向移动,羟基的能量提高,催化剂的光催化活性增强。由于Cu2+具有较强的溶剂化作用,易于羟基的附着,紫外光照射时,在铜的表面可以累积更多的表面羟基,形成游离活泼羟基,羟基可以有效的吸收微波能,使局部温度迅速升高,加快自由基反应,甲基橙迅速被氧化为小分子二氧化碳和水。
不同铜掺杂量条件下制备的TiO2-Cu催化剂的XRD图,见图10。

图10 不同铜掺杂量条件下制备TiO2-Cu的XRD图Fig.10 XRD pattern of TiO2-Cu at different Cu/Ti molar ratioA.n(Cu)/n(Ti)=0;B.n(Cu)/n(Ti)=0.010;C.n(Cu)/n(Ti)=0.025
根据jade软件分析,101晶面的粒径分别为17.8,10.9,13.4 nm,与没有掺杂的纯 TiO2相比,铜掺杂后TiO2-Cu的粒径减小。Cu2+与Ti4+离子半径相近,Cu的3d电子数较多,更易于与O结合,替换TiO2晶格中的Ti,使晶格畸变,键长和键角发生变化,从而造成TiO2-Cu粒径变小[18];另外,晶格畸变使分子的极性增大,表面的氢键打开,在微波辐射作用下,催化剂表面形成活性羟基,再加之紫外光照射时引发自由基反应,有机物被矿化,最终形成无污染的小分子,使催化剂的光催化活性提高。
由图10可知,与纯TiO2相比,铜掺杂后TiO2-Cu催化剂部分晶面的不对称性提高,极性增强,在微波辐射作用下,可以迅速启动极性基团的定向振动,使TiO2-Cu表面的水脱附下来,形成羟基,再加之紫外光照射时催化剂吸收光子的能量,造成电子的跃迁,产生电子-空穴对,致使有机物中的键断裂,形成新的中间产物,中间产物在微波的作用下,也会急速振动,体系温度升高,有机污染物键被打开,致使其被氧化成无污染的小分子,从而导致催化剂的光催化活性提高。
2.7 可见光对TiO2-Cu光催化活性的影响
在可见光照条件下,TiO2-Cu对甲基橙溶液的降解率见表1。

表1 太阳光下TiO2-Cu对甲基橙的降解率Table 1 The degradation rate of methyl orange for TiO2-Cu in sun light
由表1可知,随着可见光照射时间的延长,甲基橙的降解率逐渐提高,照射4 h时,甲基橙几乎达到完全降解,这表明铜掺杂TiO2-Cu催化剂具有良好的吸收可见光的性能,也说明铜掺杂可以使锐钛矿型TiO2的吸收带红移。彭金辉等[18]对铜、铁、镍元素掺杂锐钛矿型TiO2进行了第一性原理计算,得出掺杂锐钛矿相TiO2活性提高最显著的金属元素为铜,锐钛矿型TiO2的禁带宽度为3.2 eV,铜元素掺入间隙位、桥位、置换位,禁带宽度分别为1.984,1.907,1.775 eV,铜比铁、镍更易取代 TiO2中的钛原子,铜处于置换位时禁带宽度最窄。
2.8 TiO2-Cu的SEM表征及比表面积分析
离子液体用量5.6 mL,硝酸铜与钛酸丁酯的物质的量比为0.025,微波干燥时间20 min,干燥功率210 W,煅烧温度550℃,煅烧时间2 h条件下,制备TiO2-Cu催化剂的SEM,见图11。
由图11可知,TiO2-Cu催化剂的粒径为纳米级别,微粒近似球形,球形的比表面积较大,稳定性较好,可以充分接触甲基橙溶液,提高催化活性。
最佳条件下制备TiO2-Cu对氮气的吸附脱附,见图12,BET法求得煅烧温度为500℃时,催化剂的比表面积为 85.201 m2/g,孔容积为 0.162 9 cm3/g,平均孔径为3.825 nm。图13为TiO2-Cu催化剂的半孔宽与孔容积及导数关系图,利用DFT方法分析求得催化剂的半孔宽为2.171 4 nm。

图11 TiO2-Cu催化剂的SEM图Fig.11 SEM spectrum of TiO2-Cu catalyst

图13 TiO2-Cu催化剂的DFT曲线Fig.13 DFT analysis of TiO2-Cu catalyst
从以上分析数据可以看出,TiO2-Cu催化剂的比表面积较大,增加了与降解物的接触面,导致催化活性提高。另外,催化剂还拥有较高的孔容积、平均孔径和半孔宽,这为光生-电子空穴对和活性羟基从催化剂表面形成后向溶液中移动提供了空间,同样导致催化剂具有较高的光催化活性。
3 结论
(1)微波辅助离子液体中制备TiO2-Cu催化剂的最优条件为:离子液体用量5.6 mL,硝酸铜与钛酸丁酯的物质的量之比为0.025,微波干燥时间20 min,干燥功率210 W,煅烧温度500℃,煅烧时间2 h。
(2)TiO2-Cu催化剂在微波、紫外、微波-紫外3种降解条件下,甲基橙降解率分别为 3.78%,92.98%,98.39%。这表明在紫外光照条件下,微波辐射具有强化TiO2-Cu催化降解甲基橙的作用。
(3)TiO2-Cu催化剂具有粒径均匀、比表面积、孔容积、平均孔径和半孔宽都较大等特点,这也是TiO2-Cu催化剂拥有较高的光催化活性的主要原因。
[1]袁丽欣.浅谈城市水污染问题及防治对策[J].科技资讯,2012,36(1):141-144.
[2]白玉娜,左胜利,于迎春.氮-硫共掺杂二氧化钛光催化剂的制备及其可见光催化活性[J].化学研究,2013,24(4):355-360.
[3]Junya O,Akira Y,Kentaro T.Modification of metal nanoparticles with TiO2and metal-support interaction in photodeposition[J].ACS Catalysis,2011,1:187-192.
[4]蒋文建,孙婧,毕先钧.微波助离子液体中S掺杂TiO2催化剂的制备及其微波强化光催化活性[J].化学工程与技术,2013,3(4):114-121.
[5]Wen Yanyuan,Ding Hanming.Preparation and photo-catalytic activity of Ag-AgCl modified anatase TiO2nanotubes[J].Chin J Cata,2011,32:36-45.
[6]杨艳琼,王昭,毕先钧.微波助离子液体中纳米TiO2/PMMA复合材料的制备及光催化性能[J].分子催化,2008,22(4):362-367.
[7]Sun Qiong,Xu Yiming.Sensitization of TiO2with aluminum phthalocyanine:Factors influencing the efficiency for chlorophenol degradation in water under visible light[J].The Journal of Physical Chemistry C,2009,113:12387-12394.
[8]Zhang Lihong,Li Peijun,Zong Qiang.Photo-catalytic degradation of polycyclic aromatic hydrocarbons on soil surfaces using TiO2under UV light[J].Journal of Hazardous Materials,2008,158:478-484.
[9]Wang He,Lu Z G,Xi L J,et al.Facile and rapid synthesis of highly porous wire like TiO2as anodes for lithium-ion batteries[J].ACS Applied Materials & Interfaces,2012,4:1608-1613.
[10]杨波,余刚,赵绪新.物理场协同作用降解有机污染物研究进展[J].环境污染与防治,2010,32(8):66-70.
[11]Yang Shaogui,Fu Hongbo,Sun Cheng,et al.Rapid photocatalytic destruction of pentachlorophenol in F-Si-co-modified TiO2suspensions under microwave irradiation[J].Journal of Hazardous Materials,2009,161(2):1281-1287.
[12]郭雅静.微波紫外耦合辐射降解吸附态苯酚的研究[D].哈尔滨:哈尔滨工业大学,2011.
[13]Liu Z,Huang S,Wang W.A refined force field for molecular simulation of imidazolium-based ionic liquids[J].The Journal of Physical Chemistry B,2004,108(34):12978-12989.
[14]张桂琴,毕先钧.微波助离子液体中锌-铁共掺杂纳米TiO2光催化剂的制备及其光催化活性[J].化学研究,2011,22(5):55-62.
[15]孙婧,蒋文建,张桂琴,等.微波助离子液体中锌掺杂纳米TiO2的制备及微波强化光催化氧化活性[J].工业催化,2013,21(3):27-33.
[16]蒋文建,孙婧,毕先钧.微波助离子液体中硫-钕共掺杂纳米TiO2的制备及微波强化光催化氧化活性[J].工业催化,2013,21(9):32-37.
[17]胡庆华,张蔚萍,王建国.Cu2+/TiO2纳米纤维掺杂比对一氯甲烷光催化降解的影响[J].无机盐工业,2010,42(11):23-24.
[18]何承东,彭金辉.掺杂锐钛矿型二氧化钛光催化性能的第一性原理计算[D].昆明:昆明理工大学,2011.

