刀豆蛋白A诱导人脐静脉内皮细胞表达p-ERK1/2
龚文广,王红梅,牛青霞
(汕头大学医学院炎症与免疫性疾病研究所及病理生理学教研室,广东 汕头 515041)
刀豆蛋白A诱导人脐静脉内皮细胞表达p-ERK1/2
龚文广,王红梅,牛青霞
(汕头大学医学院炎症与免疫性疾病研究所及病理生理学教研室,广东 汕头 515041)
目的探讨刀豆蛋白A(ConcanavalinA,ConA)对CRL2480细胞(人脐静脉内皮细胞系)细胞外调节蛋白激酶(Extracellular signal-regulated kinase,ERK)1/2磷酸化的影响。方法采用MTT法检测ConA对CRL2480细胞活化的影响;采用Western印迹法检测CRL2480细胞磷酸化(p)-ERK1/2的表达;采用细胞免疫荧光技术检测p-ERK1/2在细胞内的分布。结果在5~20 μg/ml范围,ConA刺激CRL2480细胞8 h的活化指数具有剂量依赖性;20 μg/ml ConA显著增加CRL2480细胞的活化(P<0.05)。ConA能够增加CRL2480细胞的p-ERK1/2表达水平(P<0.05),ERK途径抑制剂PD98059和U0126明显抑制p-ERK1/2表达。免疫荧光染色结果显示ConA刺激细胞的荧光信号明显高于对照细胞,荧光分布于细胞浆、细胞核周围和细胞核内。结论ConA能够激活CRL2480细胞表达p-ERK1/2。
刀豆球蛋白A;内皮细胞;细胞外调节蛋白激酶
刀豆蛋白A又称伴刀豆球蛋白A(Concanavalin A,ConA),是从巨刀豆中提取的一种植物凝集素,为四聚体蛋白,可以与生物大分子末端的α-D-甘露糖基以及α-D-葡萄糖基结合[1]。因小鼠模型中,ConA肝损伤的某些病理变化类同与人肝炎的病理特点,据此ConA肝损伤常被用于研究人的肝脏疾病[2]。尾静脉注射的ConA主要结合于肝内皮细胞[3]。另外,ConA与肿瘤免疫细胞的激活和肿瘤新生血管密切相关[1],被视为新的抗肿瘤策略。血管内皮细胞位于血管的内表面,不断受到血源性因素刺激,积极参与炎症、凝血和血管新生等病理生理过程。因此,我们认为血管内皮细胞在ConA相关的反应中起重要作用。细胞外调节蛋白激酶(Extracellular regulated proteinkinases,ERK)是一类丝氨酸/苏氨酸(Serine/ threonine,Ser/Thr)蛋白激酶,包括ERK1和ERK2(统称为ERK1/2)。ERK1/2信号途径属于丝裂原活化蛋白激酶家族(Mitogen activated protein kinase,MAPK)家族,能够被生长因子、细胞因子、丝裂原等诸多因素激活,调节细胞功能(如增殖、迁移和表达炎症介质),与炎症、肿瘤及血管性疾病密切相关[4-5]。本研究采用CRL2480细胞(人脐静脉内皮细胞系)为细胞研究模型,观察ConA及ERK信号途径抑制剂(PD98059和U0126)对磷酸化(p)-ERK1/2分子表达的影响。
1 材料与方法
1.1 主要材料、仪器和培养液 CRL2480细胞系购自ADCC(美国);胎牛血清(FBS)、胰胰岛素-转铁蛋白-硒添加物(ITS)、M199培养液、谷氨酰胺和抗小鼠Cy3荧光抗体购自Invitrogen公司(美国),内皮细胞生长添加物(ECGS)购自EMD Bio-sciences公司(美国);肝素、ConA、青霉素-链霉素、噻唑蓝(MTT)购自Sigma公司美国);ERK信号CASE试剂盒(包括抗 p-ERK1/2(Thr202/Tyr204)、抗-ERK1/2 (Thr202/Tyr204)、二抗及各种缓冲液)购自SuperArray公司(美国);PD98059和U0126购自Calbiochem公司(美国);抗β微管蛋白抗体购自CST公司(美国);细胞裂解液购自碧云天生物技术研究所(中国),丙烯酰胺、甲叉丙烯酰胺混合物(1:29)购自Bio-Rad公司;PVDF膜购自Millipore公司;ECL化学发光试剂盒购自Promega公司(美国)。主要仪器包括倒置荧光显微镜(Olympus公司,日本)、CO2培养箱(Kendro公司,德国)、生物安全柜购自(Heal force公司,中国)、离心机(Eppendorf公司,美国)、电泳仪和半干转膜仪(Bio-Rad公司,美国)、扫描仪(Amersham公司,美国)和酶标仪(Molecular Devices公司,美国)。完全培养液包括12.5 μg/ml ECGS,100 μg/ml肝素、10%FBS、2 mmol/L谷氨酰胺、10 mmol/L Hepes和M199培养液,无血清培养液包括不含血清的完全培养液和1%ITS,12.5%聚丙烯酰胺凝胶、凝胶电泳及转膜缓冲液按分子克隆实验指南[6]配制。
1.2 细胞培养 CRL2480细胞培养于完全培养液中,密度约90%时,胰蛋白酶消化、传代,3~4 d传代1次。
1.3 MTT法检测CRL2480细胞活性 将CRL2480细胞接种于96孔培养板,密度约80%。将完全培养液换为无血清培养液,培养过夜。分别用5 μg/ml、10 μg/ml、20 μg/ml ConA刺激细胞30 min和8 h。加2.5 mg/ml MTT,20 μl/孔,继续培养4 h。吸弃培养上清,加二甲亚砜150 μl/孔,570 nm波长下检测吸光度值。复孔6个,实验重复4次。细胞活化指数= ConA刺激细胞的A570值/对照细胞的A570值。
1.4 Western印迹法检测p-ERK ①样品制备:完全培养液培养细胞至密度为80%,换为无血清培养液,过夜。PD98059和U0126预处理细胞30 min,20 μg/ml ConA刺激细胞15 min,对照细胞组不加ConA。吸弃培养液,加入裂解液,冰上裂解30 min,收集细胞裂解液。4℃下,离心8 000 r/min×15 min,收集上清。②12.5%SDS-PAGE分离蛋白:按分子克隆实验指南操作[6]。煮沸样品5 min,20 μl/孔。80 V 1 h,100 V 2 h。③半干转膜仪转移蛋白:20%甲醇缓冲液作用PVDF膜10 min。在半干转膜仪板上,依次放置滤纸、电泳后凝胶、甲醇处理的PVDF膜和滤纸,加盖。15 V 1 h。④处理含目的蛋白的PVDF膜:封闭缓冲液封闭PVDF膜1 h,洗涤缓冲液洗膜3次,5 min/次。分别加抗p-ERK1/2和抗-ERK1/2抗体(1:1 000),4℃孵育过夜,洗膜3次。加二抗(1:100),1 h/室温,洗膜3次。⑤结果视化和半定量处理:按试剂说明书,加发光液,曝光、显影、定影、扫描,ImageJ软件半定量分析显色条带。⑥PD98059和U0126浓度选择:0 μmol/L、25 μmol/L和50 μmol/L PD98059,0 μmol/L、5 μmol/L、10 μmol/L和20 μmol/L U0126、ConA对照以及溶剂(二甲亚砜)对照预处理CRL2480细胞30 min,20 μg/ml ConA刺激细胞15 min,进行预试验,因50 μmol/L PD98059和10 μmol/L U0126几乎完全抑制ConA诱导的p-ERK1/2表达。因此,将他们用于本研究。
1.5 细胞免疫荧光法检测 p-ERK1/2 将CRL2480细胞接种于培养孔中,完全培养液培养24 h,无血清培养液培养过夜。50 μmol/L PD98059和10μmol/LU0126预处理细胞30 min后,20μg/ml ConA处理细胞15 min,PBS洗细胞3次。固定、通透、洗细胞,封闭缓冲液封闭非特异性位点1 h。加抗p-ERK1/2抗体,4℃孵育过夜。洗细胞,加cy3标记的抗小鼠荧光二抗结合物(1:800),室温避光孵育30 min,洗细胞。Hochest3342(1:3 000)染细胞核,洗细胞,荧光显微镜下观察、拍照。
2 结 果
2.1 ConA对CRL2480细胞活化的影响 MTT法检测表明:在5~20 μg/ml范围内,ConA处理8 h,CRL2480细胞的活化具有剂量依赖性;20 μg/ml ConA显著增加CRL2480细胞的活化指数(P<0.05)。因此,20 μg/ml ConA被用于进一步研究。ConA处理细胞30 min,各剂量组间活化指数的差异无统计学意义(P>0.05),见图1。
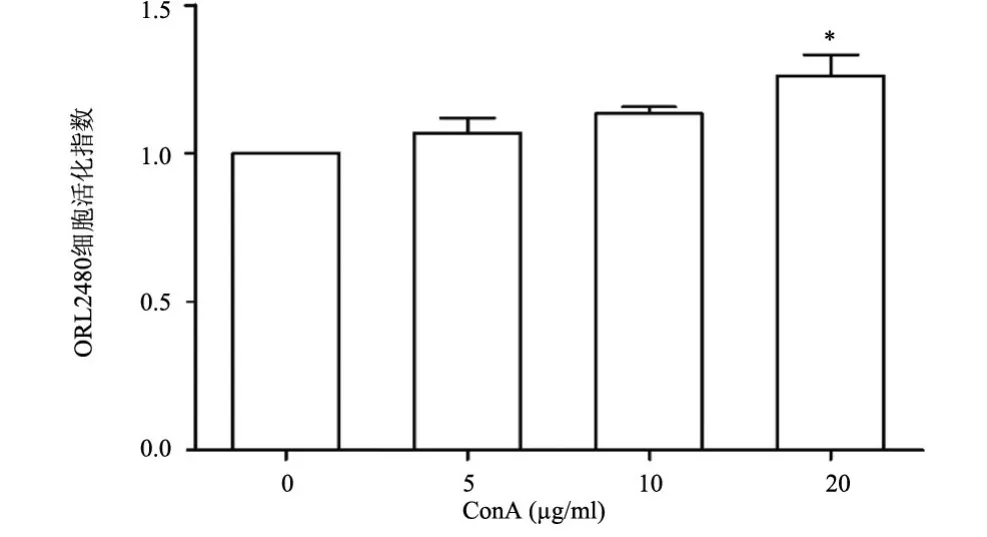
图1 ConA对CRL2480细胞活化指数的影响(n=4)
2.2 PD98059和U0126对CRL2480细胞活化的影响 ConA处理CRL2480细胞8 h的MTT结果表明:①ConA处理细胞的活化指数高于对照细胞(P<0.05);②50 μmol/L PD98059和10 μmol/L U0126组的活化指数与细胞对照组的差异无统计学意义(P>0.05):③50 μmol/L PD98059+ConA和10 μmol/L U0126+ConA组细胞的活化指数低于ConA组,但差异无统计学意义(P>0.05)。ConA处理CRL2480细胞30 min,各观察组间活化指数的差异无统计学意义(P>0.05)。这提示MTT法的灵敏度不足以反映PD98059和U0126对ConA作用的抑制效应。
2.3 ConA诱导p-ERK表达 Western印迹法结果表明:20 μg/ml的ConA刺激CRL2480细胞15 min,p-ERK1/2表达水平明显高于对照细胞(P<0.05);50 μ mol/L PD98059和10 μmol/L U0126显著抑制ConA诱导的p-ERK1/2表达水平(P均<0.05,图2A,2B)。免疫荧光染色显示:ConA处理细胞的荧光信号明显高于对照细胞;荧光斑点分布于细胞浆、细胞核周围和细胞核内;PD98059和U0126预处理细胞的荧光信号明显减弱(图2C)。
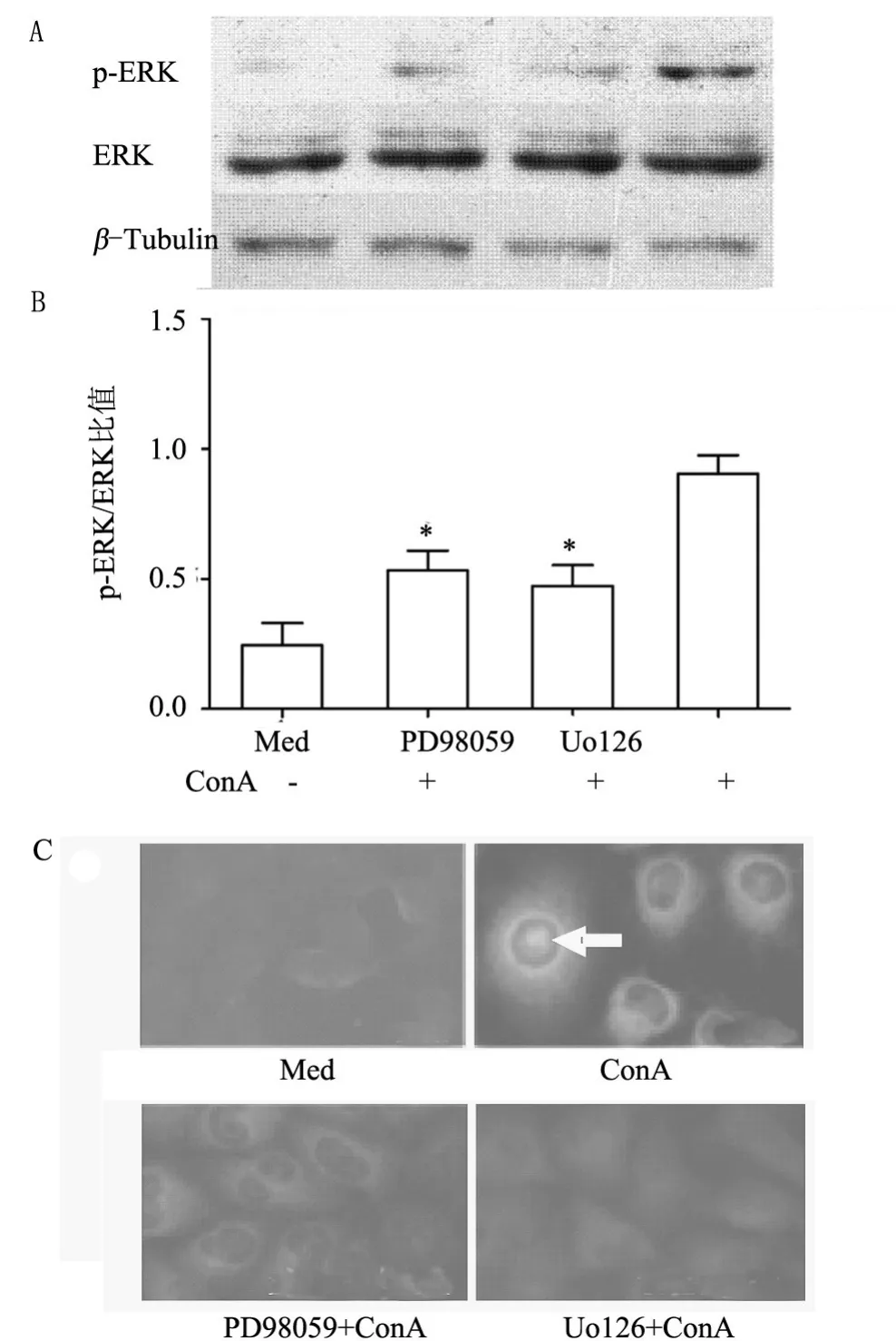
图2 ConA对p-ERK1/2表达的影响(n=4)
3 讨论
采用蛋白酪氨酸磷酸酶2(SHP2)野生型和突变型成纤维细胞,研究信号转导时发现:通过SHP2-ras-ERK和SHP2-ras-p38途径,ConA刺激细胞基质金属蛋白酶-2分泌[7];ConA通过SHP2-MEK1-ERK途径,ConA促进细胞分泌金属蛋白酶组织抑制剂-2[8]。Zhao等[9]在细胞表面糖蛋白PZR的研究中发现:ConA刺激HT-1080,293和HeLa细胞,可以引起细胞表面PZR酪氨酸磷酸化,激活SHP2和细胞凝集反应。Roy等[9]报道ConA通过MEK/ERK途径,激活HeLa细胞的自噬作用。我们用ConA处理CRL24808细胞8 h,该细胞活化水平升高。Western印迹法结果表明ConA能够增加CRL2480细胞的p-ERK1/2分子表达。采用抗p-ERK1/2抗体染色的结果显示:ConA处理细胞的荧光强度显著高于对照细胞;荧光分布于细胞浆、细胞核周围及细胞核内;ERK途径抑制剂PD98059和U0126显著降低ConA诱导的p-ERK1/2水平。这表明ConA能够激活CRL2480细胞的ERK信号途径。当用ConA和层粘连蛋白刺激小鼠腹水肝癌细胞,可以引起微丝在细胞膜下重新组装,并且促进DNA合成,提示微丝在信号分子从细胞膜运输到细胞核中起关键作用[11]。胡良高等[12]研究表明ConA与巨噬细胞膜受体结合后,加速膜下肌动蛋白多聚化,微丝走向从细胞膜延伸到细胞中央。本研究中:内皮细胞浆内的红色丝状荧光物质,可能与p-ERK1/2附着在微丝上面有关;细胞核周围的荧光信号可能与细胞浆p-ERK1/2向细胞核内移动、聚集有关。据此,我们认为ConA能够通过内皮细胞膜表面的结合位点,引起细胞浆的p-ERK1/2分子表达升高。p-ERK1/2进入细胞核,启动转录、mRNA和蛋白质的表达(图3)。

图3 ConA激活CRLl2480细胞ERK信号途径模式图
综上所述,ConA能够激活CRL2480细胞表达p-ERK1/2,提示干预ERK的活化有利于调节内皮细胞和血管的功能。
[1]Li WW,Yu JY,Xu HL,et al.Concanavalin A:a potential anti-neoplastic agent targeting apoptosis,autophagy and anti-angiogenesis for cancer therapeutics[J].Biochem Biophys Res Commun,2011, 414(2):282-286.
[2]Zhou YC,Chen S,Cao JJ,et al.Adenovirus-mediated viral interleukin-10 gene transfer prevents concanavalin A-induced liver injury [J].Dig Liver Dis,2012,44(5):398-405.
[3]Knolle PA,Gerken G,Loser E,et al.Role of sinusoidal endothelial cells of the liver in concanavalin A-induced hepatic injury in mice [J].Hepatology,1996,24(4):824-829.
[4] Kohno M,Tanimura S,Ozaki K.Targeting the extracellular signal-regulated kinase pathway in cancer therapy[J].Biol Pharm Bull,2011,34(12):1781-1784.
[5] Chu X,Ci X,He J,et al.A novel anti-inflammatory role for ginkgolide B in asthma via inhibition of the ERK/MAPK signaling pathway[J].Molecules,2011,16(9):7634-7648.
[6]Sambrook J,Fritsch EF,Maniatis T,et al.金冬雁,黎孟枫,等译.分子克隆实验指南[M].2版.北京:科学出版社,1993:888-898.
[7]Ruhul Amin AR,Oo ML,Senga T,et al.SH2 domain containing protein tyrosine phosphatase 2 regulates concanavalin A-dependent secretion and activation of matrix metalloproteinase 2 via the extracellular signal-regulated kinase and p38 pathways[J].Cancer Res, 2003,63(19):6334-6339.
[8]Biswas MH,Hasegawa HH,Rahman MA,et al.SHP-2-Erk signaling regulates concanavalin A-dependent production of TIMP-2[J]. Biochem Biophys Res Commun,2006,348(3):1145-1149.
[9]Zhao R,Guerrah A,Tang H,et al.Cell surface glycoprotein PZR is a major mediator of concanavalin A-induced cell signaling[J].J Biol Chem,2002,277(10):7882-7888.
[10]Roy B,Pattanaik AK,Das J,et al.Role of PI3K/Akt/mTOR and MEK/ERK pathway in concanavalin A induced autophagy in HeLa cells[J].Chem Biol Interact,2014,210:96-102.
[11]Wei X,Cai J,Liu F,et al.Possibility of signal transduction through microfilaments below the membrane following ligand-receptor interaction[J].Chin Med Sci J,1993.8(4):218-222.
[12]胡良高,宁 红,尹忆民,等.伴刀豆球蛋白A与巨噬细胞膜受体结合对膜下F-actin的影响[J].生物物理学报,1996,12(1):61-66.
Concanavalin A enhances p-ERK1/2 expression in CRL2480 cells.
GONG Wen-guang,WANG Hong-mei,NIU Qing-xia.
Institute of Inflammation and Immune Disease,Department of Pathophysiology,Medical College of Shantou University,Shantou 515041,Guangdong,CHINA
ObjectiveTo explore the influence of concanavalinA(ConA)on the expression of phosphorylated extracellular signal-regulated kinase(p-ERK)1/2 in CRL2480 cells(human umbilical vein endothelial cell line).MethodsActivated effect of ConAon CRL2480 endothelial cells was detected by MTT assay.P-ERK1/2 expression was examined by western blot.The distribution of p-ERK1/2 was observed via immunofluorescent staining.ResultsAfter 8h incubation,ConA increased the activated index of the cells in a dose dependent manner in the range of 5~20 μg/ml(P<0.05).The immunoblot displayed that 20 μ g/ml ConA increased p-ERK1/2 expression in the cells(P<0.05).PD98059 and U0126(both ERK pathway inhibitors)exerted inhibitory action on p-ERK1/2 expression(P<0.05).The fluorescent intensities existed in the cytoplasm and the nuclei of ConA-treated cells were much stronger than those of control cells.Conclusion ConAis able to upregulate p-ERK1/2 expression in CRL2480 cells.
ConcanavalinA;Endothelial Cells;Extracellular signal-regulated kinase
R329.2+8
A
1003—6350(2014)14—2029—04
10.3969/j.issn.1003-6350.2014.14.0790
2014-01-24)
国家自然科学基金(编号:81072941)
牛青霞。E-mail:gongwenguang@163.com