pH对魔芋胶复配体系凝胶特性及色泽的影响
庄远红,刘静娜,潘裕添,黄家福,庞 杰
(1.闽南师范大学 生物科学与技术学院,漳州 363000;2.闽南师范大学 菌物产业工程技术中心,漳州 363000;3.福建农林大学 食品科学学院,福州 350002)
多糖是一类重要的大分子物质,凝胶化性质是 多糖大分子生物功能的重要方面。魔芋葡甘聚糖(KGM)是由D-葡萄糖和D-甘露糖按1∶1.6的比例以 β-1,4-糖苷键聚合的大分子非凝胶多糖[1-3],该多糖不具凝胶性,单一的魔芋葡甘聚糖也存在着成胶能力弱、胶用量大、凝胶析水量大等不足之处,但是多糖共混可以改变其凝胶性能。
κ-卡拉胶是由 D-半乳糖-4-硫酸酯和 3,6-脱水-D-半乳糖交替连接而成的线型多糖[4-5],它具有较强的阴离子活性[6],是一种凝胶多糖[5],但其单独形成的凝胶存在脆性大、弹性小、易脱液收缩等问题[2,5]。在κ-卡拉胶中添加一定量的魔芋胶所形成的凝胶具有所需原料少、凝胶强度大、弹性好等特点。卡拉胶螺旋结构可自交联或与甘露聚糖分子链交联,因甘露聚糖分子电荷密度较小,甘露聚糖与卡拉胶的交联要优于卡拉胶间的交联[7]。魔芋葡苷聚糖分子平滑,没有分支链,与卡拉胶分子的双螺旋结构以次级键结合形成三维网状结构,从而产生协同增效作用,但所形成的凝胶容易受pH的影响,在pH低的环境中,多糖分子间氢键容易断开,在pH高的环境中,卡拉胶大分子间相互缠绕作用差[8]。蛋白质和多糖共存时,大分子上的部分基团可以相互连接,紧密缠绕,最终形成稳定的交联结构,从而赋予聚合物一些独特的性质,如增强其乳化性和凝胶性等[9]。蛋白质-多糖复合物形成过程较复杂,pH、多糖类型、电荷密度、分子柔韧性和离子强度等因素对反应的进行和最终产物功能性质都有一定影响。蛋白质分子所带净电荷及其参与库仑作用程度取决于溶液pH偏离蛋白等电点pI程度。当溶液pH<pI时,蛋白质显阳性,此时蛋白质与阴性多糖产生静电作用形成不可溶复合物;当pH>pI时,蛋白质显阴性,多糖与蛋白质通过疏水相互作用和氢键作用形成可溶性复合物[10]。因此,通过调节pH可以改变多糖―蛋白质表界面性质、溶解性和稳定性等,从而影响凝胶品质特性。
笔者主要考察不同pH条件下魔芋多糖、κ-卡拉胶与大豆分离蛋白形成的凝胶质构及色泽的变化,以期为魔芋食品的开发利用奠定理论基础。
1 材料与方法
1.1 材料
魔芋精粉(含KGM 85%)、κ-卡拉胶、大豆分离蛋白(含蛋白质90%),均由福州素天下食品有限公司提供。
1.2 主要仪器设备
TA-plus质构仪(Lloyd公司),ColorFlexTM测色仪(HunterLab公司),BS 124S型电子天平(赛多利斯科学仪器(北京)有限公司),HH-2型数显恒温水浴锅(江苏省金坛市江南仪器厂),NDJ-9S型数显黏度计(上海精密科学仪器有限公司)。
1.3 实验设计
保持共混体系总质量分数为1%,固定复合物中多糖和大豆分离蛋白质量比为8∶2,魔芋精粉和κ-卡拉胶的质量比保持在2∶8,即魔芋精粉质量分数0.16%、κ-卡拉胶0.64%、大豆分离蛋白0.2%,先将大豆分离蛋白分散到温水中,搅拌让其溶解,再将魔芋粉及κ-卡拉胶在不断搅拌的条件下,缓慢地分散到大豆分离蛋白液中,尽量避免结块,即得到混合体系的混合分散液,分别调节pH至3、4、5、6、7、8 和9,在80 ℃下溶胀 15 min,取出,在室温下放置12 h使之冷却形成凝胶体。
1.4 测定方法
1.4.1 凝胶强度、弹性、咀嚼性测定
采用TPA模式,选用12.7 mm柱形探头。具体参数设定:测前速率1 mm/s,测试速率 1 mm/s,测试后速率1 mm/s,测试距离20.0 mm。
1.4.2 黏度测定
将溶胀后的凝胶于室温下静置 15 min,用NDJ-9S数显黏度计,选用S1号转头,速度60 r/min,测量复配凝胶黏度值。
1.4.3 色度测定
使用ColorFlexTM测色仪,以黑板为标样测定色差值ΔE*,其值大小表示着色样品与标样的颜色差别程度。
2 结果与讨论
2.1 pH对魔芋胶复配体系凝胶强度的影响
考察pH对魔芋胶复配体系的凝胶强度的影响,结果见图1。由图1可知:随着pH的升高,凝胶强度呈“S”型变化。在pH 3~5之间,凝胶强度随pH的升高而增大,Penroj等[4]研究发现,当 pH <4时,κ-卡拉胶容易发生酸水解作用,加热使水解加快,大分子降解为小分子,黏度下降,失去凝固性,不能形成有序的网状结构,因此凝胶强度较小。当pH=5时,凝胶强度最大,可能是此时大豆分离蛋白处于等电点附近,因不带静电荷发生聚沉作用,蛋白质分子聚合度高,分子之间结合紧密,因而表现出最高的凝胶强度。随着pH的继续升高,蛋白质所带静电荷数逐渐增加,蛋白质与水分之间的吸引力加强,而蛋白质分子间的斥力增大,蛋白质分子充分吸水伸展,持水性增强,凝胶强度下降[11]。但在pH为6~8时,共混胶的凝胶强度有所增加,可能是在此时卡拉胶酸水解程度大大下降,在卡拉胶、魔芋精粉和大豆分离蛋白的相互作用下,凝胶呈现出较好的凝胶强度。Penroj等[4]通过X线衍射分析发现在碱性条件下共混胶中魔芋胶的胶束有序排列增多,结晶区增加,有利于提高共混胶的屈服应力、强度和凝胶强度等,也可能是魔芋胶碱化后其分子链上脱去部分乙酰基,而脱去乙酰基的魔芋胶分子间能形成氢键,增强了分子间的作用力,提高了凝胶强度。当pH>8时,凝胶强度下降,这与Huang等[12]研究结果一致,可能是魔芋粉在碱性环境中受到水解,使凝胶强度降低[13]。
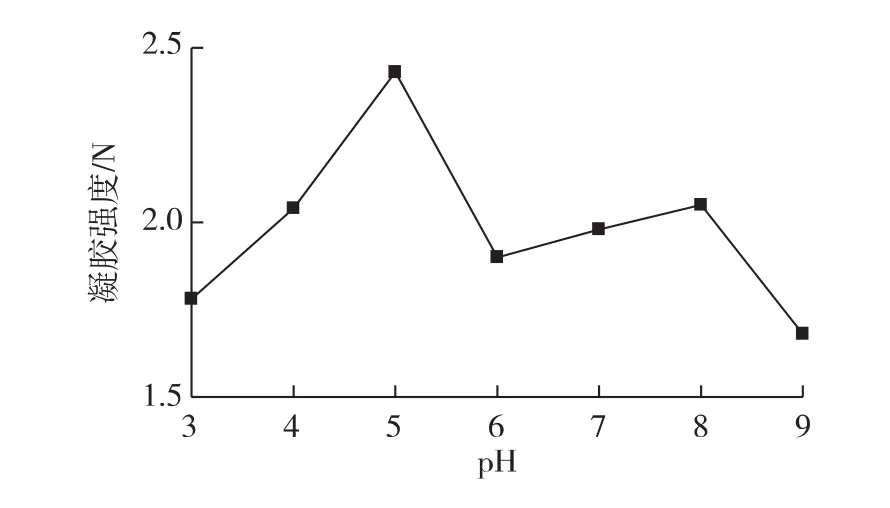
图1 pH对复合物凝胶强度的影响Fig.1 Effects of pH on gel strength of composite system
2.2 pH对魔芋胶复配体系弹性的影响
考察pH对魔芋胶复配体系弹性的影响,结果见图2。由图2可知:在pH为3~9范围内,混合凝胶均呈现出很好的弹性,数值均在0.95以上,这与Penroj等[4]与杨玉玲等[14]的研究结果是一致的,可能是因为此复配体系卡拉胶的含量较大,因此表现出的某些凝胶特性与卡拉胶较为相似。在pH为3时,出现最小值,主要是因为此时κ-卡拉胶发生酸水解作用,大分子降解为小分子,不能形成有序的网状结构;同时,浓度较高的H+容易导致卡拉胶分子和KGM已形成的氢键断裂,导致已经形成的网络结构降解,从而导致凝胶弹性的下降。受魔芋精粉和大豆分离蛋白的影响,在pH为4~5时,凝胶弹性下降,主要是因为KGM是阴离子多糖,而蛋白质是两性聚电解质,当pH<5(蛋白质等电点)时,由于蛋白质所带净电荷为正,阴离子多糖与带正电荷的蛋白质分子产生强的静电作用,形成不溶复合物,因此弹性有所降低;当pH>5时,多糖与蛋白质通过疏水相互作用和氢键作用形成可溶性复合物,对其加热形成具黏弹性的三维结构,将水分子包围其中,从而得到了弹性、咀嚼性好,但凝胶强度较小的凝胶[11]。

图2 pH对复合物凝胶弹性的影响Fig.2 Effects of pH on springiness of composite system
2.3 pH对魔芋胶复配体系咀嚼性的影响
咀嚼性=凝胶强度×内聚性×弹性;因此,有必要考察pH对魔芋胶复配体系咀嚼性的影响,结果见图3。由图3可知,咀嚼性随pH的增大,大致呈上升趋势,在pH为5时,咀嚼性突然上升,这个变化可能凝胶强度的突然增大有关。

图3 pH对复合物凝胶咀嚼性的影响Fig.3 Effects of pH on chewiness of composite system
2.4 pH对魔芋胶复配体系黏度的影响
图4为pH对魔芋胶复配体系黏度的影响结果。由图4可知,随着pH的升高,黏度呈先增大后减小的趋势。在pH<4时,凝胶黏度较小,主要是较高的酸度降低了混合胶的pH,pH的变化引起多糖分子间氢键部分断开,分子舒展,致使黏度下降[15];也可能因为卡拉胶是一种带负电荷的高分子多糖,具有半硫酸酯基(—ROSO-3)而表现出强烈的阴离子性,当它与H+结合成卡拉胶酸时,稳定性最差,因此在酸性条件下加热时,卡拉胶组成物容易发生水解,使卡拉胶黏度显著降低[16]。在pH 4~9范围内,凝胶体系黏度变化不大,均在0.08到0.1之间,但在pH为7时达到最大值。当pH>7时,凝胶黏度开始下降,主要是因为碱性增强不利于卡拉胶大分子的相互缠绕,故强酸、强碱环境下胶液黏度较小[8]。这与杨永利等[17]的研究结果是一致的。
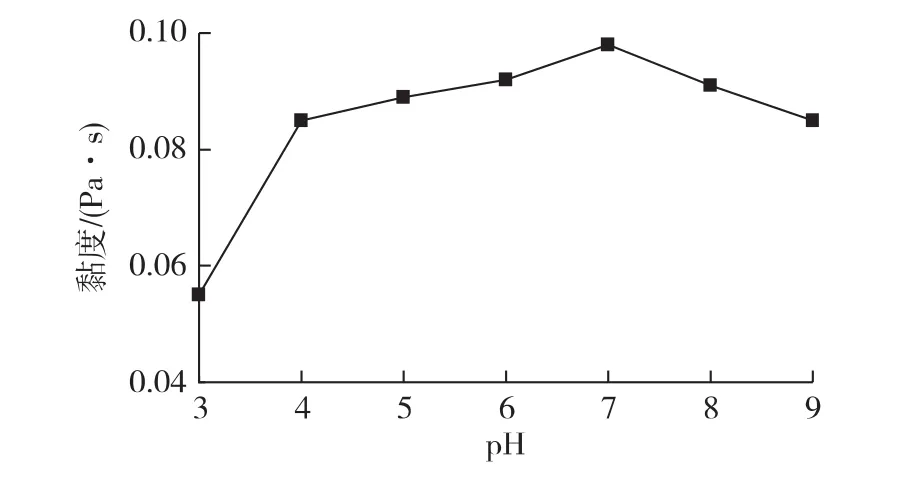
图4 pH对复合物凝胶黏度的影响Fig.4 Effects of pH on viscosity of composite system
2.5 pH对魔芋胶复配体系色泽的影响
图5为pH对魔芋胶体复配体系色泽的影响结果。由图5可知:当pH<4时,复配体系凝胶色差变化较大;当pH 4~9时,凝胶色差变化不大,ΔE*均为31左右。当pH=3时,复配凝胶色泽较透明,pH 4~7时色泽为乳白色,pH>8时色泽偏黄。可能原因是:在pH<4时,由于卡拉胶的水解导致不能形成有序的网络结构,因此凝胶色泽较透明。在pH 4~7时,由于蛋白酸沉凝乳,色泽呈现乳白色。在pH>8时,颜色变黄,可能是因为大豆分离蛋白在加碱后,其所含的发色基团和助色基团相连接或发生共轭反应,使共轭键或生色基团的吸收波移向长波方向导致凝胶显色[18]。

图5 pH对复合物凝胶色泽的影响Fig.5 Effects of pH on color of composite system
3 结论
在强酸性条件下(pH<4),魔芋胶复配体系凝胶特性(强度、弹性、咀嚼性和黏度)较差,但此时色泽最好,较透明,易于上色;随着pH的升高并逐渐到达蛋白质等电点(pH 5),凝胶特性显著提高,到达蛋白质等电点时凝胶强度和咀嚼性最高;在pH 4~8时凝胶色泽较好,呈乳白色;但当pH>8时,凝胶强度、咀嚼性和黏度开始下降,形成的凝胶偏黄色,色泽较差,且有浓碱味,建议制取魔芋凝胶时pH控制在4~8之间。
[1] 庞杰,吴春华,温成荣,等.魔芋葡甘聚糖凝胶研究进展及其问题[J].中国食品学报,2011,11(9):181-187.
[2] 王元兰,魏玉.κ-卡拉胶与魔芋胶复配胶体系的流变特性[J].食品科学,2011,32(5):92-95.
[3] 许东颖,李仲华,林韶彬.魔芋葡甘聚糖复合凝胶的制备及其溶胀性能研究[J].日用化学工业,2012,42(4):282-284.
[4] Penroj P,Mitchall J R,Hill S E,et al.Effect of konjac glucomannan deacetylation on the properties of gels formed from mixtures of kappa carrageenan and konjac glucomannan[J].Carbohydr Polym,2005,59(3):367-376.
[5] 王元兰,黄寿恩,魏玉.κ-卡拉胶与魔芋胶复配胶的流变性能及其微观结构研究[J].中国食品学报,2012,12(7):49-54.
[6] 朱建华,杨晓泉.卡拉胶/大豆11S蛋白共混体系相容性及凝胶性质研究[J].中国粮油学报,2012,27(7):26-31.
[7] 刘芳,赵谋明,彭志英.卡拉胶与其它多糖类协同作用机理的研究进展[J].食品科学,2000,21(4):8-12.
[8] 王志辉,李春海.κ-卡拉胶凝胶特性的研究[J].江苏食品与发酵,2008(4):4-5.
[9] 齐海萍,吴强,胡文忠,等.添加剂对明胶-多糖共混凝胶特性的影响[J].食品科技,2011,36(8):240-244.
[10] 熊拯,郭兴凤,谈天.蛋白质-阴离子多糖相互作用研究进展[J].粮食与油脂,2006(10):15-17.
[11] 唐学燕,李博,顾小红.魔芋葡甘露聚糖对肌肉蛋白质性质的影响[J].食品与机械,2000(4):25-26.
[12] Huang H Y,Lin K W.Influence of pH and added gums on the properties of konjac flour gels[J].Int J Food Sci Technol,2004,39(10):1009-1016.
[13] 赵大庆,张斌,王家良.卡拉胶与魔芋粉复配生产果冻粉的研究[J].广东化工,2009,36(9):142-160.
[14] 杨玉玲,周光宏,姜攀,等.卡拉胶凝胶质构特性的研究[J].食品工业科技,2008,29(10):220-223.
[15] 韩亚兰.百合淀粉-胶复合物的质构特性及其应用研究[D].南昌:南昌大学,2007.
[16] 周湘池,卢可,娄永江.枇杷叶果冻的研制[J].宁波大学学报:理工版,2009,22(1):143-147.
[17] 杨永利,刘阿萍,王莱.魔芋胶的流变性研究[J].西北师范大学学报:自然科学版,2003,39(4):70-73.
[18] 杜学仲.影响大豆分离蛋白色泽的因素及解决方法[J].食品科技,2000(6):18-19.

