功能化离子液体化学修饰猪胰脂肪酶的催化性能
初旭明,贾 儒,杨 姣,黄 和,胡 燚,2
(1.南京工业大学生物与制药工程学院,南京211800;2.材料化学工程国家重点实验室,南京210009)
脂肪酶(lipase,EC 3.1.1.3)主要是指一类能够催化甘油三酯水解生成脂肪酸、甘油和甘油单酯或二酯的酶[1-2],广泛应用于水解或醇解、酯合成、酯交换、内酯合成、多肽合成、高聚物合成及立体异构体拆分等有机合成反应,是目前用途最广泛的酶催化剂之一[3]。猪胰脂肪酶(porcine pancreas lipase,PPL)是一类重要的脂肪酶,在食品、化妆品、医药、洗涤剂和畜牧业等领域中均有广泛应用[4]。然而,PPL的应用仍然存在一些不足,如一般具有实际应用价值的目标化合物并不是它的天然底物;PPL活力不高,在有机溶剂、高温、极端pH等非天然环境下极易失活等,这些不利因素限制了PPL在工业上进一步的广泛应用。因此,对PPL进行分子改性以强化其催化性能,为工业应用提供活性更高、稳定性更好、环境耐受性更强的新酶品种,具有重要的实际应用价值[5]。
化学修饰具有廉价、周期短、实验室可行、容易创造新型的酶学性质等优点,是对脂肪酶进行分子改性的一种重要手段[6-7]。虽然化学修饰 PPL已经取得了一定的研究进展,但仍然局限于脂肪酸、氨基酸、酸酐、聚乙二醇(PEG)和多糖等常用修饰剂的研究,修饰酶的催化活性、稳定性、耐有机溶剂性等性能往往不能同时得到有效的改善以满足反应的需要。
离子液体近年来在生物催化领域的应用越来越广泛,脂肪酶、蛋白酶、糖苷酶、醇氰酶、氧化还原酶等多种酶都在离子液体中显示出了很好的稳定性[8]。在离子液体中酶催化的区域、对映体选择性往往都有所增加,尤其作为高极性底物的酶催化反应介质,离子液体显示出了巨大的潜力[9]。笔者所在课题组将功能化离子液体作为酶固定化载体材料 SBA-15 的表面修饰剂[10-12],结果表明修饰载体固定化的酶对温度、pH等的稳定性得到了有效提升,而且相对活力较游离酶有了较大提高。在固定化方法中,离子液体作为载体修饰剂。近几年,Bekhonche 等[13-14]首次提出了离子液体修饰酶的新型化学修饰方法,用含羟基的咪唑、吡咯等离子液体修饰甲酸脱氢酶,修饰酶的活性和稳定性得到了显著提升。这些研究说明离子液体不仅可以作为反应介质用于酶催化反应中,还可以分别用作固定化载体及酶分子自身的修饰剂,目前还没有其他用功能化离子液体修饰脂肪酶的报道。本文以PPL为例,希望发展一种酶分子改造的新方法。
1 材料与方法
1.1 药品与试剂
PPL购自Sigma公司并在0~4℃下保存,酶的蛋白质含量为9.3%,以三乙酸甘油酯为底物时比酶活力为362 U/g(45℃、pH 7.5)。3种离子液体氯化1-羧甲基-3-甲基咪唑(99%)、氯化1-羧甲基-3-乙基咪唑 (99%)、氯化 1-羧甲基-3-丁基咪唑(99%)购自上海成捷化学有限公司。1-乙基-(3-二甲基氨基丙基)碳二亚胺(98%)、N-羟基琥珀酰亚胺(98%)、吗啉乙磺酸(97%)购自阿拉丁试剂公司。其余试剂购自国药集团化学试剂有限公司,均为分析纯。
1.2 离子液体的活化
取0.001 mol的离子液体,加入0.001 2 mol 1-乙基-(3-二甲基氨基丙基)碳二亚胺及0.111 5 mol N-羟基琥珀酰亚胺,在5 mL的吗啉乙磺酸溶液中,室温搅拌反应2 h后停止[5]。
1.3 活化的离子液体修饰PPL
取2 g PPL用去离子水溶解,向酶溶液中缓慢加入活化的离子液体,在0~4℃下,磁力搅拌6 h后,在去离子水中透析24 h备用。修饰度的测量通过三硝基苯磺酸法才测定[15]。
1.4 蛋白质含量测定
按照Bradford[16]的方法,以牛血清蛋白作为标准蛋白质绘制标准曲线。测定酶液的吸光值,根据标准曲线计算蛋白浓度。
1.5 酶活的测定
2)酶活测定 取10 mL上述制备的三乙酸甘油酯乳化液于100 mL锥形瓶中,再加入15 mL磷酸盐缓冲液(pH 7.5),于50℃、150 r/min下预热5 min,然后向其中加入酶开始反应。反应10 min后取出,立即加入15 mL乙醇终止反应。用0.025 mol/L的NaOH溶液滴定,记录NaOH的消耗量。在一定条件下,每分钟酶催化三乙酸甘油酯生成1 μmol乙酸所需要的酶量,定义为一个酶活单位(U)。
1.6 最适温度及最适pH的检测
1)最适温度 调节反应缓冲液pH为7.0,分别在30、35、40、45、50、55、60 和 65 ℃ 下水浴反应 10 min,取出测定酶活。
2)最适pH 调节反应液的pH分别为6.0、6.5、7.0、7.5 和8.0,50 ℃下水浴反应 10 min,取出测定酶活。
1.7 酶的热稳定性
将酶置于50℃水浴中保温,分别在0、0.5、1、2、4、6和8 h取出,冷却至室温,再测定酶活。酶活测定方法同1.5。设保温0 h时的游离酶的初始酶活为100%。
1.8 有机溶剂耐受性
在酶活测定的反应体系中,加入不同浓度的有机溶剂,测定修饰前后PPL在有机溶剂中的催化稳定性,设不含有机溶剂体系游离酶的初始酶活为100%。
1.9 紫外光谱测定
室温下,取相同浓度的 PPL、PPL-M、PPL-E和PPL-B在紫外可见分光光度计上分别测定其紫外可见吸收光谱,测定范围为240~340 nm。
2 结果与讨论
2.1 水解活力的考察
表1为经修饰后的酶与PPL的表观比酶活力的数据。
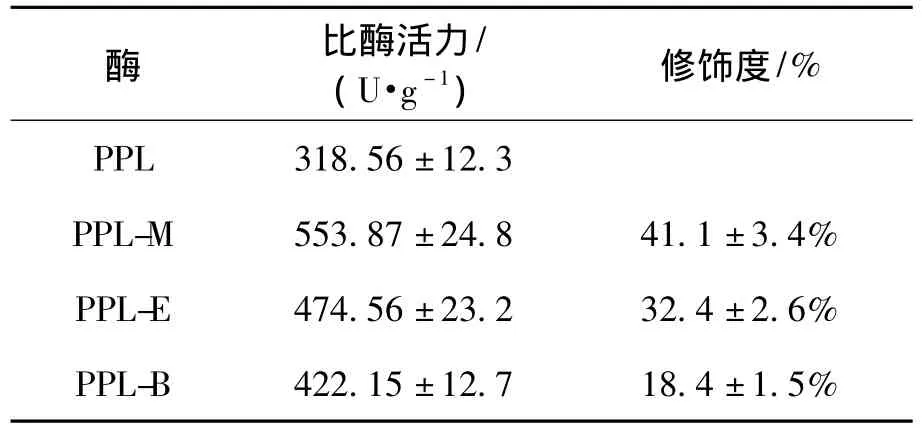
表1 酶的水解活力Table 1 Hydrolytic activity of enzymes
由表1可知:猪胰脂肪酶在经过修饰之后,活力有明显的提高,说明离子液体修饰脂肪酶的方法有利于水解活力的提高。其中离子液体修饰的酶,随着修饰度的增加活力增大,含短链的修饰有更好的水解活力,是游离酶的1.74倍,而邻苯二甲酸酐对PPL的修饰只提高了25%的水解活力[17]。随着修饰剂的链长的增大,活力呈降低的趋势。
在此格式中,就“吃亏/上当”的语法特点来说,有些名词化特点;就其意义说有些事物化,“吃亏/上当”不再表示一种动作,而表示一种抽象的事物。“但还不能因此说它们已经取得了名词的资格”(吕冀平,2003),前面的分析显示它们仍然大部分地保留着动词的语法特点,同时此格式还受其他语法成分的牵制,如“买不了”后所接名词多含褒义或中性的色彩。这是此方法所不能阐释清楚的。
2.2 最适温度的考察
根据经典酸碱滴定的方法,在不同温度下考察酶水解三乙酸甘油酯特性,结果见图1。由图1可知:原酶最适反应温度为45℃左右;经离子液体修饰后,PPL的最适温度向高温方向移动至55℃。与PPL相比,修饰后的PPL对温度的适应范围更广。经过修饰后的酶对在高温区相对游离酶更加趋于平缓,该点证明酶的离子液体修饰有助于提高温度的耐受性。
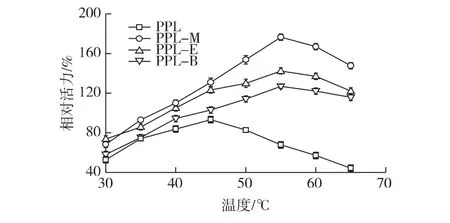
图1 温度对PPL活力的影响Fig.1 Effects of temperature on activity of PPL
2.3 最适pH的考察
在不同pH条件下考察猪胰脂肪酶的三乙酸甘油酯水解特性,结果如图2所示。由图2可知:修饰酶及游离酶的最适反应pH均为7.5,修饰的PPL在6.0~8.0之间对pH的敏感度明显降低,离子液体的修饰拓宽了酶的使用范围。
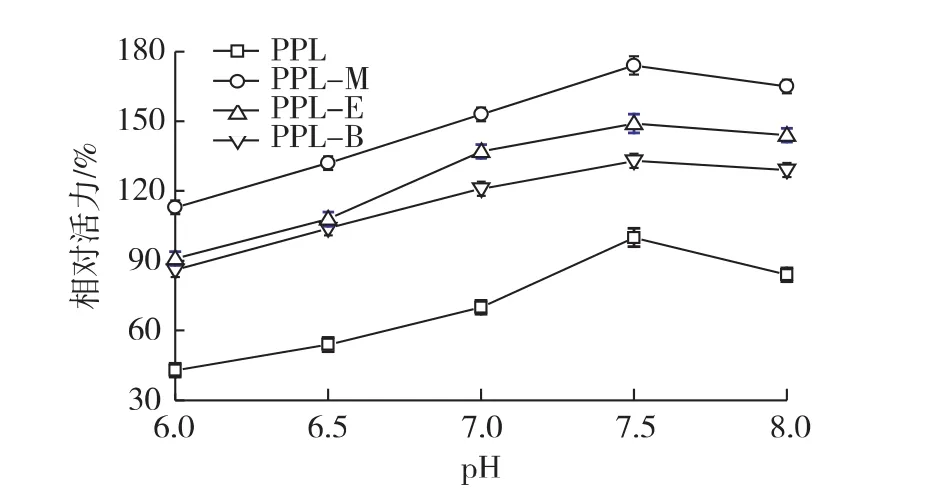
图2 pH对修饰酶酶活的影响Fig.2 Effects of pH on activity of modified lipases
2.4 热稳定性的考察
热稳定性是酶催化工业化应用的一个重要因素。图3为酶的热稳定性实验结果。由图3可知:游离酶的热稳定性较差,酶活下降快。在保温2 h后,酶活仅为初始酶活的20%。PPL-M、PPL-E及PPL-B的热稳定性均显著提高;在保温8 h后,残余酶活仍然保持在游离酶初始酶活的60%以上,尤其是长链的离子液体修饰的酶,酶活降低的更缓慢,热稳定性更好。
2.5 有机溶剂对酶活的影响
2.5.1 甲醇对酶活的影响
在pH 7.5、30℃不同甲醇体积分数的条件下,测定PPL、PPL-M、PPL-E及PPL-B的活力变化,结果见图4。
由图4可知:反应体系中加入不同体积分数的甲醇时,游离酶的相对活力一直在降低。而3种修饰酶的活力则是先升高,在高浓度的含甲醇体系中会下降,这可能是修饰后的酶在低浓度的甲醇中仍能维持构象稳定,而高浓度的甲醇会破坏部分氢键从而造成酶的解折叠。3种酶的变化趋势比较一致,且普遍高于PPL,3种修饰酶的活力大小顺序(从大到小)为 PPL-M、PPL-E、PPL-B,但 PPL-B 的活力在含低浓度的甲醇中增加幅度高于其他2种修饰酶,在含高浓度的甲醇中的活力降低程度要低于其余2种修饰酶。
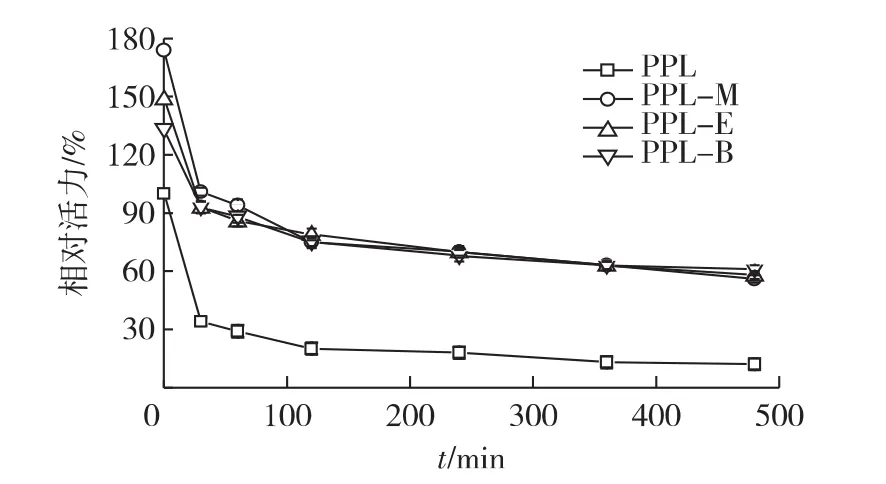
图3 修饰酶的热稳定性Fig.3 Thermal stability of modified lipases
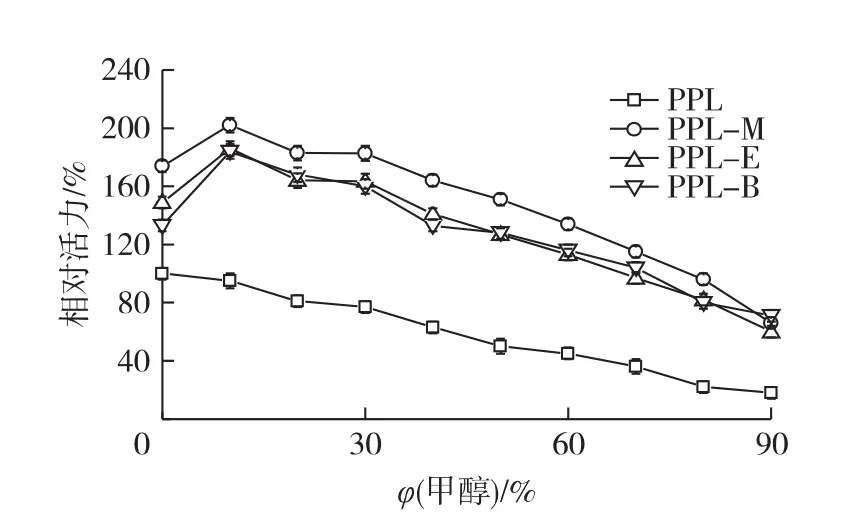
图4 甲醇对酶活的影响Fig.4 Effects of methanol on modified lipases
2.5.2 N,N-二甲基甲酰胺(DMF)对酶活的影响
在pH7.5、30℃不同DMF体积分数的条件下,测定PPL、PPL-M、PPL-E及PPL-B的活力变化,结果见图5。
由图5可知:在反应体系中加入不同体积分数的DMF时,游离酶的活力一直在降低,而修饰酶均保持了较高的活力,在反应体系中存在80%的DMF时,3种修饰酶的活力仍然保持游离酶100%的相对活力以上。3种修饰酶在不同浓度的DMF的反应体系中,酶活变化趋势一致,修饰酶的水解活性均高于原酶PPL。在含低浓度DMF中,PPL-M的酶活高于其他2种修饰酶,在DMF浓度不断增加中,PPL-B的活力受影响程度最弱,在70%以上的DMF体积分数中活力下降比例低于其他2种修饰酶,PPL修饰后的耐DMF的性能明显提高。
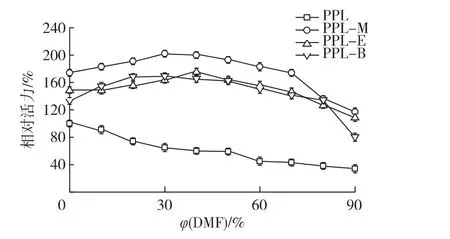
图5 DMF对酶活的影响Fig.5 Effects of DMF on modified lipases
2.6 紫外光谱表征
图6为脂肪酶PPL、PPL-M、PPL-E及PPL-B的紫外光谱变化图。
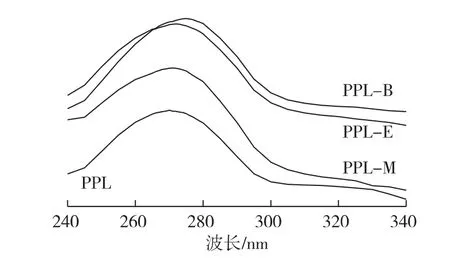
图6 酶的紫外吸收光谱Fig.6 UV spectra of lipases
由图6可知:PPL经离子液体修饰后,紫外吸收光谱峰型未发生明显变化,说明修饰后对PPL的空间结构没有造成明显的影响,但原270 nm处的吸收峰发生轻微红移,PPL-M、PPL-E及PPL-B的最大吸收波长值分别为271、272及275 nm,修饰酶的紫外吸光值均有所提高。
3 结论
以3种阴离子的咪唑类离子液体对PPL进行化学修饰,修饰后的PPL水解活力明显提升,修饰度越高,水解活力越高,且随着修饰剂的链长的增大,活力呈降低的趋势。与原酶相比,修饰酶的热稳定、有机溶剂中的催化性能等酶学性质都得到了提高。
[1] Hasan F,Shah A A,Hameed A.Industrial applications of microbial lipases[J].Enzyme Microb Technol,2006,39(2):235-251.
[2] Yang J K,Guo D Y,Yan Y J.Cloning expression and characterization of a novel thermal stable and short-chain alcohol tolerant lipase from Burkholderia cepacia strain G63[J].J Mol Catal B:Enzymatic,2007,45(3/4):91-96.
[3] 胡文静,谭天伟,王芳.改性壳聚糖固定化脂肪酶的研究[J].生物工程学报,2007,23(4):667-671.
[4] Mendes A A,Oliveira P C,de Castro H F.Properties and biotechnological applications of porcine pancreatic lipase[J].J Mol Catal B:Enzymatic,2012,78:119-134.
[5] Evran S,Telefoncu A.Modification of porcine pancreatic lipase with z-proline[J].Prep Biochem Biotechnol,2005,35(3):191-201.
[6] Díaz-Rodríguez A,Davis B G.Chemical modification in the creation of novel biocatalysts[J].Curr Opin Chem Biol,2011,15(2):211-219.
[7] Rodrigues R C,Murcia A B,Lafuente R F.Coupling Chemical modification and immobilization to improve the catalytic performance of enzymes[J].Adv Synth Catal,2011,353(13):2216-2238.
[8] Armand M,Endres F,MacFarlane D R,et al.Ionic-liquid materials for the electrochemical challenges of the future[J].Nature Material,2009,8(6):621-629.
[9] Zhang Q H,Zhang S G,Deng Y Q.Recent advances in ionic liquid catalysis[J].Green Chem,2011,13(10):2619-2637.
[10] Zou B,Hu Y,Yu D H,et al.Immobilization of porcine pancreatic lipase onto ionic liquid modified mesoporous silica SBA-15[J].Biochem Eng J,2010,539(1):150-153.
[11] Yang J,Hu Y,Jiang L,et al.Enhancing the catalytic properties of porcine pancreatic lipase by immobilization on SBA-15 modified by functionalized ionic liquid[J].Biochem Eng J,2013,70:46-54.
[12] Hu Y,Tang S S,Jiang L,et al.Immobilization of Burkholderia cepacia lipase on functionalized ionic liquids modified mesoporous silica SBA-15[J].Process Biochem,2012,47(12):2291-2299.
[13] Bekhouche M,Blum L J,Doumeche B.Ionic liquid-inspired cations covalently bound to formate dehydrogenase improve its stability and activity in ionic liquids[J].ChemCatChem,2011,3(5):875-882.
[14] Bekhouche M,Doumeche B,Blum L J.Chemical modification of stem bromelain with anhydride groups to enhance its stability and catalytic activity[J].J Mol Catal B:Enzymatic,2010,65(3/4):73-78.
[15] Xue Y,Wu C Y,White C J B,et al.Chemical modification of stem bromelain with anhydride groups to enhance its stability and catalytic activity[J].J Mol Catal B:Enzymatic,2010,63(3/4):188-193.
[16] Bradford M.A rapid and sensitive method for the detection of microgram quantities of proteins[J].Anal Biochem,1976,72:248-254.
[17] 熊亚红,苏健鸿,刘小平.邻苯二甲酸酐修饰脂肪酶的性能研究[J].华南农业大学学报,2011,32(2):122-124.

