丹桔合剂的质量控制
庞鹏,李文
南京市中医院,南京 210001
丹桔合剂的质量控制
庞鹏,李文*
南京市中医院,南京 210001
目的:建立丹桔合剂的质量控制指标。方法:采用薄层色谱法对制剂中丹参、陈皮进行定性鉴别;采用高效液相色谱法对制剂中丹酚酸B、橙皮苷进行含量测定。结果:薄层色谱斑点清晰,阴性无干扰;含量测定丹酚酸B和橙皮苷分别在进样量0.19~3.01 μg、0.16~2.51 μg的范围内呈良好的线性关系;丹酚酸B和橙皮苷的加样回收率分别为98.28%和97.91%。结论:本方法简便、专属性强,可作为该制剂的质量控制指标。
丹桔合剂;薄层色谱法;高效液相色谱法;丹酚酸B;橙皮苷
丹桔合剂为临床使用多年的经验方,由丹参、山楂、何首乌、决明子、陈皮等5味药材组成。其具有滋补肝肾、活血化瘀、化痰祛浊的功效;主治眩晕、肢麻等中风先兆症状。本实验采用薄层色谱法对制剂中的丹参、陈皮等进行定性鉴别;用高效液相色谱法对制剂中丹参与陈皮的有效成分丹酚酸B和橙皮苷进行含量测定。在此基础上建立丹桔合剂的质量控制方法,似可作为质量评价主要手段之一[1]。
1 仪器与试药
Waters高效液相色谱仪(UV/Visible Detector 2489;Seperations Module e2695);Sartorius电子天平(型号:BT25S);
丹酚酸B对照品(批号:111562-201111),橙皮苷对照品(批号:110721-201115)均由中国药品生物制品检定所提供;丹桔合剂(自制,每毫升合剂含0.8 g生药,批号:20121218、20121219、20121220);乙腈为色谱纯;其余试剂为分析纯。
2 性状及制备
2.1 性状及制备
棕色液体,嗅之有淡淡的中药香。
取处方药味,加水,先浸润,再加热煎煮多次;合并水煎液,滤过,分装入瓶,封口,灭菌,冷却后贴标签,即得。
2.2 鉴别
2.2.1 丹参取丹桔合剂3 mL于10 mL带盖离心管中,加入甲醇6 mL,振摇混合均匀,超声提取15 min后,以4500 r·min-1离心10 min,上清液即可作为供试品溶液。取除丹参外的4味药材各40 g,按合剂制备法制得丹参的阴性合剂,再按供试品溶液的制备方法制备阴性溶液。另取丹参对照药材0.2 g,加75%甲醇25 mL,加热回流1 h,滤过,滤液浓缩至1 mL,作为丹参对照药材溶液。再取丹酚酸B对照品,加75%甲醇制成每毫升含2 mg的溶液,作为对照品溶液。照2010版《中国药典》丹参药材项下鉴别方法进行检测。供试品色谱中,在与对照药材和对照品色谱相应的位置上,显相同颜色的荧光斑点,阴性对照无干扰[2]。
2.2.2 陈皮取丹桔合剂3 mL于10 mL带盖离心管中,加入甲醇6 mL,振摇混合均匀,超声提取15 min后,以5000 r·min-1离心10 min,上清液即可作为供试品溶液。取除陈皮外的4味药材各40 g,按合剂制备法制得陈皮的阴性合剂,再按供试品溶液的制备方法制备阴性溶液。另取陈皮对照药材0.3 g,加甲醇10 mL,加热回流20 min,滤过,取滤液5 mL,浓缩至1 mL,作为陈皮对照药材溶液。再取橙皮苷对照品,加甲醇制成饱和溶液,作为对照品溶液。照2010版《中国药典》陈皮药材项下鉴别方法进行检测。供试品色谱中,在与对照药材和对照品色谱相应的位置上,显相同颜色的荧光斑点,阴性对照无干扰[3]。
2.3 检查
按《中国药典》2010年版一部附录ⅠJ合剂项下有关规定检查,对本品的密度、pH值、装量、微生物限度等进行了检查和测定,均符合规定。
2.4 含量测定
2.4.1 色谱条件以十八烷基硅烷键合硅胶为填充剂;流动相梯度洗脱如表1;检测波长:284 nm;柱温:30℃;流速:1.0 mL·min-1;进样量:10 μL。理论板数按丹酚酸B峰计算不低于2000。
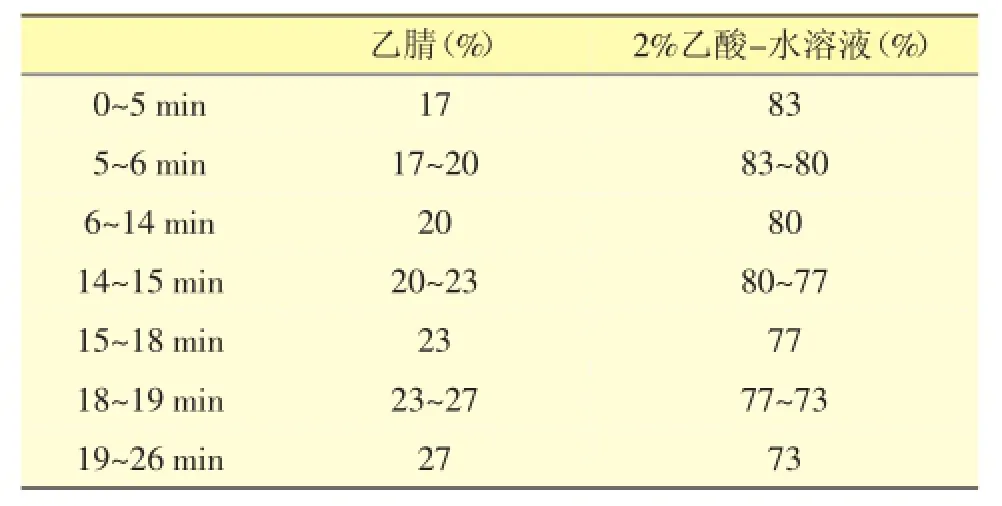
表1 流动相梯度洗脱程序
2.4.2 溶液的制备
对照品溶液的制备:精密称取丹酚酸B对照品6.01 mg,置于10 mL量瓶中,用50%甲醇充分溶解并定容至刻度,摇匀,即得丹酚酸B对照品储备液。精密称取橙皮苷对照品5.02 mg,置于10 mL量瓶中,用甲醇充分溶解并定容至刻度,精密量取5 mL,置于10 mL量瓶中,加50%甲醇稀释至刻度,摇匀,即得橙皮苷对照品储备液。
供试品溶液的制备:精密量取丹桔合剂0.5 mL,加入水4.5 mL,再加入甲醇5 mL,超声处理15 min,使充分混合均匀;以5000 r·min-1离心15 min。上清液即可作为供试品溶液。
2.4.3 专属性试验取本合剂缺丹参、陈皮的阴性制剂,按供试品溶液制备方法制得丹参、陈皮阴性样品,按上述色谱条件进样,测定,结果表明,阴性制剂无干扰。见图1。
2.4.4 线性关系考察精密吸取0.601 mg·mL-1的丹酚酸B对照品储备液0.31、0.62、1.25、2.5、5 mL分别用50%甲醇定容至10 mL的量瓶中,摇匀,分别得到浓度为0.301、0.150、0.075、0.038、0.019 mg· mL-1的丹酚酸B系列对照品溶液,按上述色谱条件进样,测定峰面积,以峰面积积分值(A)对浓度(C)进行线性回归,得回归方程Y=1.0×107X+68826。
精密吸取0.502 mg·mL-1的橙皮苷对照品储备液0.31、0.62、1.25、2.5、5 mL用甲醇定容至10 mL的量瓶中,摇匀,即得0.251 mg·mL-1的橙皮苷对照品溶液;依次稀释,分别得到浓度为0.251、0.126、0.063、0.031、0.016 mg·mL-1的橙皮苷系列对照品溶液,按上述色谱条件进样,测定峰面积,以峰面积积分值(A)对浓度(C)进行线性回归,得回归方程Y= 9.0×106X-11406。
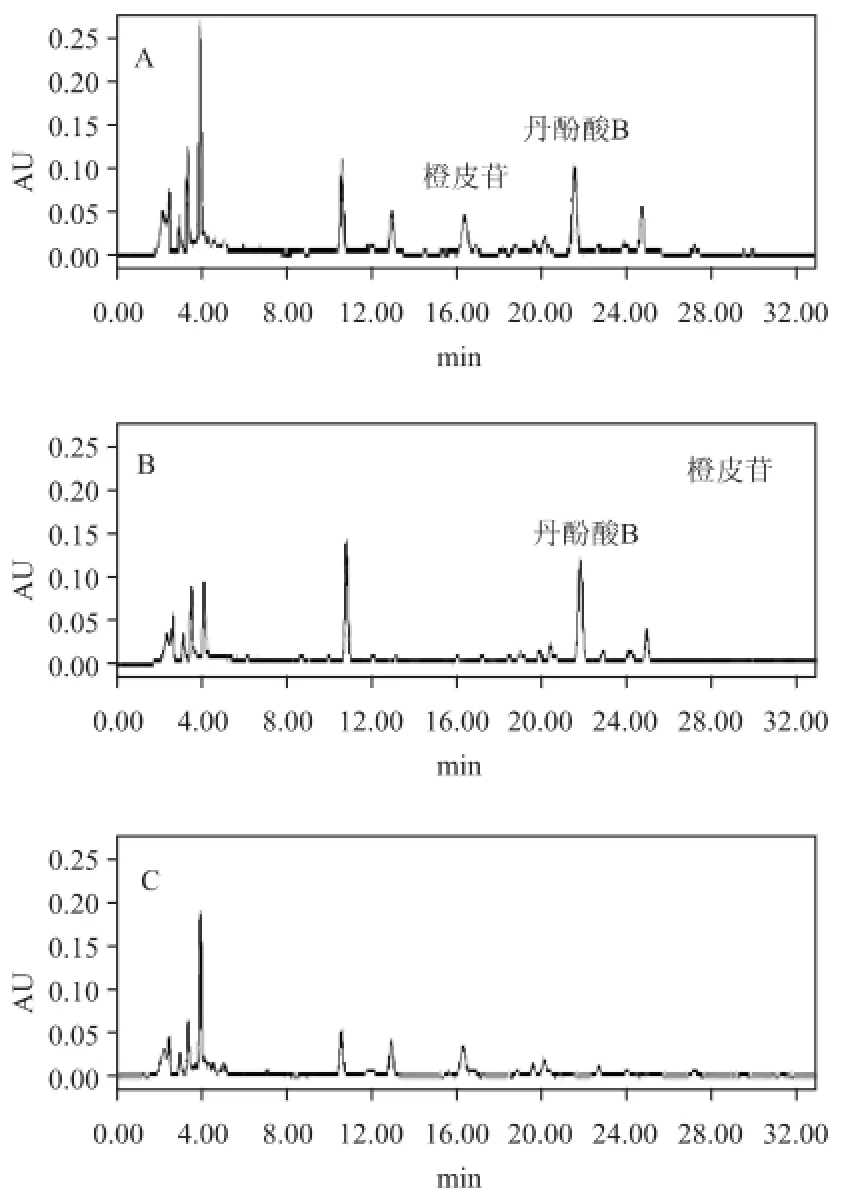
图1 样品色谱图
2.4.5 精密度试验精密吸取配制好的丹酚酸B对照品溶液,在上述色谱条件下,连续进样6针,测定峰面积,计算得丹酚酸B的相对标准偏差(RSD)为0.06%(<3%),结果表明,在该条件下仪器精密度良好。
精密吸取配制好的橙皮苷对照品溶液,在上述色谱条件下,连续进样6针,测定峰面积,计算得RSD为0.35%(<3%),结果表明,在该条件下仪器精密度良好。
2.4.6 重复性试验平行制备供试品液5份,吸取制备好的供试品溶液,进样,测定丹酚酸B、橙皮苷峰面积,计算得丹酚酸B的RSD=2.7%(<3%),橙皮苷的RSD=1.9%(<3%),结果表明此测定方法重复性良好。
2.4.7 稳定性试验吸取制备好的供试品溶液,分别于0、2、4、6、12、18、24 h进样,测定丹酚酸B、橙皮苷峰面积,计算得丹酚酸B的RSD=0.28%(<3%),橙皮苷的RSD=0.39%(<3%),结果表明,在该条件下样品溶液在24 h内稳定。
2.4.8 加样回收率试验精密量取已知丹酚酸B、橙皮苷含量的同一批合剂共6份,再精密加入等量的丹酚酸B、橙皮苷对照品,测定丹酚酸B、橙皮苷峰面积,计算丹酚酸B、橙皮苷的含量,按下式计算回收率(应为95%~105%)和平均回收率,结果见表2。表明此测定方法回收率良好。
回收率=(测得量-已知样品量)/加入的标准品量
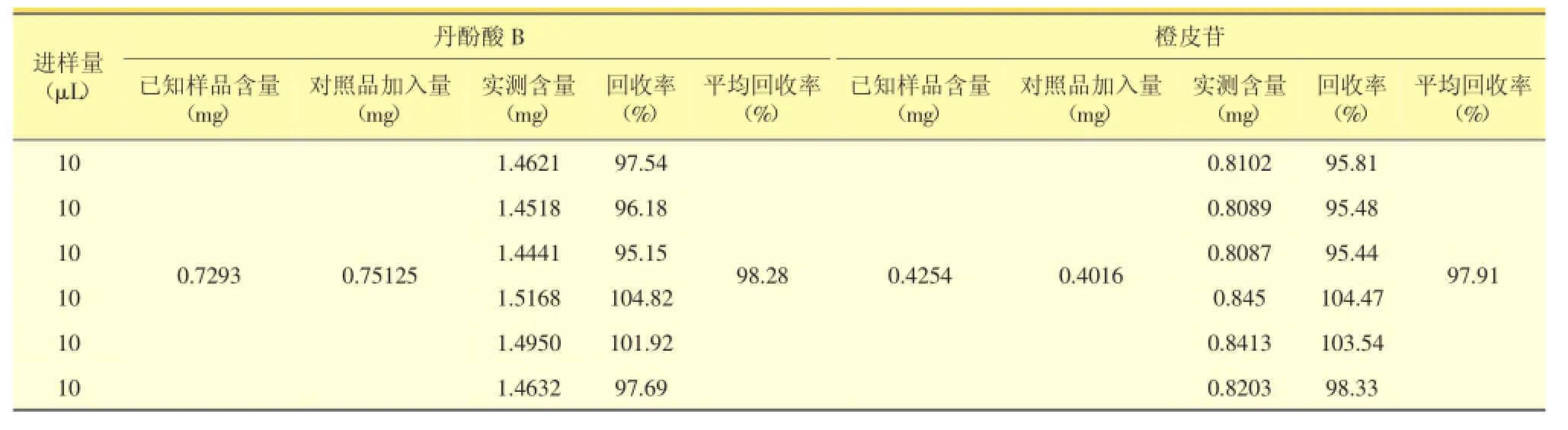
表2 丹酚酸B、橙皮苷加样回收试验结果
2.4.9 样品含量测定以建立的方法对3批样品进行含量测定。结果见表3。
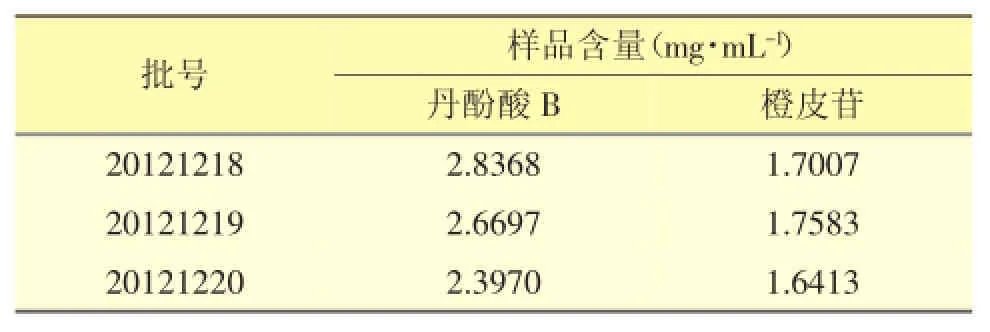
表3 样品含量测定结果
3 讨论
梯度洗脱的选择:按2010版《中国药典》药材项下“含量测定”方法检测。丹酚酸B的流动相为甲醇-乙腈-甲酸-水(30∶10∶1∶59),检测波长为286 nm;橙皮苷的流动相为甲醇-醋酸-水(35∶4∶61),检测波长为283 nm。故本实验确定检测波长为284 nm,根据药典的流动相比例及目标峰的出峰时间,可初判橙皮苷的极性大于丹酚酸B的极性。由图1可知橙皮苷的出峰时间为16 min左右,丹酚酸B的出峰时间为22 min左右,前15 min的峰非目标峰,故选用相对大极性的流动相比例,以节省时间,目标峰的出峰时间分别采用平缓的梯度23%、27%的乙腈。选用上述梯度洗脱条件可以大大节省时间,样品的出峰时间控制35 min内,并且峰型清晰,无拖尾现象。故最终确定“2.4.1”的色谱条件。
[1] 赵颖,谈瑄忠,毛春芹,等.益坤宁颗粒的质量控制[J].中国医院药学杂志,2009,29(14):1234-6.
[2] 刘丰贤.丹参调肝颗粒的薄层色谱法鉴定[J].湖南师范大学学报,2012,9(1):84-6.
[3] 宋锦锋,李娟.升清胶囊定性定量方法研究[J].中南药学,2012,10(3):192-5.
Quality Standard of Danju Mixture
PANG Peng,LI Wen
Nanjing Hospital of TCM,Nanjing 210001
Objective:To study and formulate the quality control index of Danju mixture.Methods:Qualitative analysis of Salvia Miltiorrhiza and Tangerine Peel in Danju mixture was made with thin-layer chromatography(TLC).And salvianolic acid and aurantiamarin in the Danju mixture were quantified with high performance liquid chromatography(HPLC).Results:The TLC spots were clear and no interference was found in the negative control.The good linear ranges of calibration curves for salvianolic acid and aurantiamarin were 0.19~0.75 μg and 0.16~0.13 μg,respectively,and the recovery rates were 98.28%and 97.91%,respectively.Conclusion:The process is convenient,specific and exact,and can be used as the basis of quality control for Danju mixture.
Danju mixture;TLC;HPLC;Salvianolic acid;Aurantiamarin
R927.11
A
1673-7806(2014)02-118-03
庞鹏,女,主管中药师,主要研究方向:药检及临床药学 E-mail:njqly@163.com
*通讯作者 李文,女,主任中药师,主要研究方向:中药制剂及检验 E-mail:njzyyliwen@sohu.com
2013-10-21
2014-01-06

