全骨髓贴壁法获取组织工程髓核种子细胞的相关研究*
康健侯洋周许辉杨立利陈华江唐先业袁文*
论著·实验研究
全骨髓贴壁法获取组织工程髓核种子细胞的相关研究*
康健1,2侯洋1周许辉1杨立利1陈华江1唐先业1袁文1*
目的明确兔骨髓间充质干细胞的分化能力及分化条件,以TGF-3和BMP-7诱导兔骨髓间充质干细胞向类髓核细胞分化,为组织工程髓核的构建提供良好的种子细胞。方法利用全骨髓贴壁法分离获取兔骨髓间充质干细胞,并对细胞进行培养和传代,以特定的环境及细胞诱导液进行诱导,促使其向特定的中胚层细胞分化。再将细胞分为四组,A:空白对照组,B:BMP-7诱导组,C:TGF-3诱导组,D:TGF-3与BMP-7共同诱导组,诱导21天后对蛋白聚糖、Ⅰ型胶原、Ⅱ型胶原、Ⅹ型胶原和SOX9基因进行realtime-PCR检测。结果全骨髓贴壁法分离获得的原代兔骨髓间充质干细胞生长良好,2周后显微镜下观察细胞间形态较为一致,成纺锤形。细胞传代后生长良好。细胞表面表达CD29、CD105、CD166表面标记物。在成骨诱导培养液、成软骨诱导培养液和脂肪诱导培养液的诱导下,培养21天后,通过特定染色发现兔骨髓间充质干细胞向预定方向分化生长。以TGF-3和BMP-7生长因子诱导21天后,蛋白聚糖、Ⅱ型胶原和SOX9基因表达C组和D组明显高于A组和B组(P<0.05),X型胶原表达A组和B组明显高于C组和D组(P<0.05),Ⅰ型胶原表达四组之间无明显差异。结论全骨髓贴壁法可以成功分离获得状态良好的兔骨髓间充质干细胞,在成骨诱导培养液、成软骨诱导培养液和脂肪诱导培养液的诱导下,兔骨髓间充质干细胞可向预定的方向分化且生长良好。TGF-3和BMP-7诱导兔骨髓间充质干细胞后可明显提高其类髓核细胞具有的下游基因表达水平。
兔骨髓间充质干细胞;全骨髓贴壁法;诱导分化;转化生长因子 3;骨形态发生蛋白7
间充质干细胞(mesenchymal stem cells,MSCs)是来源于中胚层的未分化的发育早期细胞,具有较强的增殖能力和多向分化能力。在特定的内环境和一定的细胞因子的诱导作用下,其可定向分化为多种组织细胞,如成骨细胞、软骨细胞、脂肪细胞、心肌细胞、肝细胞、神经细胞、成纤维细胞等[1,2],正是由于其所具有的特性,使其成为了组织工程学中最常用的种子细胞。
由于骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)具有取材方便、体外培养简单、繁殖能力强、供体创伤小、不涉及伦理问题、良好的组织相容性、及其低抗原性所表现出的低免疫反应性等优点[3,4],使其成为了组织工程中经常使用的间充质干细胞。国内外均有使用一定的细胞因子诱导BMSCs增殖和分化为类软骨细胞及类髓核细胞的相关报道[5-8]。本实验抽取新西兰兔的骨髓细胞,利用全骨髓贴壁法分离间充质干细胞,经过传代培养后再通过中胚层定向诱导分化的方法对所获取的细胞进行鉴定,确定其定向分化能力,再以转化生长因子 3(Transforming Growth Factor-3, TGF-)和骨形态发生蛋白7(Bone Morphogenetic Protein-7, BMP-7)生长因子诱导其向类髓核细胞分化,为组织工程髓核的构建提供良好的种子细胞选择。
1 材料和方法
1.1 材料与试剂
DMEM-LG培养基(Gibcol)、胎牛血清(Gibcol)、DMEMHG培养基(Gibcol)、成骨诱导培养基(地塞米松10-9M,抗坏血酸钠0.2mM,-甘油磷酸钠10mM,5%FBS,DMEM-LG培养基,1%双抗溶液)、成软骨诱导培养基(地塞米松10-7M,抗坏血酸钠0.2mM,丙酮酸钠1mM,转化生长因子-110ng/ml,ITS+LA,DMEM-HG培养基,2%FBS,1%双抗溶液)、成脂肪诱导培养基(地塞米松 10-7M,吲哚美辛 0.05mM,IBMX 0.5mM,2%FBS,DMEM-HG培养基,1%双抗溶液)、茜素红S(Roche)、羊抗牛Ⅱ型胶原多克隆抗体(Southern Biotechnology)、番红O(Sigma)、油红O(Sigma)、TGF-3(sigma)、BMP-7(sigma),CD29、CD105、CD166均购自eBioScience。
新西兰兔购自上海生旺实验动物养殖有限公司。
1.2 兔BMSCs的分离培养
取2月龄的新西兰大白兔,雌雄不限,戊巴比妥溶液腹腔麻醉后,常规备皮,消毒,严格无菌操作,以骨髓穿刺针接10ml注射器(注射器内含稀释的肝素钠3000U/0.2ml)自胫骨近端内侧处行骨髓穿刺术,抽取骨髓液3ml,缓慢注入预置4ml淋巴细胞分层液的离心管内,进行密度梯度离心。2000rpm离心20分钟后,吸取中间的单个核细胞层,弃去上清和脂肪,PBS(Phosphate Buffered Saline,磷酸盐缓冲液)缓冲液冲洗2次,再以1.6×104/cm2的浓度接种于100mm培养皿内,加入15ml Ham’s F12培养液(含青霉素钠100U/ml,链霉素100 g/ml,两性霉素B0.25 g/ml),加入胎牛血清终浓度为10%,置37℃、5%CO2、饱和湿度的条件下培养,于48小时后换液,以PBS冲洗3遍,去除全部非贴壁细胞,换上新鲜培养基,同样环境中继续培养。以后每3日换液一次,待原代培养细胞爬满培养瓶底时,即可进行传代。用0.25%的胰蛋白酶消化5分钟后,即可得兔原代骨髓间充质干细胞悬液。
1.3 兔BMSCs表面抗原的鉴定
取生长汇合约90%的第3代细胞,小心吸去培养液,加入3ml0.25%胰蛋白酶/EDTA消化液,于37℃消化约3分钟,加入含10%FBS的DMEM培养液1ml中止消化,PBS冲洗两次,以1000rpm离心5分钟,弃去上清,加入新鲜培养液制备成细胞悬液,并调整细胞浓度为1×106/ml,取100 l细胞悬液置于流式管中,按照试剂说明加入抗体,充分混匀后室温避光放置30分钟,加入流式细胞仪缓冲液1ml混匀后1000rpm离心5分钟,弃去上清,再加入0.5ml流式细胞仪缓冲液重悬细胞后,以流式细胞仪进行检测。
1.4 兔BMSCs的诱导分化
1.4.1 向成骨细胞方向诱导分化
取基本铺满瓶底的第3代细胞,胰蛋白酶消化后以2×104/ cm2的密度接种于24孔板中,加入成骨诱导培养液,每3天换液一次,培养14天后行茜素红S染色。
1.4.2 向成软骨细胞方向诱导分化
取基本铺满瓶底的第3代细胞,胰蛋白酶消化后洗涤,以2×106/ml加入15ml离心管中以500rpm离心5分钟,获得细胞团块后置入成软骨诱导培养基中悬浮培养,每3天换液1次,培养14天后行Ⅱ型胶原染色和番红O染色。
1.4.3 向脂肪细胞方向诱导分化
取第3代细胞,胰蛋白酶消化后以2×104/cm2的密度接种于24孔板中,加入成脂肪诱导培养液,每3天换液一次,培养14天后行油红O染色。
1.5 BMSCs的诱导分化
根据不同的诱导条件,将获得的BMSCs分为四组:A空白对照组;B200ng/mLBMP-7单独诱导组;C15ng/mlTGF-3单独诱导组;D TGF-3和BMP-7联合诱导组。将四组细胞在37°C、5%CO2孵育箱中培养24小时后更换新鲜培养液,此后每2天换液1次,连续培养21天后收集细胞,用Trizol试剂消化裂解,提取细胞中的mRNA。再用First Strand cDNA Synthesis Kit将提取的mRNA逆转录为cDNA。以cDNA为模板,进行Realtime PCR检测蛋白聚糖、Ⅰ型胶原、Ⅱ型胶原、Ⅹ型胶原和SOX9基因的表达水平。
1.6 统计学处理
采用SPSS13.0统计软件对所得数据进行统计学分析。先行组间的单因素方差分析(ANOVA),再以Bonferroni法行两两之间的多重比较,P<0.05为有统计学意义。
2 结果
2.1 兔BMSCs培养结果
在光学显微镜下,原代细胞接种后,细胞多呈现圆球形,大小不均一,呈散在分布,悬浮于培养液中,培养8~10小时后即可见有体积较大单核细胞逐渐沉降贴壁(图1-A),48小时后,少量细胞已经贴壁,形态呈圆形或多角形,贴壁的细胞大小不等,形态不一,培养4天后大部分细胞呈梭形,部分细胞处于分裂期,细胞数量较开始时明显增多(图1-B)。大约2周细胞已基本融合,细胞之间相互重叠,细胞排列紧密,细胞大小、形态较为均一。传代细胞在培养瓶中均匀分布后呈贴壁生长,细胞间形态较为一致,呈纺锤形外观(图1-C,图1-D)。(图1彩图见插页)
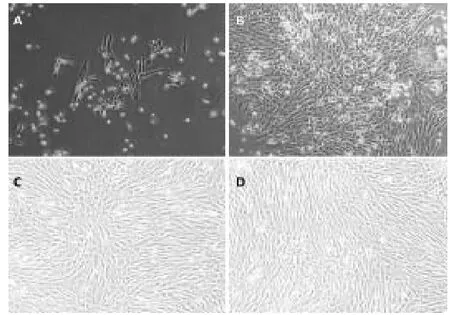
图1 光学显微镜下兔骨髓间充质干细胞的形态(×10)
2.2 兔BMSCs表面抗原鉴定结果
采用流式细胞计数对第3代细胞进行检测,结果显示细胞均一性可达90%以上,表面标记物检测结果如下图(图2)。由结果可知,分离所得的细胞表面可以稳定表达 CD29、CD105和CD166三种骨髓间充质干细胞最为特异性的表面标记物,其中CD29表达率为(71.4±3.3)%,CD105表达率为(49.3±2.1)%,CD166表达率为(88.7±2.7)%。因此可以说明,前期工作中分离培养所获得的细胞即为骨髓间充质干细胞。
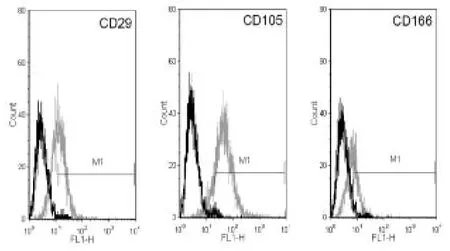
图2 所得细胞流式细胞术检测表面标记物结果
2.3 兔BMSCs中胚层诱导分化结果
2.3.1 兔BMSCs向成骨细胞诱导分化结果
在成骨诱导培养液的诱导分化下,细胞形态在8天左右发生不规则改变,呈长梭形、多角形,部分细胞呈卵圆形。诱导14天时卵圆形细胞明显增多,融合紧密。于诱导14天时对细胞行茜素红S染色显示:细胞外基质中有明显的钙结节形成。由此可以说明,分离培养的细胞在成骨诱导培养液作用下可向成骨细胞方向分化。(图3,彩图见插页)
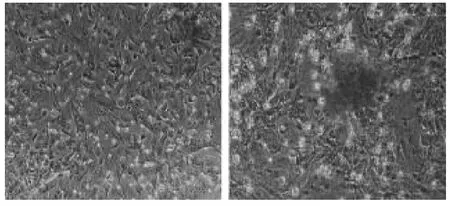
图3 兔BMSCs成骨诱导分化茜素红染色
2.3.2 兔BMSCs想成软骨细胞诱导分化结果
在成软骨细胞培养液的诱导分化条件下,诱导培养早期悬液中的细胞团块体积呈不规则型,体积有较为的明显增大,诱导培养后期细胞团体积无明显变化,细胞团逐渐变得更加致密,形状较早期趋于规则。诱导21天时PBS洗涤细胞团,4%多聚甲醛固定,乙醇梯度脱水后石蜡包埋切片,以免疫组织化学方法行II型胶原染色,可见较多量的胞浆中存在黄色颗粒的细胞存在,行番红O染色可见细胞外基质中存在大量红染的硫酸软骨素成分,因此可以说明,分离所得到的细胞在成软骨培养液诱导环境下可以转化为大量表达 II型胶原的细胞,认为其能够在特定条件下向成软骨细胞转化。(图4,彩图见插页)
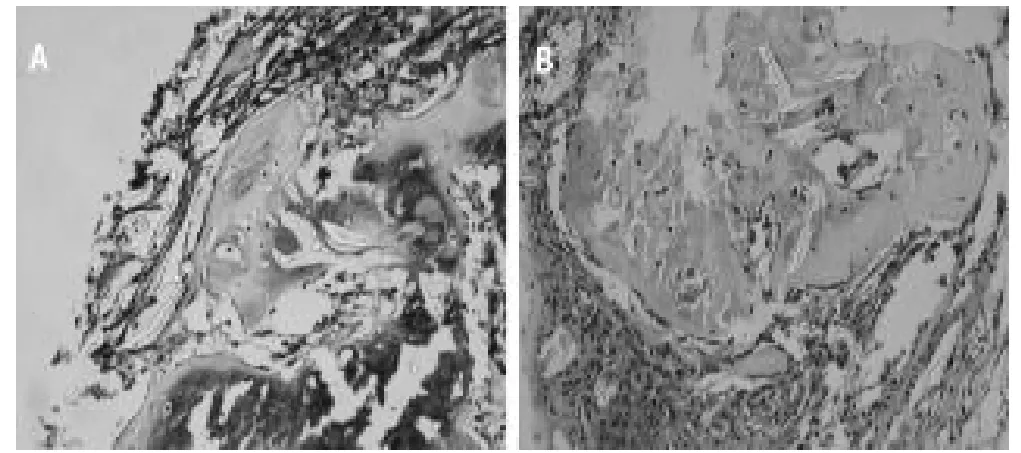
图4 兔BMSCs成软骨诱导分化染色。A:Ⅱ型胶原染色;B:番红O染色
2.3.3 兔BMSCs向脂肪细胞诱导分化结果
在成脂肪细胞培养液的诱导分化条件下,诱导2天后部分细胞形态开始发生变化,在少数细胞中可见折光性强的脂滴出现,随着培养时间的延长,细胞中脂滴逐渐增大,含脂滴的细胞数量也逐渐增多。诱导14天后对细胞行油红O染色,结果显示大多数细胞胞质中都有大小不等的被染成红色的脂滴形成。因此可认为,在成脂肪细胞培养液诱导分化的条件下,分离所得的细胞可向脂肪细胞方向转化。(图5,彩图见插页)
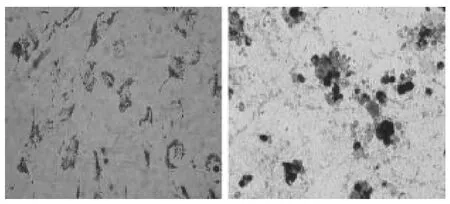
图5 兔BMSCs脂肪诱导分化油红O染色
2.4 BMSCs诱导分化下游基因Realtime PCR检测结果
将四组细胞培养21天后,C组和D组的蛋白聚糖、Ⅱ型胶原和SOX9基因的表达水平明显高于A组和B组(P<0.05),C组和D组之间上述三种下游基因表达差异没有统计学意义(P>0.05),Ⅹ型胶原基因的表达则是A组和B组明显高于C组和D组(P<0.05),而Ⅰ型胶原表达四组之间没有明显的差异(P>0.05)。结果见表1,图6。
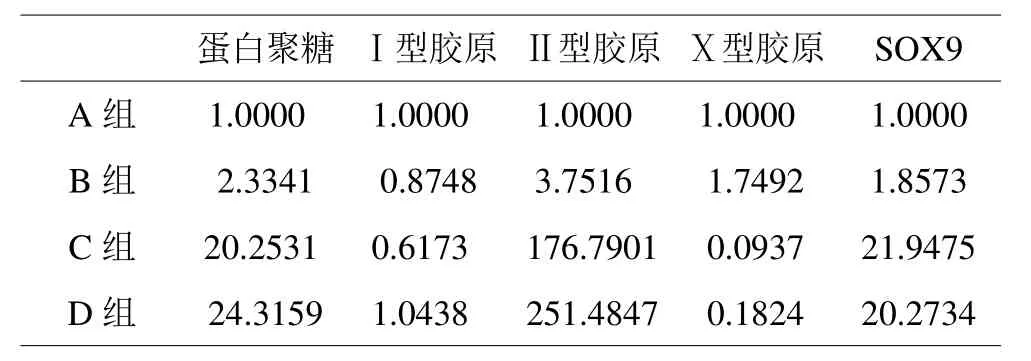
表1 BMSCs诱导分化下游基因Realtime PCR检测结果
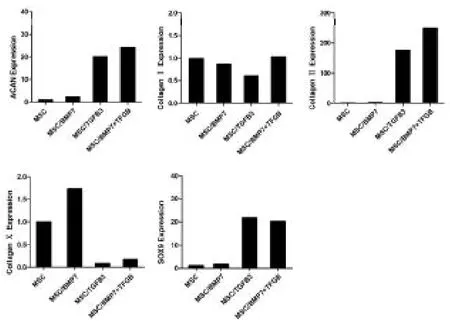
图6 BMSCs诱导分化下游基因Realtime PCR检测结果
3 讨论
组织工程中种子细胞的选取非常重要。种子细胞选取的主要原则是:取材方便,来源广,取材时对机体损伤小;体外培养容易,增殖能力强;细胞特定表达稳定或定向分化能力强,诱导分化可控性高;免疫原性低,植入机体内不产生或产生较低的免疫排斥反应;种子细胞与支架粘附性好,能够在支架中正常生长及分化。
在组织工程髓核构建中,常用的种子细胞主要分为椎间盘来源的细胞核椎间盘外来源的细胞。椎间盘来源的细胞主要包括:髓核细胞(nucleus pulposus cells,NPCs)、纤维环细胞(annulus fibrosus cells,AFCs)、脊索源性细胞(notochodal cells,NCs)等,由于这些种子细胞取材造成创伤较大,体外培养存在增殖较慢、表型不稳定及纯化、定向分化控制难度高等问题[9,11],使其在组织工程髓核构建研究中作为种子细胞的困难大大增加。
椎间盘外来源的细胞主要有软骨细胞和多种干细胞,如骨髓间充质干细胞(BMSCs)、脂肪干细胞(Adipose-drived stem cells,ADSCs)、胚胎干细胞(embryonic stem cells,ESCs)、人脐带间充质干细胞(human umbilical cordmesenchymal stem cells,HUCMSCs)等。软骨细胞在体外单层培养中容易出现去分化现象,因此其作为组织工程髓核种子细胞的可行性还需进一步研究证明。胚胎干细胞和人脐带间充质干细胞获取较为困难,且存在复杂的伦理问题。而脂肪干细胞在体外诱导培养过程中在细胞增殖、定向分化及Ⅱ型胶原和蛋白聚糖等相关蛋白表达上都差于骨髓间充质干细胞[12]。
BMSCs主要来源于中胚层[13],是存在于骨髓中的非造血干细胞,其在骨髓中的含量一般为0.001%~0.01%[14],相对略高于其他干细胞。虽然 BMSCs作为组织工程的种子细胞需要量较大,但其体外培养增殖能力强,并可以多向成骨细胞、软骨细胞、脂肪细胞、成纤维细胞等多种组织细胞分化[1,2],甚至有研究认为,其具有分化成非间充质起源的组织的能力[15]。因此BMSCs是一种理想的组织工程细胞。
BMSCs作为作为种子细胞,相对于其他细胞来说,具有以下的一些优势:⑴来源广泛,BMSCs虽然随着机体的衰老而不断减少,但是存在的BMSCs仍能保持良好增殖能力及分化能力,研究显示老年人的BMSCs增殖和分化能力与新生儿和成年人并无明显差异[16]。获取方便,操作过程对供体创伤小,常规骨髓穿刺操作获取的BMSCs约有20%处于静止期,足够传代培养所需的细胞数量[17,18]。⑵体外培养传代容易,培养周期短,增殖扩增能力强大,可通过多种分离方法进行分离培养,在经过2~4天潜伏期后开始快速扩增,可稳定的传至20~25代而基本不改变细胞性状,三代培养后基本可达成人体细胞数量[19]。⑶BMSCs为低免疫原性细胞,并不表达B7-1、B7-2、CD40等共刺激分子,不会激活T淋巴细胞,从而避免细胞毒性T细胞和NK细胞的杀伤作用[20]。⑷BMSCs对于支架的粘附性好。种子细胞与支架的粘附能力对种子细胞增殖和分化能力有着重要的影响。BMSCs能够和多种支架材料较好的粘附,给种子细胞生长提供了足够的空间,使细胞因子更好的分布于种子细胞周围,种子细胞表达更加稳定,更利于细胞代谢所需的营养物质的渗入及代谢产物的排出。Yoo等[21]研究发现,立体培养的BMSCs存在定向软骨分化,而单层培养则无软骨形成。
BMSCs有多种分离和体外培养的方法,目前常用的方法主要有四种:全骨髓贴壁法、密度梯度离心法、免疫磁珠分离法和流式细胞分离法。不同分离方法所获得的BMSCs在分化潜能方面存在一定的差异[22]。后两种方法是采用抗原抗体反应来对获取的BMSCs进行分离纯化,分离纯度高,但是由于目前并未发现 BMSCs特异性的表面或胞浆内抗原表达,且实验条件要求高、费用昂贵、对细胞活性可能产生破坏等原因,目前并未得到广泛的应用。密度梯度离心法虽然能够获得较高纯度的BMSCs,但是分离过程中可能会对细胞生长的微环境造成一定程度的破坏,分离液也会对细胞造成一定程度的损伤,造成分离得到的BMSCs的克隆扩增时间延长。相比较而言,全骨髓贴壁法操作简单,BMSCs贴壁快,数量多,克隆扩增时间早,细胞表型表达稳定等优点。由于目前并未发现BMSCs特异性的表面或胞浆内抗原,因此目前对其鉴定主要依赖于其形态学观察及功能学检测[17,23]:⑴体外培养为贴壁生长的梭形细胞。⑵体外可诱导分化培养成骨、软骨、脂肪等至少3种中胚层细胞[24]。⑶可以表达 CD105、CD29、CD44、CD34、CD166、HLA-DR等多种表型,一般认为CD29、CD105和CD166是MSCs相对较为特异的表面粘附分子[25]。满足以上要求的细胞方可认为其为MSCs。
诱导骨髓间充质干细胞(BMSCs)需要在适宜的微环境中多种生长因子协同作用。目前已知多种生长因子都具有诱导 BMSCs想类软骨和髓核细胞转化的作用。TGF-3就是其中一种,其可有效诱导BMSCs的成软骨转化[26]。Barry等[27]发现TGF-3诱导BMSCs的成软骨作用明显强于TGF-1。You等[28]研究表明用TGF-3诱导MSCs,7天即出现II型胶原表达,21天后则出现II型胶原和蛋白聚糖的共同表达。BMP-7作为诱导干细胞向成骨细胞分化细胞因子的研究较多[29,30],Knippenberg等[31]研究则发现,BMP-7还具有促进ATMSCs向软骨细胞分化的作用。Nishihara等[32]发现rhBMP-7可在自体骨表面形成关节软骨,促进软骨修复。同时BMP-7可协同SOX9维持中胚层软骨表象分化[33],从而提高TGF-3诱导BMSCs中Ⅱ型胶原和蛋白聚糖的表达。
本实验采取骨髓全贴壁法获得细胞,经细胞形态学观察为贴壁的梭形细胞,表达CD29、CD105和CD166表面标记,细胞生长增殖能力强,状态良好。体外可诱导分化成为中胚层细胞,且操作简单,诱导分化后的细胞生长良好,增殖正常。由此可见,全骨髓贴壁法是培养BMSCs的快速、简便、可靠的方法,获取的BMSCs状态稳定,使用BMP-7和TGF-3联合诱导兔BMSCs 21天后,细胞的ACAN、Ⅱ型胶原、SOX9等类软骨细胞相关基因的表达水平都有明显的升高,Ⅹ型胶原的表达水平则较空白对照组有明显的降低,由于Ⅹ型胶原主要由肥大软骨细胞分泌,为退变的椎间盘组织中表达量较高的蛋白,SOX9则为蛋白聚糖和Ⅱ型胶原基因转录过程中的关键因子,可以提高二者表达。这也可以说明,在二者联合诱导环境下,BMSCs具有向类髓核细胞分化的趋势,并且可以有效的阻止类软骨细胞和髓核细胞的退变过程,可作为组织工程髓核构建中的种子细胞的一个良好的选择。
[1] 梁雪,粟永萍,孔佩艳.人骨髓间充质干细胞体外培养及鉴定[J].医学研究生学报,2007,20:459-466.
[2] Pittenger M F,Mackay A M,Beck S C,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999, 284:143-147.
[3] Rose F R,Oreffo R O.Bone tissue engineering:hope vs hype[J]. Biochem Biophys Res Commun,2001,292:1-7.
[4] Adlowiec J A,Celil A B,Hollinger J O.Bone tissue engineering: recent advances and promising therapeutic agents[J].Expert Opin Biol Ther,2003,3:409-423.
[5] Steck E,Bertram H,Abel R.Induction of intervertebral disc-like cells from adult mesenchymal stem cells[J].Stem Cells,2005,23: 403-411.
[6] Sakai D,Mochida J,Yamamoto Y,et al.Transplantation of mesenchymal stem cells embedded in Atelocollagen gel to the intervertebral disc:a potential therapeutic model for disc degeneration [J].Biomaterials,2003,24:3531-3541.
[7] Sakai D,Mochida J,Iwashina T,et al.Regenerative effects of transplanting mesenchymal stem cells embedded in atelocollagen to the degenerated intervertebral disc[J].Biomaterials,2006,27: 335-345.
[8] Mishra A,Tummala P,King A,et al.Buffered platelet-rich plasma enhances mesenchymal stem cell proliferation and chondrogenic differentiation[J].Tissue Eng Part CMethods,2009,15:431-435. [9] Niu C,Yuan L J,Lin S S,et al.Mesenchymal stem cell and nucleus pulposus cell coculture modulates cell profile[J].Clin Orthop Relat Res,2009,467:3263-3272.
[10]Hegewald AA,Endres M,Abbushi A,et al.Adequacy of herniated disc tissue as a cell source for nucleus pulposus regeneration [J].Neurosurg Spine,2011,14:273-280.
[11]Weiler C,Nerlich AG,Schaaf R,et al.Immunohistochemical identification of notochordal markers in cells in the aging human lumbar intervertebral disc[J].Eur Spine J,2010,19:1761-1770.
[12]Xie X,Wang Y,Zhao C,et al.Comparative evaluation of MSCs from bone marrow and adipose tissue seeded in PRP-derived scaffold for cartilage regeneration[J].Biomaterials,2012,33:7008-7018.
[13]Minguell JJ,Erices A,Conget P.Mesenchymal stem cells[J].Exp Biol Med(Maywood),2001,226:507-520.
[14]Fromigue O,Hamidouche Z,Chateauvieux S,et al.Distinct oste-oblastic differentiation potential of murine fetal liver and bone marrow stroma-derived mesenchymal stem cells[J].Cell Biochem, 2008,104:620-628.
[15]Paniushin OV,Domaratskaia EI,Starostin VI.Mesenchymal stem cells:sources,phenotype,and differentiation potential[J].Izv Akad Nauk Ser Biol,2006,(1):6-25.
[16]Turgeman G,Pittman DD,Müller R,et al.Engineered human mesenchymal stem cells:a novel platform for skeletal cell mediated gene therapy[J].Gene Med,2001,3:240-251.
[17]Jiang Y,Jahagirdar BN,Reinhardt RL,et al.Pluripotency of mesenchymal stem cells derived from adult marrow[J].Nature,2002, 418:41-49.
[18]Conget PA,Minguell JJ.Phenotypicaland functional properties of human bone marrow mesenchymal progenitor cells[J].Cell Physiol,1999,181:67-73.
[19]Colter DC,Class R,DiGirolamo CM,et al.Rapid expension of recycling stem cells in cultures of plastic-adherent cells from human bone marrow[J].Proc Nati Acad Sci USA,2000,97:3213-3218.
[20]Di Nicola M,Carlo-Stella C,Magni M,et al Human bone marrow stromal cells suppress T-lymphocyte proliferation induced by cellular or nonspecific mitogenic stimuli[J].Blood,2002,99:3838-3843.
[21]Yoo JU,Bart hel TS,Nish imura K,et al.The chondrogenicpotential of human bone-marrow derived mesenchymal progenitor cells[J].Bone Joint Surg,1998,8:17-25.
[22]Jones EA,Kinsey SE,English A,et al.Isolation and characterization of bone marrow multipotential mesenchymal progenitor cells [J].Arthritis Rheum,2002,46:3349-3360.
[23]Colter D C,Sekiya I,Prockop D J.Identification of a subpopulation of rapidly self-renewing and multipotential adult stem cells in colonies of human marrow stromal cells[J].Proc Natl Acad Sci USA,2001,98:7841-7845.
[24]Koga H,Muneta T,Ju YJ,et al.Synovial stem cells are regionally specified according to local microenvironments after implantation for cartilage regeneration[J].Stem Cells,2007,25:689-696.
[25]Zhu H,Mitsuhashi N,Klein A,et al.The role of the hyaluronan receptor CD44 in mesenchymal stem cell migration in the extracellular matrix[J].Stem Cells,2006,24:928-935.
[26]Cancedda R,Descalzi Cancedda F,et al.Chondrocyte differentiation[J].Int Rev Cytol,1995,159:265-358.
[27]Barry F,Raymond EB,Beishan L,et al.Chondrogenic differentiation of mesenchymal stem cells from bone marrow:differentiation-dependent gene expression of matrix components[J].Exp Cell Res,2001,268:189.
[28]You HB,Chen AM.Transfection of precartilaginous stem cells with enhanced green fluorescence protein gene and transforming growth factor Binducing chondrogenesis in precartilaginous stem cell[J].Chin J Pediatr Surg,2004,25:545-549.
[29]Stone C.A molecular approach to bone regeneration[J].Br J Plast Surg,1997,50:369-373.
[30]张子军,卢世璧,王继芳,等.骨缺损中内源性BMP的分布及其作用[J].中华外科杂志,1996,34:596-597.
[31]Knippenberg M,Helder M.N,Zandieh-Doulubi B,et al.Osteogenesis versus chondrogenesis by BMP-2 and BMP-7 in adipose stem cells[J].Biochem Biophys Res Commun,2006,342:902-908.
[32]Nishihara A,Fujii M,Sampath TK,Miyazono K,Reddi AH.Bone morphogenetic protein signaling in articular chondrocyte differentiation[J].Biochem Biophys Res Commun,2003,301:617-622.
[33]Solursh M.Formation of cartilage tissue in vitro[J].cell Biochem, 1991,45:258-260.
The study of obtaining the seed cells in engineering nucleus pulposus through all bone marrow adherence method
ObjectiveTo identify the demanding environment of differentiation and differentiation ability of BMSCs, in order to choose a suitable seed cells for tissue engineering nucleus pulposus.MethodsObtain the rabbit BMSCs with the method of direct way.Be sure of the BMSCs through the surface mark,and then induce it to differentiate into three different mesoderm cells.Then devide BMSCs into four groups:A blank control group,B singly induced by TGF-3, C Singly induced by BMP-7,D combination induced by TGF-3 and BMP-7.Measure the expression of ACAN、CollagenⅠ、CollagenⅡ、CollagenⅩand SOX9 in mRNA level through Realtime PCR after 21 days cultivation.ResultsThe cells got through the all bone marrow adherence method are able to express cell surface marker of CD29,CD105, CD166 according to flow cytometry detection.After 21 days induced by certain kinds of induction medium,the BMSCs differentiated into at least three kinds of mesoderm cells:osteoblast,chondroblast and adipocyte.The expression level of ACAN,Collagen Ⅱ and SOX9 in group C and D was obviously higher than group A and B(P<0.05).The expression level of Collagen Ⅹ in group A and B was much higher than group C and D(P<0.05).And there was no obviously difference between four groups with CollagenⅠexpression level.ConclusionThe BMSCs could be obtained successfully through the all bone marrow adherence method,and the cells induced by induction medium are able to differentiate into some kinds of mesoderm cells.The BMSCs was able to show a high expression level of downstream gene in NPCs.
BMSCs;All bone marrow adherence method;Induced differentiation;TGF-3;BMP-7
R318
A
康健(1983-)男,博士,主治医师。研究方向:脊柱外科。
*[通讯作者]袁文(1962-)男,本科,主任医师,博士生导师。研究方向:脊柱外科。
2013-06-14)
国家自然科学基金资助项目(81071509)
1第二军医大学附属长征医院骨科,上海200003;2山东省泰安市解放军88医院骨科中心,山东泰安271000

