外源性Ⅵ型胶原对人后纵韧带细胞增殖和成骨转化的影响*
孙其志 张竞
论著·实验研究
外源性Ⅵ型胶原对人后纵韧带细胞增殖和成骨转化的影响*
孙其志1张竞2
目的观察外源性VI型胶原蛋白(collagen VI,CⅥ)对人后纵韧带细胞增殖和成骨转化的影响。方法取颈椎后纵韧带骨化症(ossification of the posterior longitudinal ligament,OPLL)患者手术切除的后纵韧带未骨化部分和非OPLL患者因外伤手术切除的正常后纵韧带,原代培养至第3代细胞,分别记作O细胞和N细胞;两种细胞均采用0、6.25、12.5、25、50、100 g/mlCⅥ刺激;CCK8法测定刺激后两种细胞1~7天光密度(D)值,评价CⅥ对细胞增殖的影响;骨形态生成蛋白-2(BMP-2)对不同浓度CⅥ刺激的细胞进行诱导骨化,用反转录聚合酶链反应(RT-PCR)检测各组细胞成骨细胞转录因子-2(RunX2)、碱性磷酸酶(ALP)、骨钙素(OC)的基因表达情况。结果CⅥ对两种细胞的增殖均起促进作用,且随着CⅥ浓度增加,其对细胞增殖的促进作用随之增强,但达到一定浓度后这种作用会保持不变或减弱,同一时间点内50 g/ml CⅥ刺激时两种细胞的D值最大;BMP-2诱导后的两组细胞有CⅥ刺激的ALP、RunX2和OC的基因表达均高于无CⅥ刺激的对照组(P<0.05);在无CⅥ刺激的情况下,O细胞的基因表达高于N细胞(P<0.05)。结论CⅥ能够促进人后纵韧带细胞的增殖和成骨转化,而来自后纵韧带骨化患者的细胞则更易被促进增殖和诱导骨化,CⅥ可能具有促进后纵韧带细胞成骨的功能。
Ⅵ型胶原蛋白;后纵韧带骨化症;细胞增殖;成骨转化
后纵韧带紧贴脊柱各椎体后方,由枕骨大孔到骶骨,构成椎管前壁。后纵韧带骨化症(ossification of posterior longitudinal ligament,OPLL)是发生在后纵韧带内的异位骨结构形成,病因及机制仍不明确,可能由多种因素共同作用引起,包括基因异常表达、代谢异常、局部应力作用等[1-3]。其中,部分研究[4-6]认为OPLL的发生与编码VI型胶原蛋白(collagen Ⅵ,CⅥ) 1肽链的COL6A1基因异常表达有关,提示CⅥ蛋白表达异常可能参与了OPLL的发生、发展。CⅥ作为细胞外基质的一种纤维蛋白,在维护细胞内环境的稳定和细胞分化、黏附、增殖、迁移、存活等方面起着重要作用[7-9]。因此,本研究采用外源性CⅥ体外刺激人颈椎后纵韧带细胞,观察其对后纵韧带细胞增殖及成骨转化的影响,初步探讨 CⅥ蛋白在OPLL发生发展中的可能机制。
1 材料和方法
1.1 主要试剂及仪器
胎牛血清(Invitrogen公司),低糖DMEM培养基、0.25%胰蛋白酶、PBS液(Hyclone公司),VI胶原蛋白(Sigma公司),CCK8(cell counting kit-8)试剂盒(Beytime,江苏),酶联免疫检测仪(Bio-Rad公司,USA),TRIzol试剂、反转录试剂盒、普通PCR试剂盒(TaKaRa公司),SYBR Green Real-time PCR Master Mix I荧光实时PCR检测试剂盒(Toyobo公司)。
1.2 细胞培养与分组
无菌条件下,取OPLL患者前路减压手术切除的后纵韧带未骨化部分和非OPLL患者因外伤前路减压手术中切除的正常后纵韧带。PBS液清洗3~4次,眼科剪将韧带剪成大小约0.5mm3的碎块,将剪成的碎块组织均匀分布于60mm培养皿中,培养基为含10%胎牛血清的DMEM培养液,置于37℃、5%CO2、饱和湿度的培养箱中静置培养,3天更换培养液1次。待组织块周围有大量细胞迁出后,去除组织块,0.25%胰酶消化细胞并转移至培养皿中继续培养,收集第3代细胞用于实验,分别记作O细胞(来自OPLL患者后纵韧带)和N细胞(来自非OPLL患者后纵韧带)。每种细胞均采用浓度为0、6.25、12.5、25、50、100 g/mlCⅥ刺激,共12组细胞,每组细胞均设有3组重复。
1.3 CCK8法检测细胞增殖特性
取7个96孔板,在96孔板所需孔中预铺200 l浓度为0、6.25、12.5、25、50、100 g/ml CⅥ,置于细胞培养箱48小时后,PBS液洗去非黏附CⅥ。取第3代O细胞和N细胞以无血清培养基培养24小时后配制密度为2×104/ml的细胞悬液。以2×103/孔种植至96孔板,每组3孔,并设对照孔。置细胞培养箱中培养1~7天后,每孔加入10 l CCK8溶液,细胞培养箱中继续孵育2小时,于450nm测定光密度(D)值。
1.4 CⅥ刺激下BMP-2诱导骨化
将BMP-2用含10%胎牛血清的DMEM配制成浓度为500ng/ml的溶液。取18个100mm培养皿,在培养皿中预铺2ml浓度分别为0、6.25、12.5、25、50、100 g/ml CⅥ溶液,每种浓度重复3个培养皿,置于细胞培养箱中48小时后,PBS液洗去非黏附CⅥ。取第3代O细胞,接种到培养皿中进行培养,培养基为含500ng/ml BMP-2、10%胎牛血清的DMEM。每2天换液,培养5天后收集细胞。N细胞采用同样的操作步骤。
1.5 反转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)
RT-PCR技术检测各组细胞的碱性磷酸酶(Alkaline phosphatase,ALP)、骨钙素(osteocalcin,OC)、成骨细胞转录因子2(runt-related transcription factor 2,Runx 2)mRNA表达情况。用TRIzol法提取总RNA,各组均重复3次,紫外分光光度计测定RNA含量,用2%凝胶电泳鉴定所提RNA的完整性。使用RT-PCR反转录试剂盒(TaKaRa公司)反转录形成cDNA。内参基因采用GAPDH,其引物序列为:上游5’-AGA AGG CTG GGG CTC ATT TG-3’,下游5’-AGG GGC CAT CCA CAG TCT TC-3’,258bp。目标基因ALP、OC、Runx2的引物序列,ALP:上游5’-CGG GAC TGG TAC TCA-3’,下游5’-GTG TCA ACG AGG TCC AGG CC-3’,221bp;OC:上游5’-GCA GCC ACC GAG ACA CCA TG-3’,下游5’-GAT CCG GGT AGG GGA CTG G-3’,213bp;Runx2:上游5’-TGG ACG AGG CAA GAG TTT CAC C-3’,下游5’-TTC TGT CTG TGC CTT CTG GGT T-3’,126bp。使用Toyobo公司的SYBR Green Real-time PCR Master Mix I荧光实时PCR试剂盒和ABI7500扩增仪进行荧光扩增。反应总体积25 l,反应参数:94℃预变性5分钟;扩增94℃,30秒;58℃,30秒;72℃,20秒;85℃(收集荧光),10秒;40个循环。为了建立PCR产物的融解曲线,扩增反应结束后继续从72℃缓慢加热到99℃(每 5秒升高 1℃)。各样品目的基因与管家基因分别进行RT-PCR反应。根据绘制的梯度稀释DNA标准曲线判断其扩增效率,各样品目的基因和管家基因的Ct(threshold cycle)值直接由机器生成。每个样品的目的基因Ct值减其管家基因Ct值,即为此样品此基因校正后的相对含量。
1.6 统计学处理
2 结果
2.1 细胞增殖和生长曲线
CⅥ浓度为0 g/ml时,O细胞生长较快,其高峰期是在第4天;N细胞生长稍慢,其高峰期是第5天(图1)。无论是N细胞还是O细胞,当加入一定浓度CⅥ刺激后,细胞增殖能力均大幅提高,而以CⅥ浓度在50 g/ml时增幅为最大,当CⅥ为100 g/ml时,增幅能力又有所减少。O细胞增殖能力高于N细胞,尤其在细胞生长的第3~4天(P<0.05)(图2)。(图1、2彩图见插页)
2.2 Runx2、ALP、OC基因表达情况
CⅥ浓度为0 g/ml时,在BMP-2骨化诱导下,O细胞的ALP和Runx2基因表达明显高于N细胞(p<0.05),而OC基因的表达情况两种细胞差异无统计学意义(图3)。与CⅥ=0 g/ml相比,不同浓度CⅥ刺激后,O细胞和N细胞ALP、Runx2、OC基因表达均明显增多(P<0.05),尤其在CⅥ浓度为25、50 g/ml时(图4)。(图3、4彩图见插页)
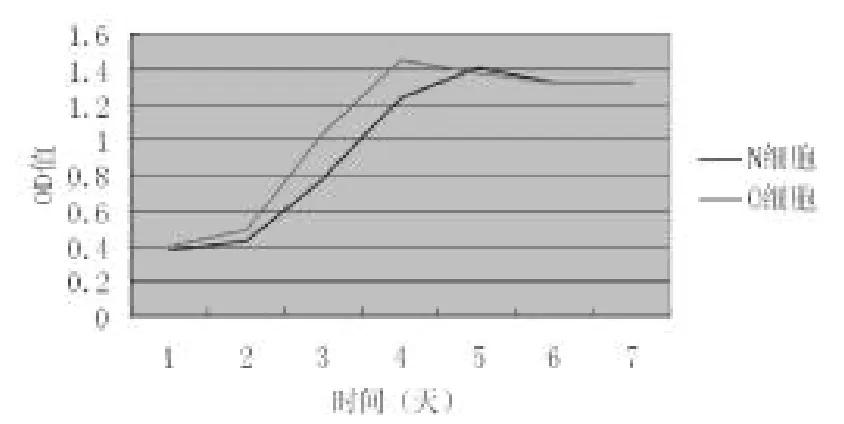
图1 无CⅥ刺激时两种细胞7天的生长曲线
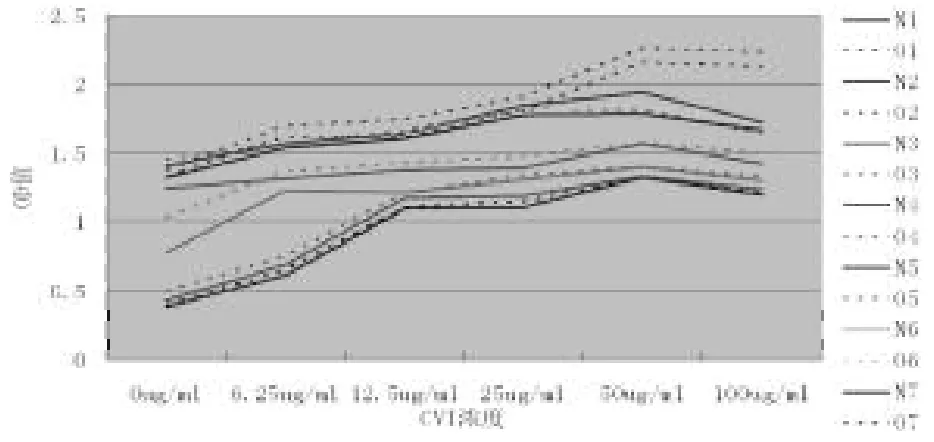
图2 O细胞和N细胞7天内随CⅥ浓度改变的增殖图

图3 无CⅥ刺激时两种细胞成骨标志物表达情况对比图
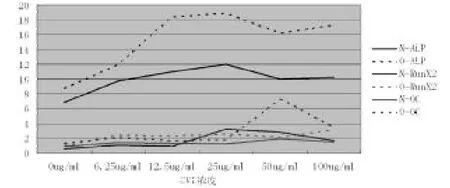
图4 两种细胞的ALP、Runx2、OC基因表达随CⅥ浓度的变化
3 讨论
OPLL是临床上常见的脊柱疾患,其发病机制不明。对骨化物和韧带交界地带的免疫组化研究发现,胶原的异常表达在骨化的不断进展中起到一定作用[10]。COL6A1限制性片段多态性可能与OPLL相关[4-6]。但对于CⅥ蛋白在骨化中的作用尚无相关研究。
CⅥ是细胞外基质的一种纤维蛋白,它在几乎全部的结缔组织中都有分布。它是由三条不同的a链构成的异三聚体结构,在细胞环境的稳定和细胞分化、粘附、增殖、迁移、存活等方面在维持细胞基质结构和功能中起着重要的作用。研究发现CⅥ可以促进各种细胞的增殖,这种促进增殖作用可以被CⅥ单独的肽链所阻断[11]。本实验发现,无论后纵韧带细胞是来自正常患者还是骨化患者的韧带组织,CⅥ都能够促进其增殖,且随着CⅥ浓度增加,其对细胞增殖的促进作用随之增强;但达到CⅥ浓度为100 g/ml时这种作用会保持不变或减弱,可能CⅥ已达到饱和或高浓度的CⅥ会反过来起到抑制作用。
CⅥ还能调节细胞分化。将心肌纤维细胞置于含有CⅥ的基质中培养,发现由于CⅥ的诱导,成肌纤维细胞出现了分化[7]。免疫细胞化学分析发现CⅥ较多地分布在牛肌腱的纤维软骨区域中,被认为是纤维软骨分化的标志物[9]。有研究认为CⅥ诱导细胞分化是通过细胞信号转导实现的,对CⅥ与信号转导的研究发现,溶解的CⅥ可以在纤维细胞中诱导桩蛋白和成簇粘附激酶的酪氨酸磷酸化,活化胞外信号调节激酶[12]。本实验中,当加入CⅥ后,无论O细胞还是N细胞的ALP、RunX2和OC的基因表达与对照组相比均明显增强,且随着浓度的变化而不同。这种增强作用可能因为CⅥ本身具有成骨诱导作用,也可能由于CⅥ促进了韧带细胞增殖,进而导致细胞成骨分化,抑或是CⅥ对细胞不起诱导分化作用,而是增强了BMP-2的成骨诱导作用。从既往研究来看,CⅥ本身具有诱导细胞分化作用似乎更为可能。但无论怎样,从本实验的结果看,在CⅥ存在的条件下,韧带细胞的成骨诱导效果得到了明显提高。既往研究已经证实OPLL过程中多种细胞因子尤其是BMP-2起着重要作用,而本实验表明了CⅥ在OPLL过程中具有增强BMP-2成骨诱导效果的作用。
但是,CⅥ对两种韧带细胞的作用却不相同,实验发现CⅥ对O细胞的增殖作用和对BMP-2成骨诱导增强作用要强于N细胞,这说明在CⅥ作用下,O细胞更易于被促进增殖和分化。而且,在没有CⅥ情况下,经BMP-2骨化诱导后,O细胞的ALP和RunX2的基因表达也明显高于N细胞,这表明O细胞和N细胞尽管都来自后纵韧带组织,但其细胞生物学特性已经发生了变化。既往通过对韧带细胞培养发现,来自OPLL患者的韧带细胞具有成骨细胞的某些表型[13,14]。董军等[15]的研究也证实了这一变化,其研究中观察到OPLL患者后纵韧带成纤维细胞增殖较快,经培养后表现成骨细胞特性。本实验的结果从另一个方面反映了后纵韧带患者的韧带细胞发生了变化,与上述研究结果一致。有人认为OPLL方式是软骨内成骨[16,17],后纵韧带组织的成纤维细胞在多种因素共同作用下逐渐分化为纤维软骨细胞、软骨细胞直至成骨细胞,完成骨化。通过对趾尖行走鼠(一种OPLL模型鼠)椎间盘和后纵韧带的细胞外基质成分的变化研究发现,后纵韧带为了修补椎体损伤而从结缔组织转变为软骨组织,进而形成骨组织[18]。由此看来,既往研究和本实验结果都表明了在后纵韧带骨化过程中,韧带组织中正常的成纤维细胞已经发生了变化,转变为易于骨化的细胞,而CⅥ更容易促进这类具有成骨倾向细胞的增殖和分化。
有研究表明CⅥ与成骨密切相关[19],在软骨内成骨过程中,表达CⅥ的软骨细胞首先出现在软骨管和关节表面,之后进入骺板的贮备区,在骨化成熟的过程中其数量不断增加。在部分闭合的骺板中,表达CⅥ的软骨细胞出现在残存的骺板中。在一些罕见的异位成骨,如室骨膜瘤的软骨骨化中,也发现了Ⅱ型、Ⅵ型胶原出现在细胞外基质中,并伴随有细胞坏死和钙化现象[20]。
CⅥ可能为成骨细胞和前成骨细胞或者软骨细胞提供一个支架,以利于膜内或软骨内成骨[21]。在骨痂组织中发现CⅥa2肽链的mRNA持续存在,说明这种胶原贯穿于骨折愈合的整个过程。CⅥ的缺失可能导致软骨细胞分化和增殖的延迟,从而延迟骨化,减少骨的形成[22]。在骨质疏松症中也发现CⅥ的减少[23]。
总之,通过体外培养两种来源不同的后纵韧带细胞和利用外源性CⅥ对人后纵韧带细胞的刺激,我们认为后纵韧带骨化患者的韧带细胞已经发生了变化,导致后纵韧带更容易骨化。而Ⅵ型胶原蛋白作为一种细胞外基质,能够促进人后纵韧带细胞的增殖和成骨转化。这为研究OPLL的发病机制提供了一个新的思路和方法。
[1] Inamasu J,Guiot BH,Sachs DC.Ossification of the posterior longitudinal ligament:an update on its biology,epidemiology,and natural history[J].Neurosurgery,2006,58(6):1027-1039.
[2] Kobashi G,Washio M,Okamoto K,et al.High body mass index after age 20 and diabetes mellitus are independent risk factors for ossification of the posterior longitudinal ligament of the spine in Japanese subjects:a case-control study in multiple hospitals[J]. Spine(Phila Pa 1976),2004,29(9):1006-1010.
[3] Okamoto K,Kobashi G,Washio M,et al.Dietary habits and risk of ossification of the posterior longitudinal ligaments of the spine(OPLL);findings from a case-control study in Japan[J].J Bone Miner Metab,2004,22(6):612-617.
[4] Tanaka T,Ikari K,Furushima K,et al.Genomewide linkage and linkage disequilibrium analyses identify COL6A1,on chromosome 21,as the locus for ossification of the posterior longitudinal ligament of the spine[J].Am J Hum Genet,2003,73:812-822.
[5] Tsukahara S,Miyazawa N,Akagawa H,et al.COL6A1,the candidate gene for ossification of the posterior longitudinal ligament, is associated with diffuse idiopathic skeletal hyperostosis in Japanese[J].Spine(Phila Pa 1976),2005,30:2321-2324.
[6] Kong Q,Ma X,Li F,et al.COL6A1 polymorphisms associated with ossification of the ligamentum flavum and ossification of the posterior longitudinal ligament[J].Spine(Phila Pa 1976),2007, 32:2834-2838.
[7] Naugle JE,Olson ER,Zhang X,et al.TypeⅥcollagen induces cardiac myofibroblast differentiation:implications for postinfarction remodeling[J].Am J Physiol Heart Circ Physiol,2006,290(1):323-330.
[8] Bryant JE,Shamhart PE,Luther DJ,et al.Cardiac myofibroblast differentiation is attenuated by alpha(3)integrin blockade:potential role in post-MI remodeling[J].J Mol Cell Cardiol,2009,46(2):186-192.
[9] Carvalho HF,Felisbino SL,Keene DR,et al.Identification,content,and distribution of type Ⅵ collagen in bovine tendons[J].Cell Tissue Res,2006,325(2):315-324.
[10]Sato R,Uchida K,Kobayashi S,et al.Ossification of the posterior longitudinal ligament of the cervical spine:histopathological findings around the calcification and ossification front[J].J Neurosurg Spine,2007,7:174-183.
[11]Atkinson J C,Rühl M,Becker J,et al.Collagen Ⅵ regulates normal and transformed mesenchymal cell proliferation in vitro[J]. Exp Cell Res,1996,228:283-291.
[12]Rühl M,Johannsen M,Atkinson J,et al.Soluble collagen Ⅵinduces tyrosine phosphorylation of paxillin and focal adhesion kinase and activates the MAP kinase erk2 in fibroblasts[J].Exp Cell Res,1999,250:548-557.
[13]Ishida Y,Kawai S.Characterization of cultured cells derived from ossification of the posterior longitudinal ligament of the spine[J]. Bone,1993,14:85-91.
[14]Ishida Y,Kawai S.Effects of bone-seeking hormones on DNA synthesis,cyclic AMP level,and alkaline phosphatase activity in cultured cells from human posterior longitudinal ligament of the spine[J].J Bone Miner Res,1993,8:1291-300.
[15]董军,袁文,王新伟,等.颈椎后纵韧带骨化成纤维细胞的培养及其生物学特性[J].脊柱外科杂志,2007,5:109-112.
[16]Song J,Mizuno J,Hashizume Y,et al.Immunohistochemistry of symptomatic hypertrophy of the posterior longitudinal ligament with special reference to ligamentous ossification[J].Spinal Cord, 2006,44:576-581.
[17]Yamamoto Y,Furukawa K,Ueyama K,et al.Possible roles of CTGF/Hcs24 in the initiation and development of ossification of the posterior longitudinal ligament[J].Spine(Phila Pa 1976), 2002,27:1852-1857.
[18]Hirakawa H,Kusumi T,Nitobe T,et al.An immunohistochemical evaluation of extracellular matrix components in the spinal posterior longitudinal ligament and intervertebral disc of the tiptoe walking mouse[J].J Orthop Sci,2004,9:591-597.
[19]Izu Y,Soeta S,Kamiya S,et al.Distribution of type Ⅵcollagenin the cartilaginous tissue of the proximal tibia in the domestic cat [J].J Vet Med Sci,2005,67:927-933.
[20]Zimecnkk J,Chánová M,Tichy M,et al.Distribution of the extracellular matrix glycoproteins in ependymomas-an immunohistochemical study with follow-up analysis[J].Neoplasma,2004, 51:214-222.
[21]Wiberg C,Klatt A R,Wagener R,et al.Complexes of matrilin-1 and biglycan or decorin connect collagen Ⅵ microfibrils to both collagen II and aggrecan[J].J Biol Chem,2003,278:37698-37704.
[22]Alexopoulos L G,Youn I,Bonaldo P,et al.Developmental and osteoarthritic changes in Col6a1-knockout mice:biomechanics of type VI collagen in the cartilage pericellular matrix[J].Arthritis Rheum,2009,60:771-779.
[23]Bailey AJ,Wotton S F,Sims T J,et al.Biochemical changes in the collagen of human osteoporotic bone matrix[J].Connect Tissue Res,1993,29:119-132.
The influence of type VI collagen on the proliferation and osteogenic differentiation of human spinal ligament cells
ObjectiveTo investigate the influence of type VI collagen(CⅥ)on the proliferation and osteogenic differentiation of human spinal ligament cells.MethodsCells isolated from the patients with ossification of the posterior longitudinal ligament(OPLL)(O cells)and the patients with non-OPLL(N cells)were stimulated by different concentrations of CⅥ.The proliferation of the cell was measured by CCK8.After the cells were stimulated by different concentration of CⅥin the presence of BMP-2,the gene expressions of alkaline phosphatase,Runx2 and osteocalcin were examined by quantitative reverse transcriptase-polymerase chain reaction.ResultsCⅥ positively regulated the proliferation of both O cells and N cells in a dose-dependent manner.The strongest effect was observed when the CⅥ concentration was 50 g/ml.The gene expressions of alkaline phosphatase,Runx2 and osteocalcin of cells stimulated by CⅥwere higher than those of cells not be stimulated by CⅥ(P<0.05).In the absence of CⅥ,the gene expressions of O cells were higher than those of N cells(p<0.05).ConclusionCⅥ potentiated the proliferation and BMP-2 induced osteogenic differentiation of human spinal ligament.The cells from OPLL were more sensitive than the cells from non-OPLL to CⅥ.CⅥ may contribute the onset and progression of OPLL.
Type Ⅵ collagen;Ossification of the posterior longitudinal ligament;Proliferation;Osteogenic differentiation
R318.08
A
孙其志(1977-)男,博士,主治医师。研究方向:脊柱外科。
2013-05-29)
2010年度“上海市卫生局科研课题”经费支持(基金编号:2010138)
1.山东省泰安市解放军88医院骨科中心,山东泰安271000;2.上海市新华医院骨科,上海200092

