纸质食品接触材料中18种禁用多环芳烃的快速测定
杨左军,王成云,徐嵘,顾浩飞,廖文忠,张春燕,陈坚
(深圳出入境检验检疫局工业品检测技术中心,广东深圳518067)
纸质食品接触材料中18种禁用多环芳烃的快速测定
杨左军,王成云,徐嵘,顾浩飞,廖文忠,张春燕,陈坚
(深圳出入境检验检疫局工业品检测技术中心,广东深圳518067)
以正己烷/丙酮(1∶1,V/V)为萃取溶剂,40℃下超声萃取纸质食品接触材料中的多环芳烃(PAHs),提取产物经硅胶固相萃取柱净化后进行超高效液相色谱分析,外标法定量,从而建立了一个同时测定纸质食品接触材料中18种禁用多环芳烃的高效液相色谱方法。在信噪比(S/N)=3的条件下,各目标化合物的检出限为0.02~0.10 mg/kg,其线性相关系数r均不低于0.999 9。各组分的平均加标回收率为58.13%~95.86%,相对标准偏差(RSD)为1.58%~4.68%。应用该方法对市售纸质食品接触材料中的多环芳烃含量进行测定,结果在一个样品中检出高浓度的菲。该方法简便快速、灵敏度高、定性定量准确,可满足多环芳烃检测的技术要求,适用于纸质食品接触材料中多环芳烃的测定。
纸质食品接触材料;多环芳烃;超高效液相色谱;超声萃取;快速测定
随着食品工业的飞速发展和各国对食品安全卫生的重视,人们对关系人体健康的食品接触材料的生产提出了更高的要求,食品接触材料的种类也不断增加。其中,纸质食品接触材料因其品种丰富、绿色环保的优点而越来越受到人们的关注。纸质食品接触材料的原料是纸和纸基复合材料,往往使用油墨进行印刷。造纸时,经常部分使用回收再生纸。回收再生纸中常含有大量有毒有害物质[1-8],尤其是废旧报纸和书籍会含有油墨,而油墨中可能残留有多环芳烃(PAHs)。PAHs具有致癌、致畸变、致突变性,且能在生物体内富集。因此,大多数国家均将其列入重点监测对象[9-12],REACH法规也将蒽纳入第1批高关注物质清单中。当残留有PAHs的纸质食品接触材料与食品接触后,PAHs将迁移进入食品中,污染食品。目前禁止使用的PAHs共有18种。2012年12 月31日,欧盟修改REACH法规附件17,全面禁止在消费品中使用PAHs,对于食品接触材料,规定不得检出PAHs,PAHs总量和苯并[a]芘含量均不得高于0.20 mg/kg。纸质食品接触材料是我国的一类重要出口商品,主要输往欧盟国家。为确保纸质食品接触材料顺利出口欧盟,必须严格监控纸质食品接触材料中PAHs的含量。
目前对PAHs的检测主要集中在电工产品和环境样品方面,通常采用酶联免疫法[13-14]、飞行质谱法[15]、气质联用法[16]、气相色谱/串联质谱法[17]、气相色谱法[18]、液相色谱法[19]、表面增强拉曼光谱法[20]、红外光谱法[21]和荧光光谱法[22]等方法进行测定。在食品接触材料方面,我国也发布了多个PAHs检测标准[23-28],但尚未见纸质食品接触材料中PAHs检测的文献报道,因此有必要建立一个快速简便的方法,对纸质食品接触材料中PAHs含量进行测定。超声萃取法操作简便、检测通量大[29],超高效液相色谱具有超高速度、分离度和灵敏度[30]。
本文采用超声萃取技术提取纸质食品接触材料中的PAHs,提取液经硅胶固相萃取柱净化后进行超高效液相色谱分析,从而建立了一个同时测定纸质食品接触材料中18种禁用PAHs的快速方法。
1 实验部分
1.1 仪器与试剂
仪器有:Shimadzu LC-20AD高效液相色谱仪(日本岛津公司);SB 25-12 DTD超声清洗机(宁波新芝生物科技股份有限公司);氮吹仪(青岛海科仪器有限公司);0.45 μm滤膜(德国Membrane公司);SmarVapor RE 501旋转蒸发仪(德国Dechem-Tech公司)。
试剂有:各PAHs标样(纯度均>98%)和PAHs混标,均由O2si smart solutions公司提供,混标中含有18种PAHs,每种PAHs的质量浓度均约为1 000 μg/mL,使用时用乙腈将混标逐级稀释至所需浓度;色谱纯乙腈,由Merck公司提供;分析纯试剂环己烷、正己烷、二氯甲烷、丙酮、甲醇、二甲亚砜、四氢呋喃和石油醚,均由广州化学试剂厂提供;水,为Millipore纯水系统处理的二级水。
1.2 样品前处理
准确称取1.0 g剪碎后的样品,置于150 mL磨口锥形瓶中,加入25 mL萃取溶剂,在40℃下超声35 min,过滤,残渣用25 mL萃取溶剂超声第2次,合并滤液,旋转蒸发至近干,再用氮气缓慢吹干。残留物用2 mL正己烷溶解,转移至已用5 mL正己烷活化的硅胶固相萃取柱中,让液体以2滴/s的速度流下,弃去。用5 mL二氯甲烷/正己烷(2∶3,V/V)淋洗,收集淋洗液,旋转蒸发至近干后用氮气缓慢吹干,用2 mL乙腈溶解残留物,用0.45 μm滤膜过滤后进行液相色谱分析。
1.3 分析条件
色谱柱:Inertsil ODS-P柱(150 mm×2.1 mm×3.0 μm)。进样量:1.0 μL。柱温:50℃。洗脱梯度见表1(各组分的检测波长见表3)。
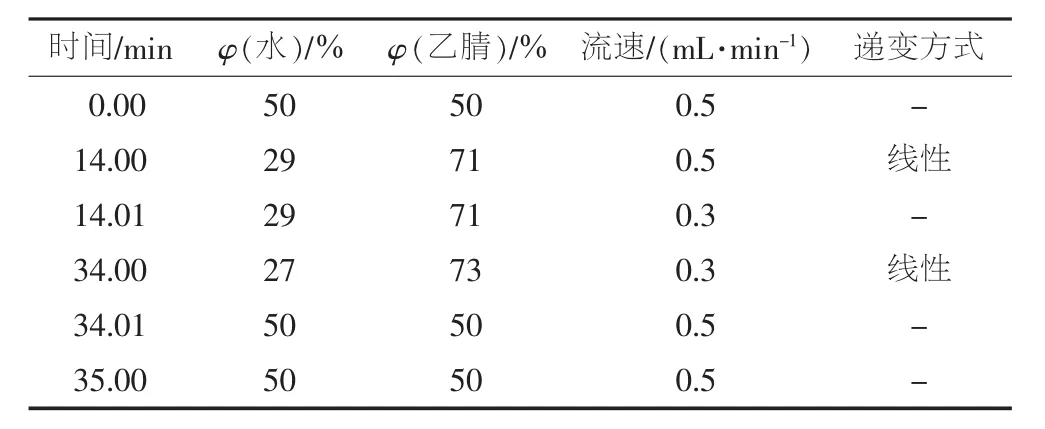
表1 洗脱梯度
2 结果与讨论
2.1 萃取条件的优化
改变超声萃取时间、萃取温度以及萃取溶剂用量,对一个阳性样品中的PAHs进行萃取,观察萃取量的变化。当萃取温度和萃取溶剂用量不变时,萃取时间为35 min时萃取量最大;当萃取时间和萃取溶剂用量不变时,萃取温度为35℃时萃取量最大;当萃取时间和萃取温度不变时,萃取溶剂用量为25 mL时萃取量最大。综合考虑萃取时间、萃取温度和萃取溶剂用量的影响,进行3因素3水平正交实验,萃取时间水平分别为30、35和40 min,萃取温度水平分别为30、35和40℃,萃取溶剂用量水平分别为20、25和30 mL。正交实验结果表明,当超声时间为35 min、温度为40℃和溶剂用量为25 mL时,萃取量最大。在此条件下,对同一样品连续进行3次超声提取,对提取量进行分析,结果发现,第1次提取时提取量达到总提取量的97%以上,第2次提取时目标分析物基本上已被提取完全,第3次提取时基本上无目标分析物被提取出来。
不同溶剂对目标物的溶解能力各不相同,且对超声波的吸收能力各异,因此采用不同的溶剂进行萃取时,萃取量相差极大。为了确定合适的萃取溶剂,参考相关文献,分别选用二氯甲烷、甲醇、丙酮、正己烷/丙酮(1∶1,V/V)、正己烷/二氯甲烷(1∶1,V/V)、环己烷、石油醚、丙酮/甲醇(2∶1,V/V)、正己烷、丙酮/二氯甲烷(1∶1,V/V)和四氢呋喃等11种常见溶剂作为萃取溶剂,对一个阳性样品中的PAHs进行提取,观察不同溶剂的提取量,结果见表2。

表2 不同溶剂的提取效果
表2的数据表明,正己烷/丙酮的提取效果最佳。因此最终确定的提取条件为:用25 mL正己烷/丙酮(1∶1,V/V)40℃下超声35 min。
2.2 样品的净化
PAHs可采用二甲亚砜萃取-环己烷反萃取方式净化,或先二甲亚砜萃取-环己烷反萃取再用固相萃取柱进行净化,也可直接采用固相萃取柱进行净化。作者采用这3种方式分别对一个阳性样品中的PAHs进行处理。结果发现,二甲亚砜萃取-环己烷反萃取-固相萃取柱净化方式的净化效果最好,但提取量明显最低;另外2种方法的净化效果接近,谱图中杂质峰均很少,但二甲亚砜萃取-环己烷反萃取法的提取量稍低。因此,最终采用固相萃取柱直接进行净化。
固相萃取柱对PAHs有一定吸附,经其净化处理后,会损失部分PAHs。选取Supelclean LC-Si硅胶柱、Agilent Bond Elut C18柱、Agilent Chem Elut柱、Suplco LC-C18柱、CNM Bond LC-C18柱、Suplco LC-Florisil柱、Anpelclean聚酰胺柱、AccuBond中性氧化铝柱、AccuBond Florisil反相柱和Waters Sep-Pak Vac柱等10种固相萃取柱分别对质量浓度约为10 μg/mL的18种PAHs混标溶液进行处理,测定其回收率。结果表明,每种PAHs的回收率均不低于93%,其中Supelclean LC-Si硅胶柱的回收率最高。因此最终确定采用Supelclean LC-Si硅胶柱进行净化。
将正己烷配制的质量浓度约为10 μg/mL的18 种PAHs混标溶液2 mL转移至已活化处理的硅胶柱中,收集流出液,经分析,该流出液中未检出PAHs,故弃去。分别用5 mL二氯甲烷/正己烷(3∶1,V/V)、二氯甲烷/正己烷(2∶1,V/V)、二氯甲烷/正己烷(1∶1,V/V)、二氯甲烷/正己烷(1∶2,V/V)、二氯甲烷/正己烷(1∶3,V/V)、二氯甲烷/正己烷(2∶3,V/V)和二氯甲烷/正己烷(3∶2,V/V)进行淋洗。结果发现,采用二氯甲烷/正己烷(2∶3,V/V)时回收率最高,萘的回收率为91.5%,其余PAHs回收率均在95%以上,同时色谱峰形尖锐,对称性好。改变淋洗液的用量,观察回收率的变化,结果发现,当淋洗液体积为5 mL时,各PAHs回收率均已达到90%以上;继续加大淋洗液体积,PAHs回收率反而稍有下降。因此最终确定采用5 mL二氯甲烷/正己烷(2∶3,V/V)进行淋洗。
样品前处理时有多个氮气吹干处理步骤,可能会导致PAHs损失。对浓度约为10 μg/mL的18种PAHs混标溶液进行氮气吹干处理,测定其回收率,结果发现,萘的回收率为96.4%,其余PAHs回收率均大于98.5%。可见氮气吹干步骤导致的损失可忽略不计。
2.3 色谱分离条件的优化
选择最大吸收波长进行检测有利于提高检测灵敏度,为确定每种PAHs的检测波长,在190~700 nm范围内,测定每种PAHs标准溶液的紫外-可见吸收光谱,确定其最大吸收波长。对每种PAHs,均采用其最大吸收波长作为检测波长,结果见表3。
分别采用Inertsil ODS-P色谱柱和多种规格的Shimadzu Shim-pack SR-ODS色谱柱对18种PAHs混标进行分离。Shimadzu Shim-pack SR-ODS色谱柱是通用型色谱柱,改变其规格、洗脱梯度、流动相组成,均不能将18种PAHs完全分离。Inertsil ODS-P色谱柱是专用于分离PAHs的色谱柱,通过对分离条件的优化,可将18种PAHs完全分离。
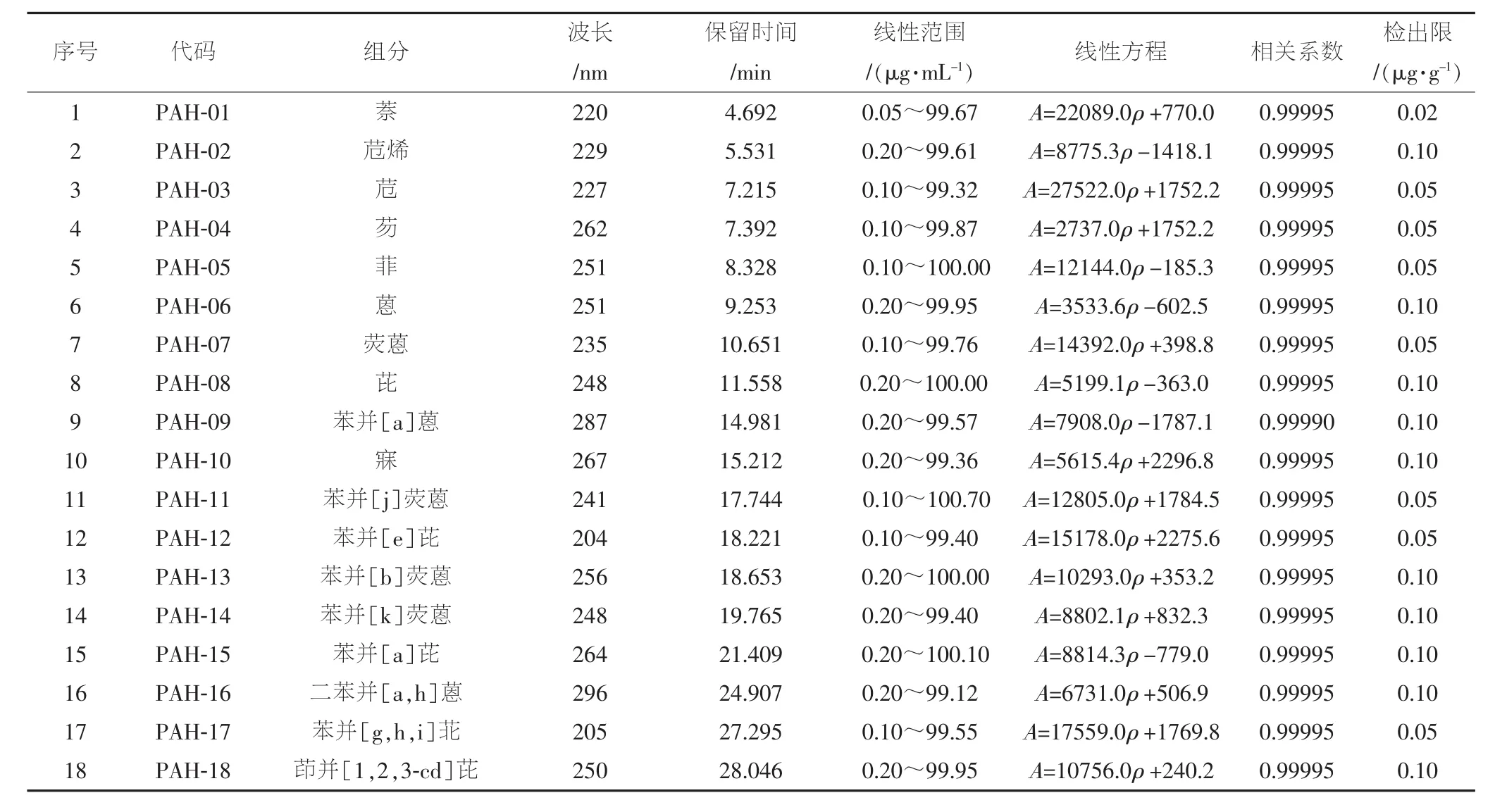
表3 18种PAHs的线性关系和检出限
分别采用乙腈/甲醇/水、乙腈/水和甲醇/水等3种流动相进行分离,考察分离效果。结果发现,当流动相为乙腈/水时,分离效果最好,各组分间均达到基线分离。
色谱柱温直接影响分离效果,柱温较低时,色谱柱压力较大,柱温上升时,色谱柱压力随之下降,但分离效果却稍微下降。经对比实验,发现当柱温为50℃时,分离效果较好。
流速也直接影响分离效果,流速较小时,目标化合物的保留时间增加,峰形展宽,分离度下降,但色谱柱的柱压较小;流速增大时,目标化合物的保留时间减少,峰形变窄,分离度下降,同时色谱柱的柱压明显上升。在18种PAHs中,有几组PAHs的保留时间非常接近,当流速恒定时很难将其完全分离。在不同洗脱阶段,改用不同的流速,有助于改善分离效果。经对比,发现采用1.3节中分析条件时,18种PAHs均能完全分离,且各谱峰峰形对称性好,峰形尖锐,图1是18种PAHs混标的液相色谱(HPLC)谱图(图中峰号同表3)。
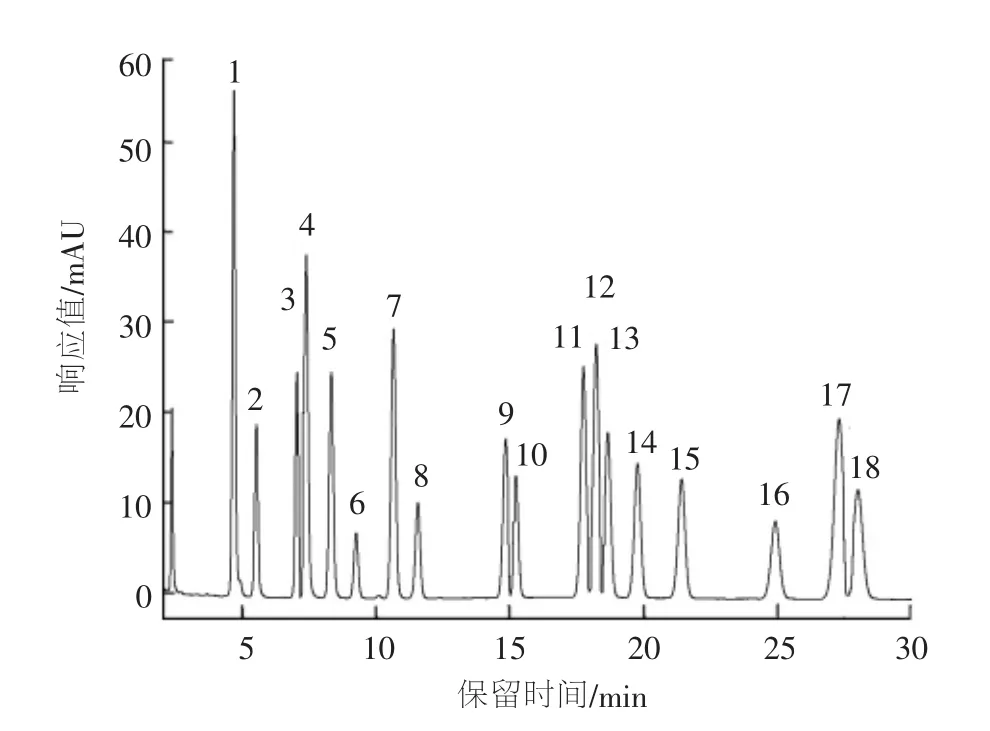
图1 18种PAHs混标的HPLC谱图
2.4 工作曲线和检出限
以不含目标分析物的白纸的萃取液作为空白基质,将PAHs混标逐级稀释,配制成11个不同浓度的混标溶液,按建立的方法进行测试。结果发现,在各自质量浓度范围内,18种PAHs的峰面积(A)与质量浓度(ρ)之间存在良好的线性关系,且相关系数均大于0.999 9。表3给出了各目标化合物的线性关系。在信噪比(S/N)=3的条件下,确定各目标化合物的检出限,也列于表3中。
2.5 方法的回收率和精密度
以不含目标化合物的白纸为空白样品,分别添加低、中、高等3个浓度水平的混标,每个浓度水平制备9个平行样,按1.2节进行前处理,按1.3节条件进行测试,计算各组分的平均回收率及精密度,结果见表4。
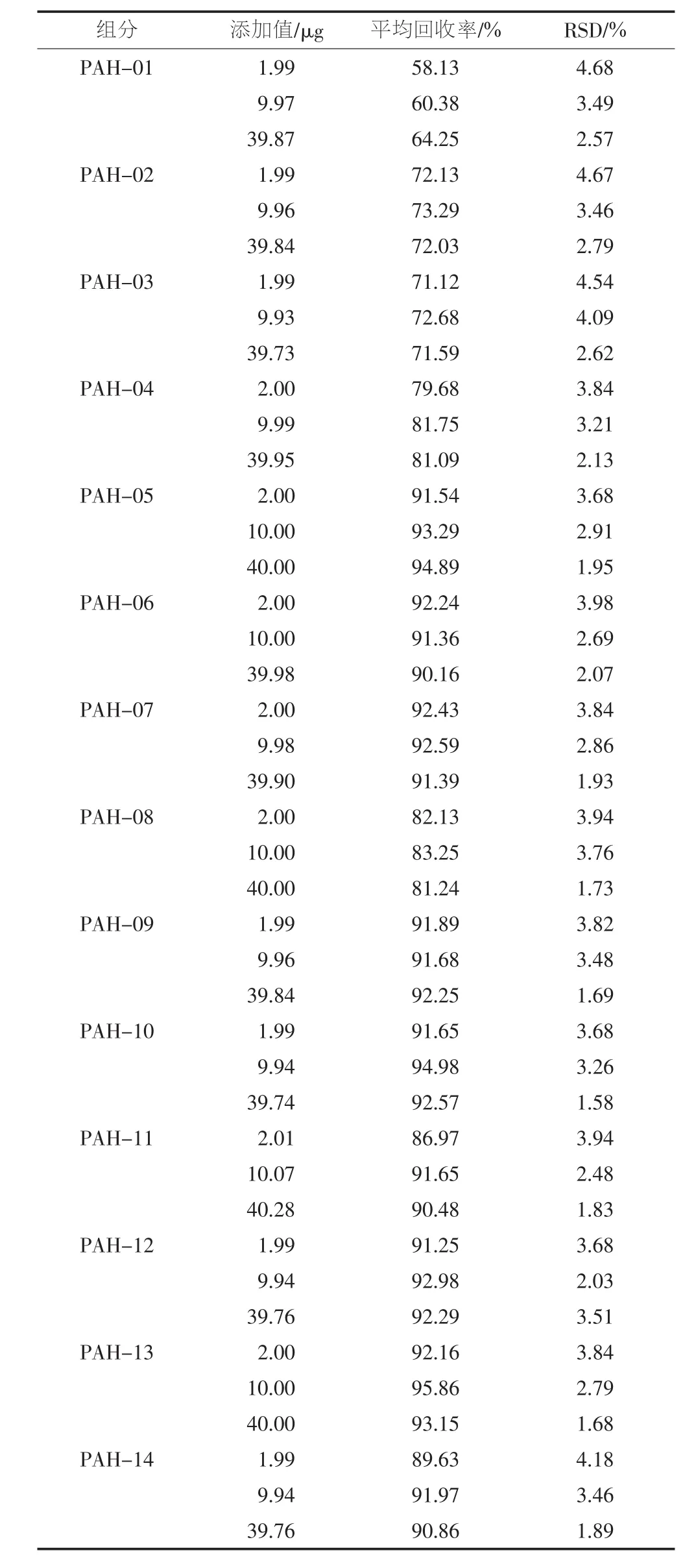
表4 空白样品中18种PAHs的加标回收率
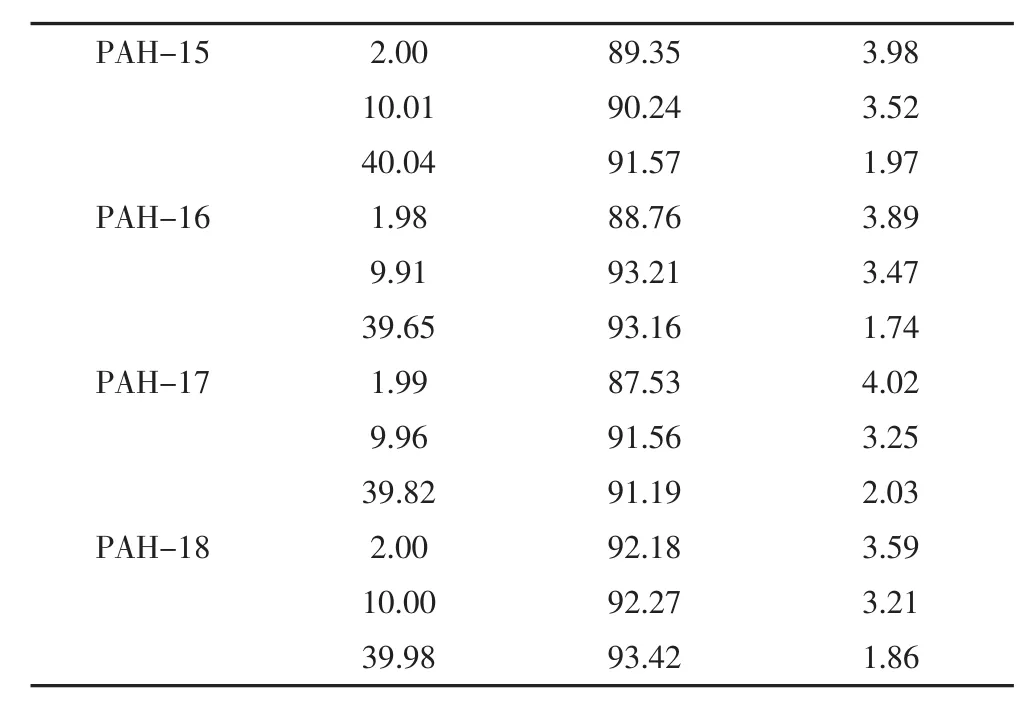
PAH-15 PAH-16 PAH-17 PAH-18 2.00 10.01 40.04 1.98 9.91 39.65 1.99 9.96 39.82 2.00 10.00 39.98 89.35 90.24 91.57 88.76 93.21 93.16 87.53 91.56 91.19 92.18 92.27 93.42 3.98 3.52 1.97 3.89 3.47 1.74 4.02 3.25 2.03 3.59 3.21 1.86
2.6 实际样品测定
采用本文建立的方法对市售纸质食品接触材料中的PAHs含量进行测定。测定样品分别为面点王餐垫、必胜客比萨包装纸盒、肯德基外带全家桶包装纸桶、肯德基川香双层鸡腿堡包装纸盒、麦当劳麦辣鸡腿汉堡红色包装纸盒、五谷道场桶装方便面包装纸桶、康师傅桶装方便面包装纸桶、统一老坛酸菜牛肉面包装纸盒、美赞臣安儿宝全新3袋装包装纸盒(分别印有粉红色和红色图案)、东莞绿赏纸杯(印有蓝色铃兰图案)、希艺欧绿色环保纸杯(分别印有红色心形图案、绿色铃兰图案、粉红色铃兰图案以及素色纸杯)、再生包装纸袋(分别为米黄色、灰色和米白色)、黄色包装纸袋和涂蜡纸杯,结果在米黄色再生包装纸袋中检出高含量的菲,其含量为217.1 mg/kg,见图2(图中峰号“1”为菲)。
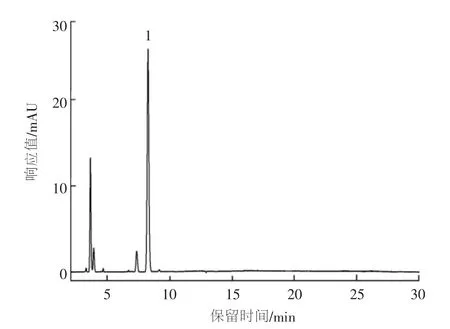
图2 实际样品的HPLC谱图
3 结束语
采用超声萃取技术提取纸质食品接触材料中的PAHs,提取液经硅胶固相萃取柱净化后进行超高效液相色谱分析,由此建立的同时测定纸质食品接触材料中18种禁用PAHs的分析方法简便快速、灵敏度高、定性定量准确,可满足多环芳烃检测的技术要求,适用于纸质食品接触材料中多环芳烃的测定。参考文献:
[1]余集锋.浅谈食品包装用纸中有毒有害物质的来源及危害[J].湖北造纸,2007(2):36-38.
[2]黄崇杏,王志伟,王双飞.纸质食品包装材料中的残留污染物[J].包装工程,2007,28(7):12-15.
[3]许洁玲,王勃,许思昭,等.食品纸质包装材料中的有害物质的产生与分析[J].现代食品科技,2009,25(9):1083-1087.
[4]黄大川.食品包装材料对食品安全的影响及预防措施探讨[J].食品工业科技,2007(4):188-190.
[5]刘浩,赵笑虹.食品包装材料安全性分析[J].中国食物与营养,2009(5):13-13.
[6]韦苇,刘红清,陈震华.食品用纸的安全分析[J].广西轻工业,2010 (9):17-18.
[7]董晓雪.纸制食品容器和包装材料的卫生学调查[J].中国热带医学,2008,8(4):694-694.
[8]岳青青.纸质包装材料中可能存在的有害物质及其迁移研究现状[J].华东纸业,2011,42(4):61-64.
[9]申松梅,曹先仲,宋艳辉,等.多环芳烃的性质及其危害[J].贵州化工,2008,33(3):61-63.
[10]Directive 2005/69/EC of the european parliament and of the council of 16 november 2005 amending for the 27th time council directive 76/769/EEC on the approximation of the laws,regulation and administrative provisions of the member states relating to restrictions on the marketing and use of certain dangerous substances and preparation(polycyclic aromatic hydrocarbons in extender oils and tyres)[J].OfficialJournaloftheEuropeanUnion,2005,L323:51-54.
[11]Commission Regulation(EC)No 1881/2006 of 19 December 2006 setting maximum levels for certain contaminants in foodstuffs(Text with EEA relevance)[J].Official Journal of the European Union,2006,L364:1-26.
[12]Commission Regulation(EC)No 835/2011 of 19 August 2011 amending Regulation(EC)No 1881/2006 as regards maximum levels for polycyclic aromatic hydrocarbons in foodstuffs(Text with EEA releance)[J].Official Journal of the European Union,2011,L254:4-8.
[13]Van Emon J M,Gerlach,C L.A status report on field-portable immunoassay[J].Environ Sci Technol,1995,29(7):312A-317A.
[14]Barcelo D,Oubina A,Salau J S,et al.Determination of PAH in river water samples by ELISA[J].Analytica Chimica Acta,1998,376:49-53.
[15]张晓翔,李晓东,侯可男,等.飞行时间质谱仪在线检测多环芳烃[J].分析化学,2010,38(6):859-863.
[16]冼燕萍,罗海英,郭新东,等.冷冻去脂-液液分配净化/气相色谱-质谱法测定化妆品中16种多环芳烃[J].分析试验室,2013, 32(1):85-89.
[17]高军刚,孔祥虹,何强,等.气相色谱-串联质谱法测定大豆提取物中16种多环芳烃和16种邻苯二甲酸酯类[J].分析试验室,2013,32(5):65-70.
[18]祝本琼,陈浩,李胜清.基于轻质萃取剂的溶剂去乳化分散液-液微萃取-气相色谱法测定水样中多环芳烃[J].色谱,2012,30(2):201-206.
[19]冯精兰,申君慧,翟梦晓,等.超声萃取-高效液相色谱测定沉积物中的多环芳烃[J].河南师范大学学报(自然科学版),2011,39(6):88-91.
[20]谢云飞,王旭,阮伟东,等.表面增强拉曼光谱技术在多环芳烃检测中的应用[J].光谱学与光谱分析,2011,31(9):2319-2323.
[21]尹雪峰,李晓东,尤孝方,等.红外光谱法分析聚乙烯热解和燃烧产物中多环芳烃分布特性[J].热力发电,2005,34(4):20-23.
[22]张伟,周娜,李呐,等.低温恒能量同步荧光法同时快速检测食品中多种多环芳烃[J].光谱学与光谱分析,2009,29(10):2806-2809.
[23]蒋一昕,汪蓉,商贵芹,等.SN/T 2201-2008.食品接触材料辅助材料油墨中多环芳烃的测定气相色谱-质谱联用法[S].北京:中国标准出版社,2009.
[24]曹国庆,姜晓黎,翁若荣,等.SN/T 2202—2008.食品接触材料蜡食品模拟物中多环芳烃的测定[S].北京:中国标准出版社,2009.
[25]黄炳国,姜晓黎,翁若荣,等.SN/T 2203—2008.食品接触材料木制品类食品模拟物中多环芳烃的测定[S].北京:中国标准出版社,2009.
[26]汤志旭,牛增元,庞士平,等.S N/T 2279—2008.食品接触材料塑料食品模拟物中多环芳烃的测定高效液相色谱法[S].北京:中国标准出版社,2009.
[27]董广彬,郑顺利,王春燕,等.GB/T 22509—2008.动植物油脂苯并(a)芘的测定反相高效液相色谱法[S].北京:中国标准出版社,2009.
[28]International Organization for Standardization.ISO 15302-2007. Animal and vegetable fats and oils-determination of benzo(a)pyrene-reverse-phase high performance liquid chromatography method[S].Switzerland:HIS,2007.
[29]王成云,唐丽莉,林君峰,等.超声萃取-气相色谱/质谱-选择离子监测法同时测定涂布纸中21种邻苯二甲酸酯类增塑剂[J].造纸科学与技术,2012,31(6):115-120.
[30]王成云,谢堂堂,杨左军,等.超高效液相色谱法测定纺织品中三氯生的含量[J].分析测试学报,2010,29(12):1231-1234.
Rapid Determ ination of 18 Banned Polycyclic Aromatic Hydrocarbons in Paper Packaging Materials Intended to Comeinto Contact with Foodstuffs
YANG Zuo-jun,WANG Cheng-yun,XU Rong,GU Hao-fei,LIAO Wen-zhong,ZHANG Chun-yan,CHEN Jian
(Testing and Technology Center for Industrial Products,Shenzhen Entry-Exit Inspection and Quarantine Bureau,Shenzhen 518067,China)
An effective method was established for simultaneous determination of 18 banned polycyclic aromatic hydrocarbons(PAHs)in paper packaging materials intended to come into contact with foodstuffs.PAHs in paper packaging materials intended to come into contact with foodstuffs were ultrasonically extracted at 40℃,using hexane/ acetone(1∶1,V/V)as solvent.Then the extract was purified using silica solid-phase extraction column and analyzed by ultra-high performance liquid chromatography.The concentration of each analyte was calibrated by external standard method.The detection limits varied from 0.02 mg/kg to 0.10 mg/kg at the condition with signal noise ratio(S/N)of 3 while the correlation coefficients were all larger than 0.999 9.The spiked average recoveries were changed from 58.13%to 95.86%while the relative standard deviations(RSDs)were varied from 1.58%to 4.68%.The proposed method was successfully applied to the determination of polycyclic aromatic hydrocarbons in commercially available paper packaging materials intended to come into contact with foodstuffs and high content of phenanthrene was detected in a sample.The proposed method was rapid,simple,sensitive and accurate,in both quantitative and qualitative analysis,whichmetwiththetechnologyrequirementofpolycyclicaromatichydrocarbonstesting,andwasapplicableforthe determination ofpolycyclicaromatic hydrocarbons in paper packaging materials intended to come into contact with foodstuffs.
paper packaging materials intended to come into contact with foodstuffs;polycyclic aromatic hydrocarbons;ultra-high performance liquid chromatography;ultrasonic extraction;rapid determination
TS77
A
1007-2225(2014)01-0009-06
杨左军先生(1966-),高级工程师;主要从事轻纺产品中有毒有害物质分析;E-mail:yangzuojun2009 @163.com。
2013-11-15(修回)
国家认监委科研制标项目(2011B431)
本文文献格式:杨左军,王成云,徐嵘,等.纸质食品接触材料中18种禁用多环芳烃的快速测定[J].造纸化学品,2014,26(1):9-14.

