p53调控Nfkbiz基因表达的研究
杨逸凡,杜立中,朱紫祥,李 满,,魏建超,史子学,邵东华,李蓓蓓,马志永
(1.中国农业科学院上海兽医研究所,上海 200241;2.南京农业大学,南京 210095)
p53调控Nfkbiz基因表达的研究
杨逸凡1,杜立中2,朱紫祥1,李 满1,2,魏建超1,史子学1,邵东华1,李蓓蓓1,马志永1
(1.中国农业科学院上海兽医研究所,上海 200241;2.南京农业大学,南京 210095)
核因子-κB(NF-κB)在炎症反应中起着关键的促进作用,并且受其他多种因素的调节。Nfkbiz基因编码的IκBζ蛋白是IκB家族成员之一,在炎症反应中起着调节NF-κB的作用。本研究采用荧光实时定量PCR分析Nfkbiz基因的表达情况,发现在p53特定刺激源作用下Nfkbiz基因mRNA丰度显著降低。分析Nfkbiz基因序列,发现其基因中存在可能的p53反应元件,通过构建荧光素酶报告质粒及双荧光素酶报告试验和染色质免疫共沉淀试验,证明Nfkbiz基因中含有p53反应元件并且受p53蛋白调节。以上结果初步证明Nfkbiz是受p53蛋白负向调控的靶基因。
p53 蛋白;Nfkbiz 基因;NF-κB;靶基因
NF-κB是调控炎症反应重要的转录因子,许多促炎性细胞因子和趋化因子的转录都依赖于NF-κB信号通路的激活[1]。NF-κB根据不同的受体识别不同的刺激信号,通过经典途径或旁路途径激活后,进入细胞核发挥转录调控作用,促进一系列促炎性细胞因子如IL-6、IL-8、IL-12、GM-CSF、M-CSF等的合成及释放。近年来,NF-κB信号通路中非典型性成员在NF-κB信号通路的作用成为研究热点[2]。如IκBζ自从2000年被作为脂多糖诱导的拥有核锚重复序列的分子(Mail)发现以来,关于它的研究越来越多。IκBζ拥有核锚重复序列而被归为IκB家族成员,随后发现其能通过TLRs及IL-1R信号通路激活,具有促进IL-6分泌的活性[3,4]。与IκBζ家族其他经典成员如IκBα、IκBβ所不同的是,IκBζ位于细胞核内,而不是位于胞浆内与游离的NF-κB成员结合调控NF-κB解离后激活入核,它是以非典型的方式调控NF-κB对下游基因的转录作用,在细胞核内以辅因子通过与NF-κB的p50亚基结合,抑制或者激活NF-κB二聚体对特定基因的转录活性[2,5]。正是由于IκB非典型性成员这种对NF-κB既具有促进又具有抑制的双相作用[5,6],非典型成员在调节炎症反应中的作用得到不断的重视。同时,最新的研究表明IκBζ对NK细胞的激活、Th17细胞的发育都发挥着重要的作用[7,8]。
有研究表明p53在抑制炎症反应中也有其独特的作用[9,10]。p53能够抑制TNF-α通过NF-κB信号通路诱导的大部分基因的转录。外源性p53蛋白能够抑制NF-κB依赖性启动子的转录。通过野生型小鼠和p53缺失型小鼠对炎症反应刺激物的比较,发现p53缺失型小鼠对LPS高度敏感,组织上呈现高水平的炎症反应,其体内巨噬细胞激活数量增加,中性粒细胞清除延迟。而野生型小鼠由于能够抑制编码促炎性细胞因子和趋化因子基因的转录,减少活性氧与蛋白质氧化产物的积累,炎症反应表现轻微[10]。
p53与NF-κB的交互调节存在多种的调控模式,有研究报道p53通过与NF-κB亚基之一p65竞争性结合转录共激活因子p300/CBP,抑制NF-κB的转录活性[11];p53也能通过其下游靶基因产物p21对p65亚基上的磷酸化影响其与p300共激活因子的结合[12];同时,p53也能通过抑制IKK及组蛋白H3激酶活性抑制NF-κB的转录活性[13];最近研究发现p53可通过下游靶基因产物MDM2对p65亚基进行泛素化抑制其转录活性[14]。
通过对流感病毒感染小鼠肺组织进行ChIP-seq测序发现,Nfkbiz基因(IκBζ的编码基因)有可能与p53相结合,p53可能通过调控Nfkbiz的表达而影响NF-κB在炎症反应中的作用,但是p53如何调控Nfkbiz的表达并不清楚。本文就p53是否对Nfkbiz具有转录调控作用开展了研究。
1 材料与方法
1.1 细胞与试剂Raw264.7细胞、NIH/3T3细胞、4T1细胞购买自中国科学院上海细胞保藏中心;脂多糖(Lipopolysaccharides,LPS)、5-氟尿嘧啶(5-Fluorouracil,5-FU)、阿霉素(Doxorubicin,Dox)均购买自Sigma-Aldrich;M-MLV反转录酶、RNA酶抑制剂购自Invitrogen公司;DNA凝胶回收试剂盒、质粒小提试剂盒均购买自Axygen公司;RNAisol Plus、Oligo dT 寡聚核苷酸、LA Taq酶、6 bp 随机引物、dNTPs、rTaq 酶、SYBR®Premix Ex Taq™ (Tli RNaseH Plus)购买自宝生物工程(大连)公司;pCMV-p53购买自Clontech公司;X-tremeGENE HP 转染试剂购自Roche公司;pGL3-Basic质粒及pRL-TK质粒、双荧光素报告检测系统均购买自Promega公司。
1.2 质粒的制备pCMV由pCMV-p53质粒经突变PCR得来,方法见文献[15]。pCMV-Trp53质粒制备:由带有Hind III/EcoR I的引物扩增Trp53基因的开放阅读框,上游引物5'- CGCAAGCTTATGACTGCC-3'、下游引物5'- CCGGAATTCTCAGTCTGAGT-3',然后连接pCMV载体。p-Nfkbiz RE1-Luc质粒由扩增Nfkbiz基因+8947~+8969调控序列连接至pGL3-Basic质粒,Δp-Nfkbiz RE1-Luc质粒中缺失调控序列中+8947 ~ +8969位置的核苷酸。
1.3 RNA的提取及制备cDNA6孔板培养细胞,弃培养液,用PBS洗涤2次后,每孔加入1mL RNAisol Plus后反复吹打裂解,之后按照说明书进行操作,最后用20 μL DEPC水溶解并测定RNA浓度。按照1 μg RNA、1 μL 100 pmol/μL 6 bp 随机引物、0.5 μL Oligo dT寡聚核苷酸、4 μL 2.5 mmol/L dNTPs,4 μL 5×First buffer、2 μL 0.1mol/L DTT、1 μL RNA酶抑制剂、1 μL M-MLV,补DEPC水至20 μL。离心后按照25℃ 10 min、37℃ 60 min、75℃15 min、4℃10 min的反应程序进行反应。
1.4 荧光实时定量PCR获得的cDNA按照SYBR®Premix Ex Taq™ (Tli RNaseH Plus)试剂说明书操作配制反应体系,在ABI 7500 Real-Time PCRSystem(Life technology)进行实时荧光定量PCR反应,利用甘油醛-3-磷酸脱氢酶基因GAPDH作为内参基因,进行多基因mRNA的相对定量。用7500 System Software对数据进行分析。扩增引物见表1。
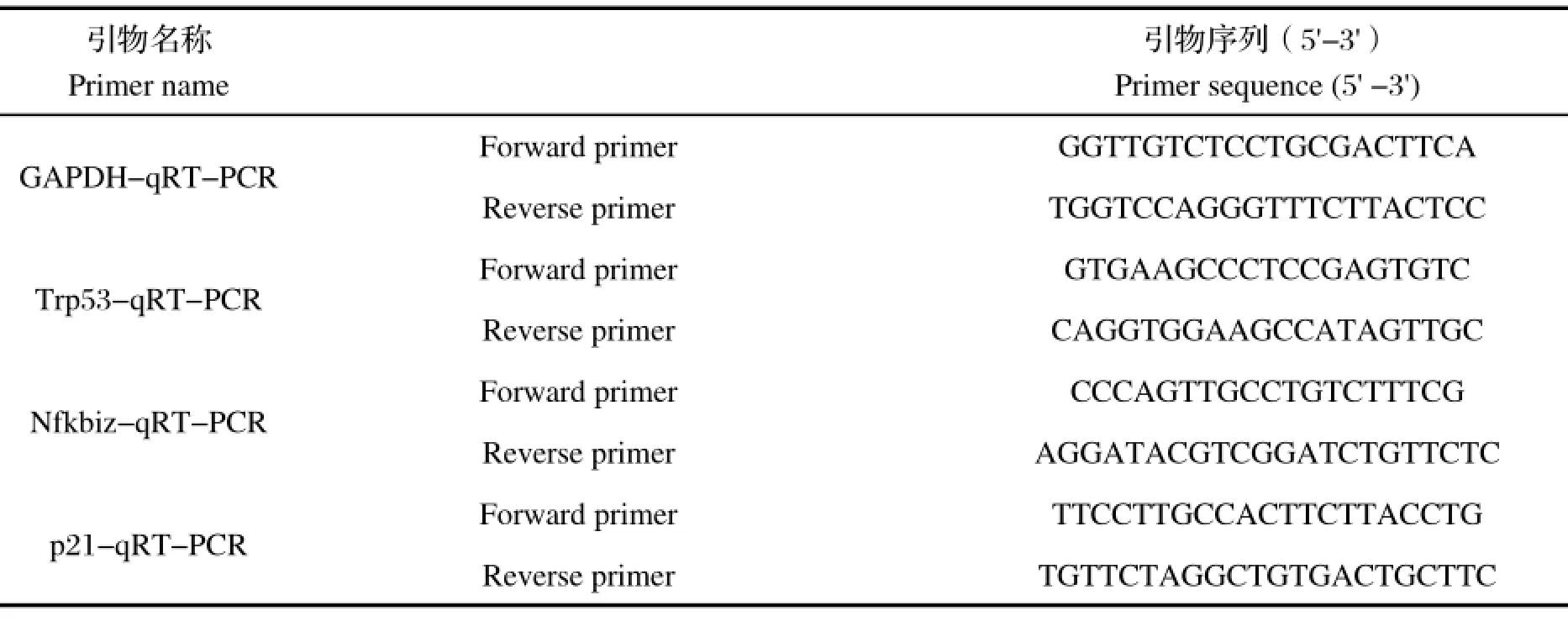
表1 实时定量引物序列Table 1 qRT-PCR primers used in this study
1.5 荧光素酶活性试验将NIH/3T3细胞接种24孔板,当细胞生长至孔底70%时,转染构建的荧光素酶报告质粒p-Nfkbiz RE1-Luc或Δp-Nfkbiz RE1-Luc和pRL-TK(10:1),6 h后用Nutlin-3 按照每孔10 μmol/L处理24 h后收取细胞。将4T1细胞接种24孔板,当细胞生长至孔底60%时,共转染pcMV-Trp53与构建的荧光素酶报告质粒和pRL-TK(10:1),24 h收取细胞。细胞样品按照双荧光素报告检测系统试剂盒说明进行检测,检测p53对Nfkbiz基因转录激活的影响,以Rellina酶活性值为内参进行比较,所得数据进行t-test检验统计学分析。
1.6 染色质免疫共沉淀试验Raw264.7细胞按照2×107接种于150 mm 培养皿,12 h后,用10 μg/mL 5-FU处理细胞24 h,按照染色质免疫共沉淀试剂盒(Millipore)说明处理细胞样品,得到DNA样品。
2 结果
2.1 p53抑制Nfkbiz基因转录通过过表达p53,使得p53在细胞核内聚集,研究Nfkbiz mRNA含量的变化。用p53特异性刺激剂5-FU[16]处理Raw264.7细胞,发现Nfkbiz基因转录水平在5-FU刺激条件下发生了下降,如图1A所示。此外,在特异性刺激剂Dox[17](如图1B)和Nutlin-3[18](图1C)处理下Nfkbiz基因转录水平也有相同的变化。同时,选取被证实为受p53转录激活调控的靶基因p21基因[19]作为阳性对照。LPS能促进Nfkbiz的表达[4],在LPS处理下,同时使用5-FU和Dox增加p53在细胞中含量,如图2所示,Nfkbiz mRNA表达受到抑制的现象更为明显。
2.2 p53转录调控Nfkbiz的序列分析实时荧光定量的结果发现p53能够抑制Nfkbiz mRNA的水平,p53作为转录因子,一般通过直接与靶基因上相对保守的序列结合,继而发挥转录调控作用[20]。p53是否对Nfkbiz存在着转录调控而降低mRNA的水平?继而对Nfkbiz基因序列进行分析,推导p53潜在靶基因的结合基序,发现Nfkbiz中可能存在p53反应元件(p53 response element,p53 RE)。如图3A所示,在转录起始位点后+8947~+8969位置,与p53经典的结合序列类似,p53经典结合序列一般为2个RRRCWWGYYY的十聚体组成,中间间隔0~13个碱基[21]。
推测出潜在的p53结合位点后,进一步构建了含p53 RE的双荧光素报告基因系统,并同时构建对应的缺失突变体质粒(图3B)。同时使用含有p21荧光素酶报告基因质粒p-p21-Luc作为转录激活阳性对照。
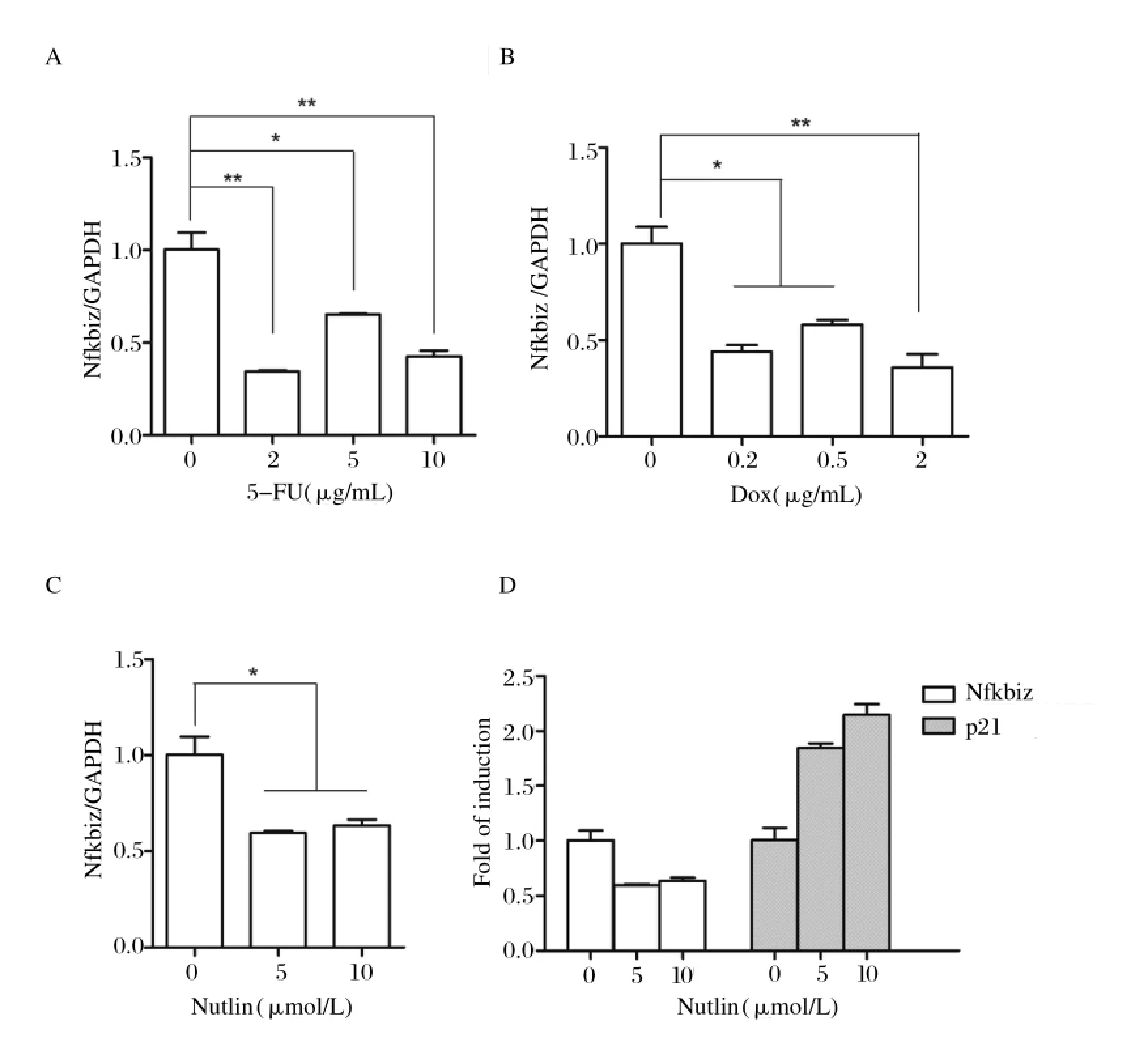
图1 p53刺激剂(5-FU、Dox、Nutlin)处理Raw264.7细胞后Nfkbiz mRNA的含量变化Fig.1 Nfkbiz mRNA expression levels in Raw264.7 cells treated with different concentration of p53 stimulus (5-FU, Dox, Nutlin-3) for 24 h
2.3 Nfkbiz基因中p53RE1基序是p53结合的靶位点通过双荧光素酶报告试验,表明含有Nfkbiz p53RE1的荧光素酶报告质粒的荧光值受到p53的转录抑制,而将这一基序缺失后发现荧光值得到回升(图4A、4B),说明p53通过与Nfkbiz基因p53RE1区域的结合而发挥转录抑制作用,将这一基序缺失后,p53对Nfkbiz的转录抑制作用丧失。
为了进一步证明p53是否直接与Nfkbiz基因推测的p53RE1基序结合,用染色质免疫共沉淀试验(ChIP assay)展开进一步研究,对ChIP得到的DNA样品进行PCR扩增,PCR产物回收后送Invitrogen公司测序。研究发现,如图4C所示,p53能够直接与Nfkbiz的p53RE1中+8947~+8969核苷酸序列直接发生结合作用。这表明Nfkbiz的p53RE1就是p53结合的靶位点。
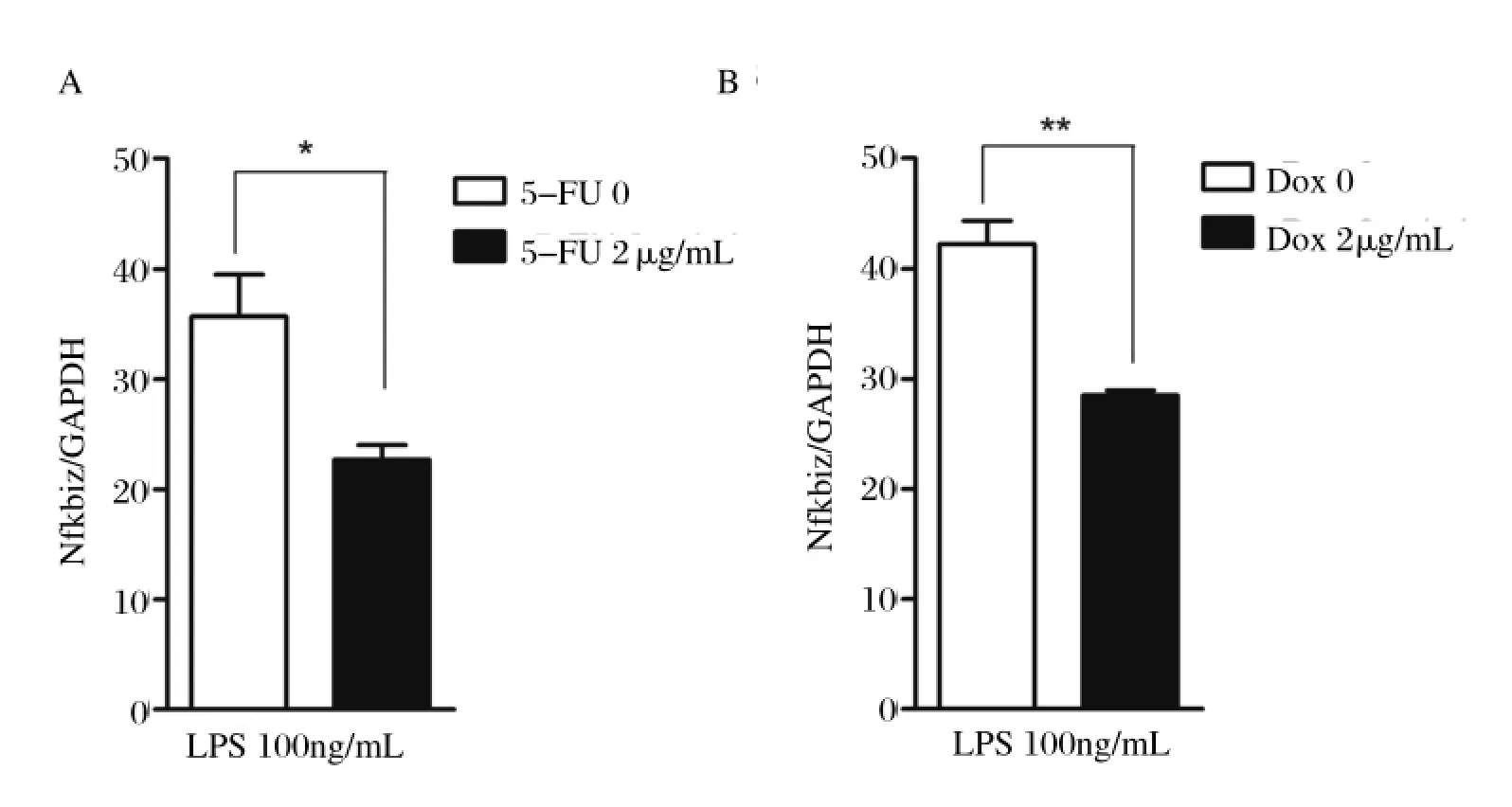
图2 5-FU和Dox分别处理Raw264.7细胞24 h后,再以LPS处理Raw264.7细胞6 h后Nfkbiz mRNA 表达含量变化Fig.2 Nfkbiz mRNA expression levels in Raw264.7 cells under the treatment of LPS for 6 h after treated with 5-FU or Dox for 24 h
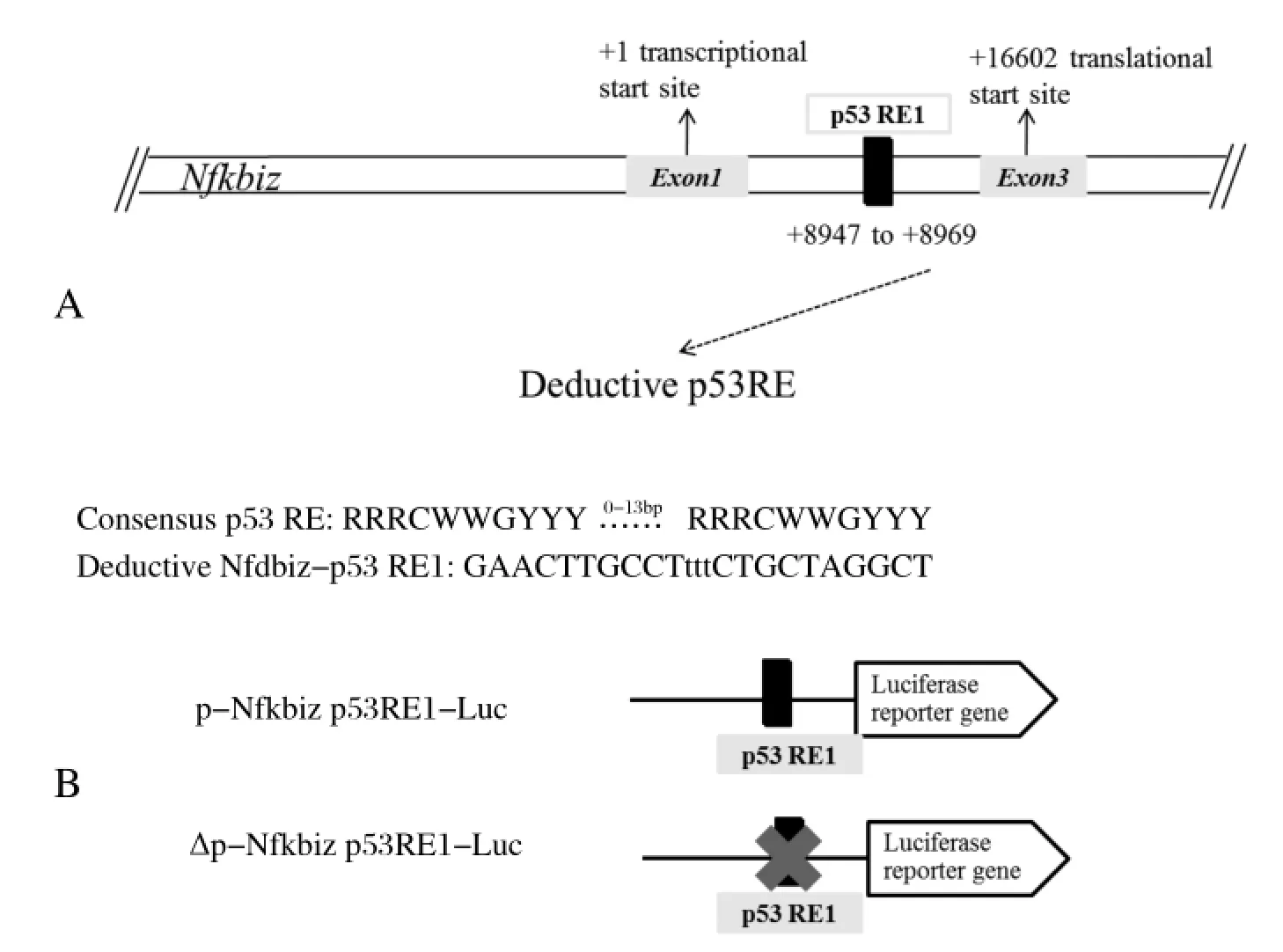
图3 Nfkbiz基因中p53反应元件序列分析及荧光素酶报告基因的构建Fig.3 Analysis of the potential p53 response element in Nfkbiz gene and construction of Luciferase plasmids containing p53 RE

图4 p53与Nfkbiz 基因中p53反应元件的结合证明Fig.4 Demonstration of binding between p53 trans factor and p53 response element in Nfkbiz gene
3 讨论
p53蛋白与NF-κB作为细胞对内外应激感应的分子,有着各自庞大的信号网络,能及时对各种刺激信号做出应答,维持细胞、组织和机体的相对稳定。但p53与NF-κB激活后主要引起的细胞效应却迥然不同,或者可以说是相反的。NF-κB通过抵抗细胞凋亡以及刺激细胞生长从而促进细胞的生存;p53激活后的效应却是抑制生长,根据不同的细胞类型以及应激的种类和强度,致使细胞周期停滞、衰老、或者凋亡[22]。在肿瘤发生过程,常常伴随着p53因为突变而失去正常活性,而NF-κB保持着一定水平的活性,因此在癌症的治疗过程中,那些能够激活p53而抑制NF-κB活性的药物分子逐渐成为研究的焦点[23]。
本试验前期通过ChIP-seq对流感病毒感染小鼠肺组织进行测序,发现p53可能与Nfkbiz基因发生结合,推测p53可能通过调控Nfkbiz影响NF-κB在炎症反应中的作用。由于正常细胞中p53的半衰期很短,仅6~20 min,非常不稳定。通过使用p53特异性刺激源处理p53野生型细胞,使得p53在细胞核中得以聚集,得以观察p53对下游基因的转录调控作用。本试验首先发现p53能够在过表达状态下降低Nfkbiz mRNA的表达水平,在生理水平—Nfkbiz未受到刺激时(图1)以及炎性水平—Nfkbiz受到刺激而引起表达含量上升时(图2),均发现p53能够引起Nfkbiz mRNA含量的显著下降。分析Nfkbiz基因序列时,发现了p53潜在的结合反应元件Nfkbiz p53RE1位于Nfkbiz内含子+8947~+8969位置。p53作为转录因子,与其特异性结合并具有功能的DNA基序可能位于启动子区域[24],也可能位于内含子区域[25-27],也有可能远离靶基因的位置。有报道在FLJ11259基因上游22.3kb处发现有功能活性的p53RE[28]。通过构建包含Nfkbiz p53RE1及缺失p53RE1的荧光素酶报告质粒进行的Luciferase试验(图4A、4B),发现Nfkbiz基因中的p53RE1确实是具有生物功能活性的反应元件,并且对p53的转录效应呈现转录抑制作用。这就解释了p53能够降低Nfkbiz mRNA含量的现象。p53通过与基因组中Nfkbiz内含子中有活性的p53RE1结合,发挥转录抑制作用,阻止Nfkbiz基因的转录,从而降低了Nfkbiz mRNA的含量。在ChIPPCR的进一步验证下,p53确实能够与Nfkbiz基因中+8947~+8969区域发生直接结合作用。以上结果表明,Nfkbiz为p53负调控的靶基因。
通过上述研究,我们对p53蛋白在机体如何抑制炎症反应中发挥作用提供了一个研究方向,为全面揭示p53的分子生物学功能提供了数据。
[1] Hayden M S, Ghosh S. NF-kappaB in immunobiology[J]. Cell Res, 2011, 21(2): 223-244.
[2] Ghosh S, Hayden M S. New regulators of NF-kappaB in inflammation[J]. Nat Rev Immunol, 2008, 8(11): 837-848.
[3] Kitamura H, Kanehira K, Okita K,et al. MAIL, a novel nuclear I kappa B protein that potentiates LPS-induced IL-6 production[J]. FEBS Lett, 2000, 485(1): 53-56.
[4] Yamazaki S, Muta T, Takeshige K. A novel IkappaB protein, IkappaB-zeta, induced by proinflammatory stimuli, negatively regulates nuclear factor-kappaB in the nuclei[J]. J Biol Chem,2001, 276(29): 27657-27662.
[5] Yamamoto M,Takeda K. Role of nuclear IkappaB proteins in the regulation of host immune responses[J]. J Infect Chemother, 2008, 14(4): 265-269.
[6] Motoyama M,Yamazaki S, Eto-Kimura A,et al. Positive and negative regulation of nuclear factor-kappaB-mediated transcription by IkappaB-zeta, an inducible nuclear protein[J]. J Biol Chem,2005, 280(9): 7444-7451.
[7] Miyake T, Satoh T, Kato H,et al. IkappaBzeta is essential for natural killer cell activation in response to IL-12 and IL-18[J]. Proc Natl Acad Sci U S A, 2010, 107(41): 17680-17685.
[8] Okamoto K, Iwai Y, Oh-Hora M,et al. IkappaBzeta regulates T(H)17 development by cooperating with ROR nuclear receptors[J]. Nature, 2010, 464(7293): 1381-1385.
[9] Martinez-Cruz A B, Santos M,Garcia-Escudero R,et al. Spontaneous tumor formation in Trp53-deficient epidermis mediated by chromosomal instability and inflammation[J]. Anticancer Res, 2009, 29(8): 3035-3042.
[10] Komarova E A, Krivokrysenko V, Wang K,et al. p53 is a suppressor of inflammatory response in mice[J]. FASEB J, 2005, 19(8): 1030-1032.
[11] Ravi R, Mookerjee B, van Hensbergen Y,et al. p53-mediated repression of nuclear factor-kappaB RelA via the transcriptional integrator p300[J]. Cancer Res, 1998, 58(20): 4531-4536.
[12] Perkins N D, Felzien L K, Betts J C,et al. Regulation of NF-kappaB by cyclin-dependent kinases associated with the p300 coactivator[J]. Science,1997, 275(5299): 523-527.
[13] Kawauchi K, Araki K, Tobiume K,et al. Activated p53 induces NF-kappaB DNA binding but suppresses its transcriptional activation[J]. Biochem Biophys Res Commun, 2008, 372(1): 137-141.
[14] Heyne K, Winter C, Gerten F,et al. A novel mechanism of crosstalk between the p53 and NFkappaB pathways: MDM2 binds and inhibits p65RelA[J]. Cell Cycle, 2013, 12(15): 2479-2492.
[15] Li X, Qiu Y, Shen Y,et al. Splicing together different regions of a gene by modified polymerase chain reactionbased site-directed mutagenesis[J]. Anal Biochem,2008, 373(2): 398-400.
[16] De Angelis P M,Svendsrud D H, Kravik K L,et al. Cellular response to 5-fluorouracil (5-FU) in 5-FU-resistant colon cancer cell lines during treatment and recovery[J]. Mol Cancer, 2006, 5: 20.
[17] Aas T, Borresen A L, Geisler S,et al. Specific P53 mutations are associated with de novo resistance to doxorubicin in breast cancer patients[J]. Nat Med, 1996, 2(7): 811-814.
[18] Vassilev L T, Vu B T, Graves B,et al. In vivo activation of the p53 pathway by small-molecule antagonists of MDM2[J]. Science, 2004, 303(5659): 844-848.
[19] Wulf G M,Liou Y C, Ryo A,et al. Role of Pin1 in the regulation of p53 stability and p21 transactivation, and cell cycle checkpoints in response to DNA damage[J]. J Biol Chem,2002, 277(50): 47976-47979.
[20] Wang B, Xiao Z, Ren E C. Redefining the p53 response element[J]. Proc Natl Acad Sci U S A, 2009, 106(34): 14373-14378.
[21] Wang B, Xiao Z, Ko H L,et al. The p53 response element and transcriptional repression[J]. Cell Cycle, 2010, 9(5): 870-879.
[22] Feng Z, Hu W, Rajagopal G,et al. The tumor suppressor p53: cancer and aging[J]. Cell Cycle, 2008, 7(7): 842-847.
[23] Hwang S G, Park J, Park J Y,et al. Anti-cancer activity of a novel small molecule compound that simultaneously activates p53 and inhibits NF-kappaB signaling[J]. PLoS One, 2012, 7(9): e44259.
[24] Riley T, Sontag E, Chen P,et al. Transcriptional control of human p53-regulated genes[J]. Nat Rev Mol Cell Biol, 2008, 9(5): 402-412.
[25] Ashur-Fabian O, Har-Zahav A, Shaish A,et al. apoB and apobec1, two genes key to lipid metabolism,are transcriptionally regulated by p53[J]. Cell Cycle, 2010, 9(18): 3761-3770.
[26] Wang B, Niu D, Lai L,et al. p53 increases MHC class I expression by upregulating the endoplasmic reticulum aminopeptidase ERAP1[J]. Nat Commun, 2013, 4: 2359.
[27] Thornborrow E C, Patel S, Mastropietro A E,et al. A conserved intronic response element mediates direct p53-dependent transcriptional activation of both the human and murine bax genes[J]. Oncogene, 2002, 21(7): 990-999.
[28] Kerley-Hamilton J S, Pike A M,Hutchinson J A,et al. The direct p53 target gene, FLJ11259/DRAM,is a member of a novel family of transmembrane proteins[J]. Biochim Biophys Acta, 2007, 1769(4): 209-219.
THE REGULATORY ROLE OF P53 ON EXPRESSION OF NFKBIZ GENE
YANG Yi-fan1, DU Li-zhong2, ZHU Zi-xiang1, LI Man1,2, WEI Jian-chao1, SHI Zi-xue1, SHAO Dong-hua1, LI Bei-bei1, MA Zhi-Yong1
(1. Shanghai Veterinary Research Institute, CAAS, Shanghai 20041, China; 2. Nanjing Agreicultural University, Nanjing 210095, China)
The functional mechanism of p53 in inhibition of infl ammation is not well-understood. Nuclear factor-κB (NF-κB) plays a causative role in infl ammatory processes and regulated by many factors. IκBζ encoded by Nfkbiz gene is a member of IκB family and regulates the activity of NF-κB in infl ammation. Expression of Nfkbiz mRNA was analyzed in quantitative Real-time PCR. The results showed that expression of Nfkbiz was signifi cantly decreased in response to a specifi c p53 stimulus. Alignment of Nfkbiz gene with p53 response element revealed a potential p53 response element in the Nfkbiz gene. We conducted a luciferase report plasmid containing a potential p53 response element and found that Nfkbiz gene was negatively regulated by p53 protein. The binding of p53 to Nfkbiz gene was detected in chromatin immunoprecipitation assay. These data indicated that Nfkbiz gene was a target gene negatively regulated by p53.
p53 protein; Nfkbiz gene; NF-κB; target gene
S852.44
A
1674-6422(2014)03-0061-08
2014-03-21
国家自然科学基金项目(81171547;81371814)
杨逸凡,男,硕士研究生,预防兽医学专业;杜立中,男,硕士,高级兽医师,主要从事动物疾病的临床监测及预防
马志永,E-mail: zhiyongma@shvri.ac.cn

