日本血吸虫重组IAP蛋白的免疫保护效果评估
胡 超,罗 荣,刀金威,王宇清,赵江平,陆 珂,李 浩,刘金明,程国锋
(中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241)
日本血吸虫重组IAP蛋白的免疫保护效果评估
胡 超,罗 荣,刀金威,王宇清,赵江平,陆 珂,李 浩,刘金明,程国锋
(中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241)
为研究日本血吸虫凋亡蛋白抑制因子(inhibitor of apoptosis protein of Schistosoma japonicum,SjIAP)重组蛋白诱导BALB/c小鼠的免疫保护效果,利用PCR技术扩增SjIAP基因,构建重组表达质粒pET-28a(+)-SjIAP,诱导表达重组SjIAP蛋白,并利用重组蛋白制备兔源多克隆抗体血清。然后,选用SjIAP重组蛋白免疫BALB/c小鼠,利用ELISA检测免疫小鼠血清中的特异性抗体水平,以及免疫小鼠脾脏淋巴细胞在SjIAP重组蛋白刺激后产生的细胞因子水平。强化免疫后,将小鼠进行血吸虫尾蚴攻虫试验,感染38 d,进行剖杀,计算虫体减虫率及肝脏减卵率。Western blot结果表明本研究制备的兔源多抗血清能特异性识别SjIAP重组蛋白。ELISA检测表明免疫SjIAP重组蛋白可诱导较高水平的IgG及IgG亚型(IgG1、IgG2a、IgG2b、IgG3)抗体和IFN-γ、IL-2及IL-4细胞因子。动物试验表明,免疫SjIAP重组蛋白的小鼠与PBS组相比分别获得了31.5%的减虫率和37.2%的肝脏减卵率。免疫SjIAP重组蛋白能诱导小鼠获得一定减虫和减卵保护效果,提示血吸虫凋亡蛋白抑制因子可作为抗血吸虫病的疫苗候选分子。
日本血吸虫;凋亡蛋白抑制因子;免疫保护
日本血吸虫病是由日本血吸虫感染和寄生引起的一种重要人畜共患寄生虫病,在中国及东南亚迄今仍然是一个严重的公共卫生问题[1]。虽然中国血吸虫病的防治已取得举世瞩目的成就,但是目前仍面临诸多新挑战[2]。目前,对此病的防控还没有有效疫苗,只能依赖化学药物—吡喹酮的大量使用[3]。但是化学药物对血吸虫童虫杀伤效果不明显,也不能控制宿主的重复感染[4],并且吡喹酮的大量长期使用,可能诱导耐药性虫株的产生。
应用血吸虫辐射致弱尾蚴或童虫免疫动物可诱导高达60%~80%的免疫保护效果,提示发展抗血吸虫病疫苗是可行的。因此,有关科研人员开展了日本血吸虫亚单位疫苗、基因工程疫苗和DNA疫苗等方面的大量研究,但各种候选疫苗抗原都没有达到辐射致弱尾蚴或童虫的保护效果。研发高效的疫苗候选抗原分子,并将此分子与有效的抗原递送方式相结合有可能取得抗血吸虫病疫苗的新突破[5]。
我们前期研究表明日本血吸虫凋亡蛋白抑制因子(inhibitor of apoptosis protein ofSchistosoma japonicum,SjIAP)在维持血吸虫的寄生中可能发挥重要作用。凋亡蛋白抑制因子不仅可调控细胞凋亡,还在生命体的生长发育过程中发挥重要作用[6]。在血吸虫中,已发现了多种凋亡蛋白抑制因子,如SjIAP[7]、SjCIAP[8]、SjBcl-2/1、SjBcl-2/2和SjA[9]。为深入研究凋亡蛋白抑制因子作为抗血吸虫病疫苗候选抗原分子可能性,本研究利用SjIAP重组蛋白免疫BALB/c小鼠,评估小鼠产生的免疫保护效果。
1 材料和方法
1.1 材料
1.1.1 实验动物及生物材料 BALB/c 小鼠(7周龄)购自中国科学院上海实验动物中心;日本血吸虫尾蚴由中国农业科学院上海兽医研究所钉螺室提供。
1.1.2 试剂及仪器 RPMI1640培养基、胎牛血清、双抗(青霉素和链霉素)购自上海世仪生物有限公司;硝酸纤维素膜(Whatman)购自北京经科宏达生物技术有限公司;预染蛋白Marker购自Thermo Scientific公司;羊抗鼠IgG (IgG1、IgG2a、IgG2b、IgG3)-HRP购自武汉三鹰生物技术有限公司;可溶性单组份TMB溶液购自天根生化科技有限公司;弗氏完全和不完全佐剂购自Sigma公司;Bradford蛋白质定量检测试剂盒购自生工生物工程(上海)股份有限公司;牛血清白蛋白购自北京鼎国生物技术有限责任公司;MTT和刀豆球蛋白(ConA)购自Sigma公司;DMSO购自AMRESCO公司;EZ-SepTMMouse 1×淋巴细胞分离液购自北京达科为生物技术有限公司;Ni-NTA His-Bind Resin试剂盒购自Novagen公司;immobilonTMWestern Chemiluminescent HRP Substrate购自Millipore公司;Th1/Th2 细胞因子ELISA试剂盒购自Ebioscience公司;其他常规生化试剂购自上海生物工程公司;酶标板(Corning)购自上海百赛生物技术公司;紫外分光光度仪购自美国BioTek公司;Luminescent Image Analyzer 仪器获取图像购自美国GE Healthcare。
1.2 方法
1.2.1 SjIAP重组蛋白的制备及兔源多克隆抗体血清的制备 采用PCR的方法,将SjIAP全长开放阅读框序列(open reading frame,ORF)克隆至pET-28a(+)原核表达质粒,阳性质粒转化至BL21感受态细胞,挑取单克隆摇菌,当OD600=0.6时,加入IPTG,使其终浓度为1.0 mmol/L进行诱导表达。用Ni-NTA His-Bind Resin试剂盒,按说明书纯化得到SjIAP重组蛋白。SjIAP重组蛋白的制备以及多克隆抗体血清的制备详细步骤参见文献[7]。
1.2.2 SjIAP重组蛋白Western blot鉴定 利用Bradford蛋白质定量检测试剂盒对SjIAP重组蛋白进行定量,重组蛋白样品进行电泳(12% SDS-聚丙稀酰胺凝胶)分离,将分离的蛋白电转至硝酸纤维膜(Whatman®Germany)上。膜在5%(W/V)脱脂奶粉封闭2 h,结束后,PBST(pH7.4)洗膜;兔源抗SjIAP多克隆抗体(稀释度为1:500)与膜室温孵育2 h,PBST洗3次,每次5 min;羊抗兔IgG-HRP作为二抗(1:10 000),室温下与膜孵育40 min,PBST洗3次,每次5 min;利用immobilonTMWestern Chemiluminescent HRP Substrate进行显影并利用Luminescent Image Analyzer (GE Healthcare Bio-Sciences AB 75184 Uppsala, Sweden)仪器获取图像。
1.2.3 免疫程序 将45只BALB/c小鼠随机分成3组,15只/组,分别按以下剂量进行皮下免疫:SjIAP重组蛋白免疫组注射:(10 μg/50 μL PBS+50 μL弗氏佐剂)/只;佐剂组注射:(50 μL PBS+50 μL弗氏佐剂)/只;PBS组注射:100 μL PBS/只。首次免疫后3周加强免疫1次,共免疫2次,第1次免疫用弗氏完全佐剂,第2次免疫用弗氏不完全佐剂。分别在免疫前(第0周),一免后第3周,二免后第3周(第6周)对小鼠进行眼眶采血,分离血清,-80℃冻存备用。在第二次免疫后第7周,采用腹部皮肤贴片法感染日本血吸虫尾蚴(40±1)条/只,感染后d38剖杀小鼠。
1.2.4 IgG及IgG亚型检测 用ELISA方法检测各组小鼠血清中特异性IgG抗体水平。以10 μg/mL的SjIAP重组蛋白蛋白包被酶标板,100 μL/孔,4℃过夜,PBST(pH7.4)洗涤3次,5 min/次;1.5%(W/V)牛血清白蛋白37℃封闭1 h,PBST洗涤3次;加入小鼠血清(1:50稀释)37℃温育1.5 h,PBST洗涤3次;然后加入羊抗鼠二抗(1:5000稀释),37℃温育1 h, PBST洗涤3次;每孔加入100 μL TMB底物溶液,37℃避光放置10 min。最后,每孔加入50 μL 2 mol/L H2SO4终止反应,读取OD450值。IgG亚型抗体(IgG1、IgG2a、IgG2b、IgG3)检测方法参照上述步骤,小鼠血清按1:100稀释,羊抗鼠二抗按1:2500稀释。
1.2.5 淋巴细胞增殖试验及细胞因子检测 二次免疫后第3周,每组各取4只小鼠(未感染)做淋巴细胞增殖试验。采用EZ-SepTMMouse 1×淋巴细胞分离液分离小鼠脾脏淋巴细胞,以RPMI1640培养基(10%胎牛血清、100 mg/mL青霉素、100 mg/mL链霉素),将细胞稀释至2×105个/200 μL/孔,于96孔细胞培养板中培养。每个免疫组的每只小鼠的淋巴细胞培养时,都分别设阳性对照ConA刺激组(终浓度:2.5 μg/mL),SjIAP重组蛋白刺激组(终浓度:5 μg/mL)和阴性对照RPMI1640刺激组,每个刺激组都分别做3个复孔。于37℃、5% CO2培养箱中培养72 h 后,每孔各取上清100 μL,同一只小鼠的同一个刺激组上清收集到一起,冻存于-80℃,供细胞因子检测。每孔再分别加入20 μL的MTT(5 mg/mL),继续培养4 h。培养结束后,轻轻吸干上清,每孔再分别加入100 μL的DMSO,继续培养30 min,然后读取OD570值,计算增殖指数(SI),SI=ConA(SjIAP重组蛋白)刺激组平均值/RPMI1640刺激组平均值。用Th1/Th2 细胞因子ELISA试剂盒,按说明书对细胞培养上清中的细胞因子(IFN-γ、IL-2、IL-4、IL-10)进行检测。
1.2.6 减虫率和肝脏减卵率的计算 采用肝门静脉灌注法收集虫体并进行虫体计数,取出肝脏称重后,置于50 mL 离心管内,加入适量PBS,匀浆机匀浆后定容至20 mL。然后取0.5 mL匀浆液和10%NaOH等体积混合,56℃消化1 h,待消化结束,光学显微镜下计数虫卵,重复计数3次取平均值。按以下公式计算减虫率和肝脏减卵率,减虫率=(对照组平均每组成虫数-实验组平均每组成虫数)/对照组平均每组成虫数×100%;肝脏减虫率=(对照组平均每组虫卵数-实验组平均每组虫卵数)/对照组平均每组虫卵数×100%。
1.3 数据处理用t检验进行统计学分析。
2 结果
2.1 SjIAP重组蛋白Western blot鉴定应用本研究制备的兔源抗SjIAP重组蛋白的多克隆抗体血清,Western blot分析SjIAP重组蛋白,如图1所示,在分子量约43 kDa处呈现蛋白信号,与SjIAP重组蛋白的分子量一致。
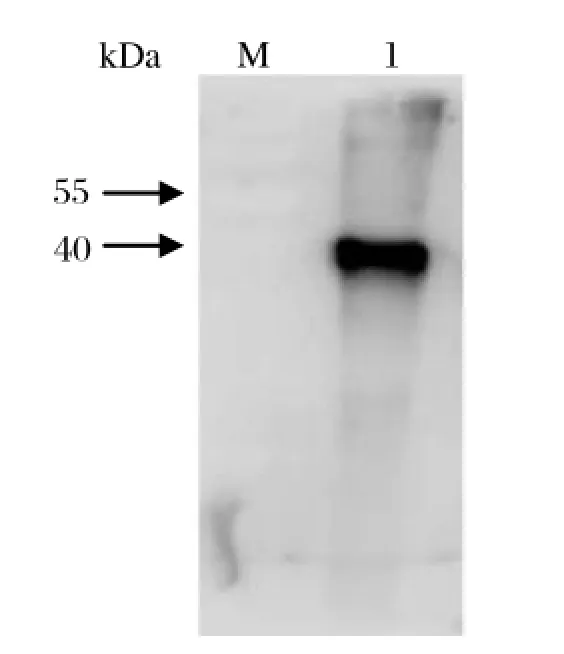
图1 SjIAP重组蛋白的Western blot分析Fig.1 Western blot analysis for recombinant SjIAP protein with anti-SjIAP polyclonal antibody
2.2 IgG及IgG亚型抗体检测利用ELISA方法测定免疫后小鼠血液中IgG抗体及IgG亚型抗体(IgG1、IgG2a、IgG2b、IgG3)的变化。如图2所示,与对照组(佐剂组或PBS组)相比,免疫组在首免后第3周即可检测到较高水平的IgG及IgG亚型抗体,强化免疫后,抗体水平仍有一定升高。SjIAP重组蛋白免疫组小鼠血清中IgG1/IgG2a的比值在第0周、第3周及第6周时分别为1.25、1.97、1.22。
2.3 淋巴细胞增殖指数如图3所示,各组小鼠脾脏细胞在ConA的刺激下都能增殖,用SjIAP重组蛋白刺激,只有SjIAP重组蛋白免疫组小鼠的脾细胞才能增殖。相对于佐剂组和PBS组,SjIAP重组蛋白免疫组的SI差异具有显著性统计学意义(P<0.01)。
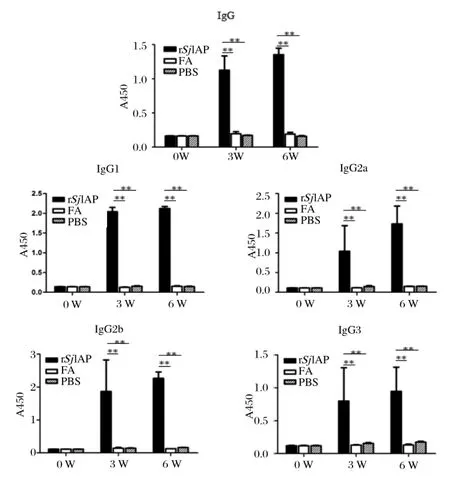
图2 免疫小鼠特异性抗SjIAP重组蛋白IgG及IgG亚型抗体水平检测Fig.2 Analysis of specifi c anti-rSjIAP IgG and IgG subclass antibodies induced in the immunized mice
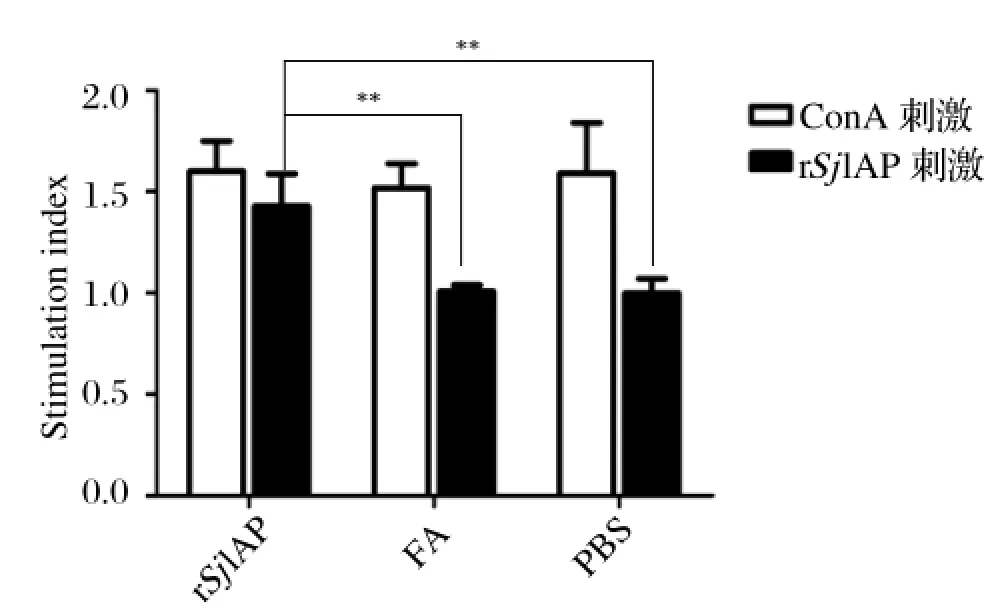
图3 免疫小鼠的脾脏淋巴细胞体外刺激后的增殖指数(**P<0.01)Fig.3 The stimulation index of the spleen lymphocytes from the immunized mice after ConA or recombinant SjIAP protein stimulation in vitro(**P<0.01)
2.4 细胞因子检测本实验对免疫鼠的脾细胞培养上清中的细胞因子(IFN-γ、IL-2、IL-4、IL-10)进行检测。如图4所示,免疫鼠脾细胞在SjIAP重组蛋白刺激后,相对于未刺激组(RPMI1640培养基)以及佐剂组,细胞培养上清中IFN-γ、IL-2升高极显著(P<0.01),但IL-10升高不明显(P>0.05)。相对于佐剂组,IL-4升高显著(P<0.05)。
2.4 免疫保护效果统计动物体内虫载量及肝脏虫卵数,计算减虫率和肝脏减卵率(表1)。统计分析表明免疫重组蛋白可获得一定的保护效果。与PBS组相比,可获得31.5%的减虫率和37.2%的减卵率;与弗氏佐剂组相比,可获得32.3%的减虫率和28.7%的减卵率,差异具有显著性统计学意义(P<0.01)。

图4 免疫小鼠脾脏淋巴细胞在SjIAP重组蛋白刺激后培养上清中的细胞因子Fig.4 Cytokine production by spleen lymphocytes of the immunized mice after recombinant SjIAP protein stimulation in vitro
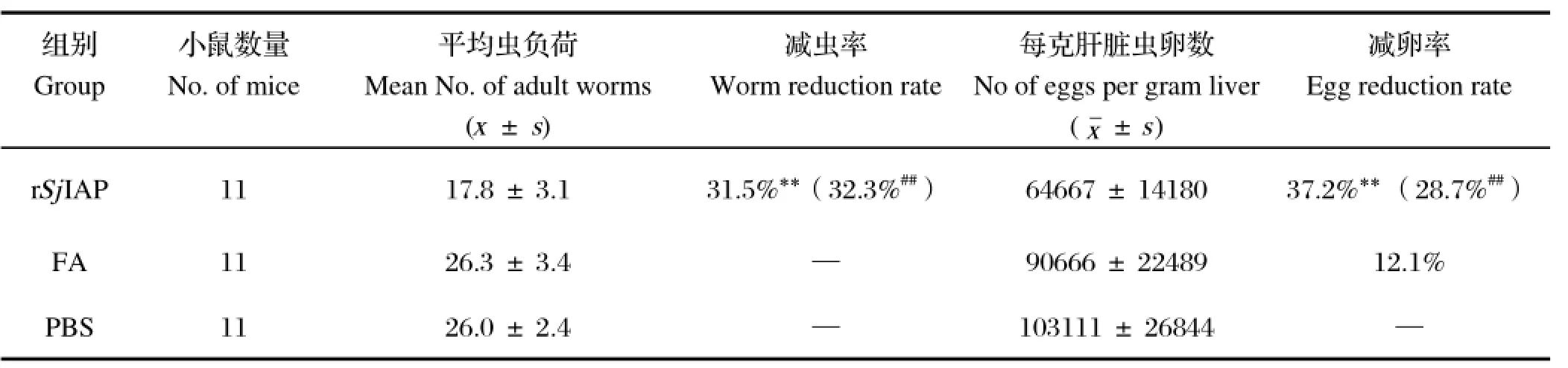
表1 SjIAP重组蛋白在BALB/C小鼠中获得的减虫率和减卵率Table 1 Worm and egg reduction rates induced by recombinant SjIAP protein in immunized mice
3 讨论
本研究用日本血吸虫凋亡蛋白抑制因子SjIAP重组蛋白免疫BALB/c小鼠,获得31.5%的减虫率和37.2%的减卵率。ELISA分析表明重组SjIAP蛋白免疫可诱导较高水平IgG及IgG亚型抗体(IgG1、IgG2a、IgG2b、IgG3)的产生,加强免疫后,SjIAP重组蛋白免疫组小鼠血清中抗体进一步提升,产生较高水平的IgG1和IgG2a抗体,且IgG1/IgG2a的比值随着两次免疫的进行呈现下降的趋势,表明SjIAP重组蛋白诱导小鼠产生的免疫反应为Th1/Th2混合型,并且逐渐向Th1型过渡。攻虫前的淋巴细胞增殖试验表明,免疫组的小鼠脾细胞能在SjIAP重组蛋白的刺激下发生特异性增殖,其培养上清中可检测到Th1型细胞因子IFN-γ、IL-2 极显著升高(P<0.01),Th2型细胞因子IL-4显著升高(P<0.05),结果表明,SjIAP重组蛋白联合弗氏佐剂免疫BALB/c小鼠,获得的特异性免疫反应为Th1/Th2混合型,且Th1型占主导,这也印证了抗体分型的检测结果。IL-2在T细胞的活化增值中发挥关键作用。IL-4在B细胞活化进而分化为浆细胞的过程中发挥重要作用。IFN-γ能促进Th0细胞向着Th1细胞分化,同时也参与抗体的类别转换,促进IgG2a和IgG3的生成。IL-4促进Th0细胞向着Th2细胞分化,同时促进IgG1的产生。有研究表明,将抗IFN-γ的单克隆抗体注射C57BI/6小鼠,会打破Th1/Th2细胞之间的平衡,抑制Th1型细胞的分化,促进Th2型细胞的分化,随后将辐射致弱的曼氏血吸虫尾蚴接种小鼠,会导致小鼠抗血吸虫感染的免疫保护力降低89.5%[10]。提示Th1型免疫应答在抗血吸虫感染方面发挥重要作用。血吸虫能在终末宿主中存活数年,推测其长时间的寄生与其细胞功能调控密切相关。凋亡蛋白抑制因子作为细胞凋亡的负调控因子,已引起了有关学者的关注。本研究表明日本血吸虫凋亡蛋白抑制因子重组蛋白免疫能产生一定的抗血吸虫病的保护效果,提示从调控血吸虫细胞凋亡入手,开展日本血吸虫凋亡蛋白抑制因子的功能及其作为抗血吸虫病的疫苗候选分子的保护效果研究,有可能为血吸虫病的防控开拓新途径。
[1] Gray D J, Williams G M,Li Y,et al. Transmission dynamics of Schistosoma japonicum in the lakes and marshlands of China[J]. PLoS One, 2008, 3(12): e4058.
[2] McManus D P, Li Y, Gray D J,et al. Conquering 'snail fever': schistosomiasis and its control in China[J]. Expert Rev Anti Infect Ther, 2009, 7(4): 473-485.
[3] McManus D P. A vaccine against Asian schistosomiasis: the story unfolds[J]. Int J Parasitol, 2000, 30(3): 265-271.
[4] Doenhoff M J, Pica-Mattoccia L. Praziquantel for the treatment of schistosomiasis: its use for control in areas with endemic disease and prospects for drug resistance[J]. Expert Rev Anti Infect Ther, 2006, 4(2): 199-210.
[5] McManus D P, Loukas A. Current status of vaccines for schistosomiasis[J]. Clin Microbiol Rev, 2008, 21(1): 225-242.
[6] Silke J, Meier P. Inhibitor of apoptosis (IAP) proteinsmodulators of cell death and inflammation[J]. Cold Spring Harb Perspect Biol, 2013, 5(2). doi: 10.1101/cshperspect. a008730.
[7] Peng J, Yang Y, Feng X,et al. Molecular characterizations of an inhibitor of apoptosis from Schistosoma japonicum[J]. Parasitol Res, 2010, 106(4): 967-76.
[8] Luo R, Zhou C J, Shi Y J,et al. Molecular characterization of a cytokine-induced apoptosis inhibitor from Schistosoma japonicum[J]. Parasitol Res, 2012, 111(6): 2317-2324.
[9] Lee E F, Clarke O B, Evangelista M,et al. Discovery and molecular characterization of a Bcl-2-regulated cell death pathway in schistosomes[J]. Proc Natl Acad Sci U S A, 2011, 108(17): 6999-7003.
[10] Smythies L E, Coulson P S, Wilson R A. Monoclonal antibody to IFN-gamma modifies pulmonary inflammatory responses and abrogates immunity to Schistosoma mansoni in mice vaccinated with attenuated cercariae[J]. J Immunol, 1992, 149(11): 3654-3658.
EVALUATION OF IMMUNOGENICITY OF THE RECOMBINANT INHIBITOR OF APOPTOSIS PROTEIN OF SCHISTOSOMA JAPONICUM IN MOUSE MODEL
HU Chao, LUO Rong, DAO Jin-wei, WANG Yu-qing, ZHAO Jiang-ping, LU Ke, LI Hao, LIU Jin-ming, CHENG Guo-feng
(Key Laboratory of Animal Parasitology of the Ministry of Agriculture, Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
To evaluate the protective immunity induced by the inhibitor of apoptosis protein of Schistosoma japonicum (rSjIAP) in BALB/c mice, SjIAP gene was amplified in PCR and subcloned into the plasmid pET-28a(+) to construct a recombinant expression plasmid pET-28a(+)-SjIAP. The recombinant protein SjIAP was expressed in E.coli. The purified recombinant protein was used to immunize New Zealand rabbit to produce polyclonal antibodies. BALB/c mice were immunized with the purifi ed recombinant SjIAP emulsifi ed in Freund's adjuvant. The levels of specifi c anti-rSjIAP antibodies in serum samples of immunized animals and cytokines in culture supernatants of the spleen lymphocytes in response to the T cell mitogen rSjIAP were detected in ELISA. Then all mice were challenged with Schistosoma japonicum cercariae and terminated at thirty-eight days later. The rates of worm reduction and liver egg reduction were counted. Western blot analysis indicated that rSjIAP reacted with rabbit polyclonal antibodies. High levels of specifi c IgGand IgG subclass (IgG1, IgG2a, IgG2b and IgG4) antibodies as well as IFN-γ, IL-2 and IL-4 were detected in animal serum samples. The immunized mice showed worm reduction by 31.5% and liver egg reduction by 37.2%. The present study indicated that immunization of rSjIAP induced partial protection against schistosomiasis in BALB/c mice, suggesting that SjIAP might be a potential candidate for vaccine development.
Schistosoma japonicum; inhibitor of apoptosis protein; protective immunity
S852.735
A
1674-6422(2014)03-0034-07
2014-03-20
国家自然科学基金(30901068)
胡超,男,硕士研究生,预防兽医学专业;罗荣,男,助理研究员,主要从事血吸虫重要功能分子研究
程国锋,E-mail: chenggfeng@yahoo.com.cn

