亚洲璃眼蜱唾液腺多肽Ha-11的鉴定、表达和生物学功能的初步研究
张冰炳, 龚海燕,周勇志,曹 杰,张厚双,周金林
(1.上海师范大学生命与环境科学学院,上海 200234;2.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241)
亚洲璃眼蜱唾液腺多肽Ha-11的鉴定、表达和生物学功能的初步研究
张冰炳1,2, 龚海燕2,周勇志2,曹 杰2,张厚双2,周金林2
(1.上海师范大学生命与环境科学学院,上海 200234;2.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241)
本研究对亚洲璃眼蜱多肽Ha-11的编码基因进行了克隆、表达和初步的功能分析。该基因开放阅读框(open reading frame, ORF)为372 bp,编码123个氨基酸,其中含23个氨基酸的信号肽。将去除信号肽的编码区基因亚克隆至pGEX-4T-1载体,大肠杆菌中诱导表达,获得了37 kDa重组蛋白。抗重组Ha-11蛋白的免疫血清识别半饱血雌蜱的唾液腺中约11 kDa的天然蛋白。Real-time PCR结果表明该基因在亚洲璃眼蜱的各发育阶段、各组织中均有表达,但以若蜱表达量最高,而组织中以淋巴液表达量最高。重组蛋白在体外可以抑制脾细胞增殖和细胞因子IL-2、IFN-γ的分泌。研究结果显示Ha-11在蜱吸血过程中可能具有抗炎作用。
唾液腺;亚洲璃眼蜱;多肽Ha-11;鉴定
蜱是一类以吸血为生的节肢动物,在世界上广泛分布,影响人类和动物的健康,同时传播多种人类和动物传染病病原,如细菌、真菌、病毒、立克次体、螺旋体和寄生原虫等[1],被认为是世界上依次于蚊子的第二大主要传播媒介[2-4]。为了抑制宿主疼痛和瘙痒从而成功获取血液,防止血液在肠中凝固,蜱唾液腺会分泌抗凝血、抗炎和免疫抑制等功能丰富蛋白分子[2,5-8],这些功能分子的存在也有利于病原传播。由于传统的化学杀虫剂容易引起耐药性、药物残留、环境污染等问题。研究蜱唾液腺分泌的功能分子对开发新型抗蜱疫苗、抗凝血制剂、发现炎症抑制因子等具有重要意义[2]。亚洲璃眼蜱(Hyalomma asiaticum)是中国北方的一种优势蜱种。本研究从实验室前期构建的差异表达基因文库的基因筛选、测序分析获得506 bp基因,进一步定义为Ha-11基因[7],对其功能进行初步鉴定,为研究该基因对亚洲璃眼蜱生长发育的影响及疫苗研制提供了基础。
1 材料与方法
1.1 材料Trizol购自Invitrogen公司;增强型HRPDAB底物显色试剂盒购自TIANGEN试剂公司;反转录和Real-time PCR试剂盒购自TaKaRa试剂公司;CCK-8试剂盒购自Dojindo公司;PRMI 1640培养液购自GIBCO公司;羊抗鼠IgG抗体购自Bethyl公司;细胞因子检测试剂盒购自eBioscience公司。
1.2 试验用动物亚洲璃眼蜱采自新疆维吾尔自治区,经兔耳人工饲养繁殖传代和保种[9];昆明小鼠购自上海斯莱克实验动物有限公司。
1.3 Ha-11编码基因的克隆和序列分析从农业部动物寄生虫学重点开放实验室(以下简称本实验室)已构建差异表达基因cDNA文库中[7],挑选出吸血后表达显著提高的多重复克隆基因,命名为Ha-11基因,克隆至pGEM-T-easy载体后进行测序。所获得的序列用SinglP http://www.ncbi.nlm.nih.gov/gorf/gorf. html网站的相关工具分析,预测Ha-11基因翻译的氨基酸序列及其信号肽。在GenBank Blastx http://blast. ncbi.nlm.nih.gov/Blast.cgi 进行同源性分析。
1.4 Ha-11的原核表达和纯化根据得到的Ha-11信号肽,将获得的Ha-11序列的开放阅读框(open reading frame,ORF)去掉信号肽后,设计原核表达引物,上游引物:;下游引物:CGACACAGGAATTG (下划线部分为Xho I位点)。以Ha-11/pGEM-T-easy为模板,扩增Ha-11的表达片段。PCR反应条件:94℃预变性 7 min;然后94℃ 45 s,54℃ 45 s,72℃ 1 min, 共 35 个 循环; 循环结束后,72℃延伸 7 min。将纯化的Ha-11表达片段连接于pGEX-4T-1载体,并转化到大肠杆菌DH5α。将PCR鉴定和测序验证后得到的阳性克隆用1 mmol/L 的IPTG诱导表达。将含Ha-11/pGEX-4T-1载体细菌和pGEX-4T-1空载体细菌分别按照GST标签蛋白的提取方法,与GST树脂结合、洗脱纯化、透析后,用12%SDS-PAGE分析重组蛋白浓度和纯化质量。
1.5 抗重组蛋白血清的制备和免疫转印分析将纯化的Ha-11重组蛋白用同体积的弗氏完全佐剂乳化,按每只小鼠100 μg剂量背部皮下多点注射免疫昆明小鼠。分别于2周和4周后按每只小鼠60 μg Ha-11重组蛋白剂量,以弗氏不完全佐剂乳化后进行第2次和第3次加强免疫,3免后1周采血,离心取上清,用ELISA测定免疫血清效价。剖杀小鼠取全部血液,离心后-70℃保存备用。
取吸血4 d的半饱血亚洲璃眼蜱雌蜱,解剖分离出脂肪体、血淋巴、卵巢、肠、壳、唾液腺,在超声仪中超声30 min至蛋白裂解,溶液呈澄清均一状,取10 μL用BCA方法测定蛋白浓度。在20 μg蛋白中加入等体积2×SDS loading buffer进行12% SDSPAGE电泳。半干法转印至PVDF膜,进行Western blot 分析:PVDF膜用PBST配制的3%脱脂奶粉4℃封闭过夜后,加入Ha-11抗体(由 1:16 000稀释的抗小鼠血清制备,含3%脱脂奶粉),37℃孵育2 h。PBST洗涤3次后加入1:4000稀释的HRP标记的二抗羊抗鼠IgG,孵育1 h。PBST洗涤3次后用HRP-DAB试剂盒显色并扫描。
1.6 Ha-11基因在不同发育阶段和组织器官的表达分析收集亚洲璃眼蜱的卵、幼蜱、若蜱、成蜱,以及半饱血亚洲璃眼蜱的唾液腺、血淋巴、肠、卵巢、外壳、脂肪体等各组织,研磨匀浆后用TRIZOL提取总RNA,分别用反转录试剂盒反转录为cDNA,用Real-time PCR试剂盒检测其表达量。Real-time PCR上游引物Ha-F:5'-ATGGAGGTCGAAGAATGTCC-3';下游引物Ha-R: 5'-TGTTGCCGATAGTTATTGGG-3'。同时利用延长因子elongation factor 1α(ELF1A)作为内参基因[10],用相对定量法分析基因的差异表达情况。
1.7 脾细胞增殖实验及细胞因子的检测取6 w昆明小鼠脾脏,经300目的筛网过滤,研磨洗脱后,分离脾细胞。用完全RPMI 1640培养基将脾细胞数目稀释到5×106个/mL,然后加入96孔细胞培养板(100 μL/孔),每孔再加入100 μL完全RPMI1640培养基,以及1 μg ConA(刺激脾细胞的增殖)。48 h后培养基中分别加入2.7×10-5μmol/L Ha-11重组蛋白和GST标签蛋白以刺激脾细胞,置于37℃、5%CO2培养箱中培养。48 h后取出100 μL细胞上清-70℃保存备用,测定细胞因子的变化。剩余每孔中加入10 μL cell counting kit CCK-8和90 μL完全RPMI 1640培养基。分别在加入试剂后1、2、3、4 h测定OD450,探究细胞数目的变化。
用eBioscience试剂盒测定小鼠脾细胞培养上清中的IL-2、IL-4、IL-5、TNF-α、IFN-γ含量。取试剂盒中已包被好的的ELISA板,样品孔中加入一抗(由50 μL 样品稀释液(sample dilute)稀释50 μL脾细胞培养上清、50 μL分析缓冲液(assay buffer)稀释的生物素共150 μL构成)。室温孵育2 h后,弃去一抗,洗脱液(washing buffer)洗板。每孔加入二抗streptavidin-HRP 100 μL,孵育1 h。倒掉液体,washing buffer洗板。加入显色液(TMB substrate)100 μL,显色15 min后测定其在波长为450 nm处的OD值。每个样品设3个重复。
2 结果
2.1 Ha-11基因的测序与分析如图1所示,Ha-11基因全长506 bp,含有1个372 bp的ORF,编码123个氨基酸,并在第1到第23个碱基之间有1个23个氨基酸的信号肽,提示其可能作为分泌蛋白分泌到胞外。经BLASTP分析,表明无功能域,且无同源基因。去信号肽后的成熟蛋白中有8个半胱氨酸,提示可能与β螺旋的形成有关。

图1 Ha-11全长基因及预测的氨基酸序列Fig.1 Nucleotide and deduced amino acid sequence of Ha-11
2.2 蛋白的表达与纯化如图2所示,Ha-11基因在pGEX-4T-1中成功表达并被纯化,其分子量约为37 kDa,由去掉信号肽后的Ha-11(约11 kDa)和标签蛋白GST(约26 kDa)组成。

图2 重组蛋白Ha-11/pGEX-4T-1的表达与纯化Fig.2 Expression and purifi cation of Ha-11 recombinant protein in pGEX-4T-1 vector
2.3 蜱中Ha-11的蛋白表达取亚洲璃眼蜱吸血前后的唾液腺经超声离心后,获得的均一澄清溶液用重组蛋白制备的免疫血清进行免疫印迹反应,结果在半饱血雌蜱的唾液腺中检测到分子量约为11 kDa的特异性条带(图3)。子宫、卵巢、肠道等组织中则未检测出特异性条带,表明Ha-11基因表达的蛋白在唾液腺中以天然形式存在。
2.4 Ha-11在蜱的不同阶段和组织中的表达Real-time PCR检测发现在半饱血雌蜱的各个组织器官中,Ha-11以淋巴液中表达量最高,唾液腺次之(图4A)。而在4个不同的发育阶段,Ha-11以若蜱中表达量最高 (图4B)。
2.5 Ha-11重组蛋白的免疫调节作用对脾细胞增殖研究发现,培养48 h后,重组蛋白可显著抑制小鼠脾细胞的增殖。而同浓度的GST标签蛋白,对脾细胞增殖的抑制作用较弱 (图5A)。
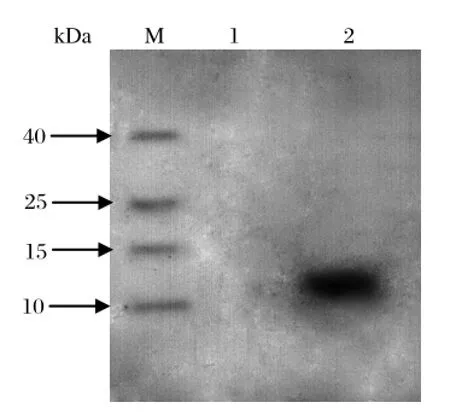
图3 蜱唾液腺中Ha-11的Western blot分析结果Fig.3 Western blot analysis of Ha-11 in salivary gland of ticks

图4 Ha-11在不同组织和不同发育阶段的表达量Fig.4 Expression profi le of Ha-11 in different tissues and developmental stages of H. asiaticum
对于细胞因子 IL-2、IL-4、IL-5、TNF-α、IFN-γ的检测结果表明,重组蛋白对脾细胞中IL-2、TNF-α的表达有明显的抑制作用(图5B和5C,P<0.05,Student's t-test)。重组蛋白对于IL-2、TNF-α的抑制作用可能对相应细胞的增殖分化产生影响,而对于上清中的IL-4、IL-5、IFN-γ并无明显影响(结果未显示)。
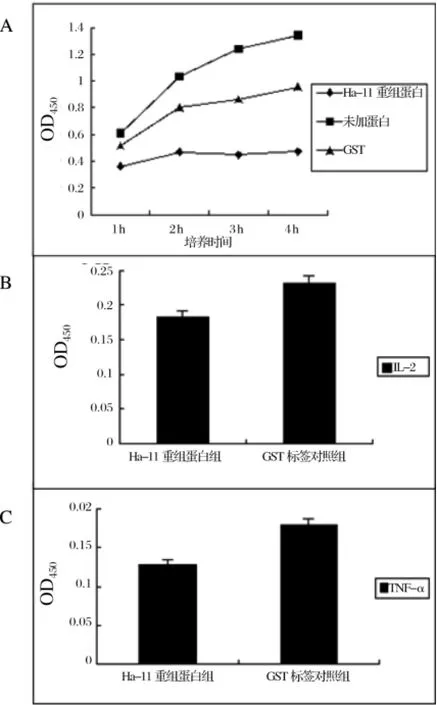
图5 重组蛋白对脾细胞增殖及上清中细胞因子的影响Fig.5 The infl uence of recombinant protein on the proliferation of spleen cell and the expression of cytokines
3 讨论
本研究根据本实验室前期对亚洲璃眼蜱唾液腺差异表达文库的大规模测序结果,选择其中吸血后高表达的一个小分子编码基因Ha-11进行克隆、表达和初步的功能分析。该基因编码123个氨基酸,其中含有23个氨基酸的信号肽,表明该蛋白可分泌到细胞外。在去除信号肽的100个氨基酸中含有8个半胱氨酸,这可能与β螺旋的形成有关。Real-time PCR 分析发现其在若蜱、半饱血雌蜱、淋巴液和唾液腺中大量表达。对该基因的同源性分析未发现功能域。Western blot 分析表明在半饱血唾液腺中检测到11 kDa左右的特异性条带,未吸血蜱唾液腺中则没有特异性带,此表明Ha-11为吸血过程中诱导表达的小分子,可能与蜱吸血存在密切关系。IL-2对于T细胞、B细胞、NK细胞的增殖有着重要的作用,是炎症反应的重要指标[11]。IFN-γ对于B细胞的分化、Th1细胞的产生有着重要的促进作用。脾细胞增殖实验发现重组蛋白对于脾细胞增殖有抑制作用,所培养的细胞上清中IL-2、IFN-γ的表达量降低,说明Ha-11可能在蜱吸血过程中,对B细胞、T细胞、NK细胞的增殖有着抑制作用,特别是对Th1细胞的分化抑制,表明该基因在蜱吸血过程中可能具有抗凝抗炎作用,但抗凝抗炎机制及在抗蜱疫苗开发中的作用还有待进一步探索。
[1] 柳支英, 路宝麟. 医学昆虫学[M]. 北京: 科学出版社, 1990 : 397-415.
[2] 周金林. 蜱的功能分子研究及其应用前景[J]. 动物医学进展, 2004, 25(1): 53-56.
[3] de la Fuente J, Kocan K M,Almazan C,et al. Targeting the tick pathogen interface for novel control strategies[J]. Front Biosci, 2008, 13: 6947-6956.
[4] Anderson J F, Magnarelli L A . Biology of ticks[J]. Infect Dis Clin North Am,2008, 22(2): 195-215.
[5] 王玉霞, 周金林, 沈杰. 蜱功能基因研究进展[J]. 动物医学研究进展, 2005, 26(7): 31-35.
[6] 郭凤璕, 狄清, 周金林, 等. 亚洲璃眼蜱免疫抑制蛋白 P36的分子鉴定及重组表达[J]. 中国预防兽医学报, 2010, 32(6): 437-440.
[7] 程天印, 周金林, 周勇志, 等. 亚洲璃眼蜱唾液腺差异表达基因文库的构建和分析[J]. 中国预防兽医学报, 2006, 28(3): 261-266.
[8] Barry J D, Ginger M L, Burton P,et al. Why are parasite contingency genes often associated with telomeres[J]. Int J Parasitol, 2003, 33(1): 29-45
[9] 周勇志, 周金林, 曹杰, 等. 四种硬蜱的实验室人工饲养和部分生物学特性的观察[J]. 中国兽医寄生虫病, 2003, 11(2): 23-25.
[10] Nijhof A M,Balk J A, Postigo M,et al. Selection of reference genes for quantitative RT-PCR studies in Rhipicephalus(Boophilus) microplusand Rhipicephalus appendiculatus ticks and determination of the expression profile of Bm86[J]. BMC Mol Biol, 2009, 47(2): 1-14.
[11] Mosmann T R, Cherwinski H, Bond M W,et al. Two types of murine helper T cell clone. I. Definition according to profiles of lymphokine activities and secreted proteins[J]. J Immunol, 1986, 136(7): 2348-2357.
EXPRESSION AND PRIMARY CHARACTERIZATION OF HA-11 POLYPEPTIDE FROM HYALOMMA ASIATICUM
ZHANG Bing-bing1,2, GONG Hai-yan2, ZHOU Yong-zhi2, CAO Jie2, ZHANG Hou-shuang2, ZHOU Jin-lin2
(1.College of Life and Environment Science, Shanghai Normal University, Shanghai 200234,China; 2. Key Laboratory of Animal Parasitology of the Ministry of Agriculture, Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
In the present study, we reported cloning, expression and primary biological identifi cation of Ha-11gene fromHyalomma asiaticum. The ORF of Ha-11gene was 372 bp encoding 123 amino acid residues including a signal peptide of 23 amino acid residues. A 37 kDa recombinant protein was obtained fromE.coliDH5α using pGEX-4T-1 as expression. A specifi c band about 11kDa was detected in the salivary gland of female ticks in Western blot using anti-recombinant Ha-11serum. The result of Real-time PCR indicated that Ha-11 was expressed in all of developmental stages and tissues of adult female ticks with the highest expression in nymphs and hemolymphs. Recombinant Ha-11 protein signifi cantly suppressed the proliferation of spleen cells and secretion of cytokines including IFN-γ and IL-2in vivo. The results obtained here suggested that recombinant protein might be involved in suppression of infl ammation.
Salivary gland;Hyalomma asiaticum; Ha-11 polypeptide; identifi cation
S852.746
A
1674-6422(2014)03-0048-05
2014-03-14
卫生行业科研专项经费资助项目(201202019)
张冰炳,女,硕士研究生,动物学专业
周金林,E-mail:jinlinzhou@shvri.ac.cn

