单性血吸虫带虫免疫对继发血吸虫病的影响
乔洪宾,曹宇凡,韩 愉,石耀军,陆 珂,李 浩,刘金明,林矫矫,金亚美
(中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241)
单性血吸虫带虫免疫对继发血吸虫病的影响
乔洪宾,曹宇凡,韩 愉,石耀军,陆 珂,李 浩,刘金明,林矫矫,金亚美
(中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241)
研究表明,辐照致弱血吸虫尾蚴疫苗能够诱导宿主产生较高的免疫保护作用,是所有血吸虫候选疫苗中保护力最强的,且辐照致弱尾蚴在宿主体内不能发育成熟,不会对宿主造成严重的病理损害。单性感染的血吸虫同样不能在宿主体内发育成熟,其发育状态停留在童虫阶段,也不会对宿主造成严重的病理损害,在童虫状态下对宿主持续进行的免疫刺激,是否也能诱导宿主对继发血吸虫病产生较高的免疫保护作用呢?为此,本研究通过让宿主携带单性血吸虫雄虫的带虫免疫方式来检测其对继发血吸虫病的影响。选用雄性血吸虫尾蚴感染BALB/c小鼠(100条/只),于单性血吸虫尾蚴攻击后第5、7 w用吡喹酮进行治疗(300 mg/kg),第9 w进行雌雄血吸虫混合尾蚴攻击实验动物(40条/只),第15 w剖杀实验动物,收集宿主荷虫、宿主肝卵负荷、肝卵孵化、宿主肝单卵肉芽肿体积数据,并检测宿主血清特异性抗体变化趋势。结果表明单性带虫免疫可以引起宿主肝虫卵孵化率及组织病理损伤显著降低,对宿主有一定的免疫保护效果。
日本血吸虫;单性带虫免疫;虫卵肉芽肿;孵化率
Key words:Schistosoma japonnicum; single-sex immunization; egg granuloma; hatching rate
血吸虫病是广泛流行的寄生虫病之一,目前大约仍有2亿人感染血吸虫病,6亿人面临血吸虫病的威胁[1,2],因此血吸虫病的防控仍面临严峻的挑战[3,4]。目前血吸虫病的治疗主要依赖于吡喹酮,它具有高效低毒的优点,但是无法控制血吸虫的重复感染,且对童虫的效果不明显,并已有抗吡喹酮血吸虫虫株出现的报道[5],因此筛选高效候选疫苗的工作仍十分迫切。以往血吸虫疫苗研究工作发现,辐照致弱尾蚴免疫动物能够诱导大于70%的保护力,从而成为抗感染疫苗的研究热点[6-8],且在抗感染疫苗中,致弱尾蚴的免疫保护力最高,可诱导宿主产生明显的抗攻击感染免疫保护力和抵抗血吸虫生殖的免疫力[9]。
血吸虫雌雄异体,血吸虫雌虫必须与雄虫合抱相当长的时间才能正常生长发育为成熟虫体。单性感染的雌虫其生殖系统会处于不成熟的发育阻碍状态,不能正常产卵,而血吸虫的病理损害主要是由成熟血吸虫雌虫所产虫卵所致,所以单性感染的血吸虫雌虫或雄虫都不会对宿主造成严重的病理损害。单性感染的血吸虫与辐照致弱尾蚴都以童虫状态存活于宿主体内,其存在势必会持续的刺激宿主免疫系统,那么单性感染的血吸虫能否像致弱尾蚴一样诱导宿主对继发血吸虫感染产生较强的免疫保护效果呢?基于此,本研究以单性血吸虫雄虫带虫免疫的方式对其保护作用进行了初步探讨。
1 材料和方法
1.1 生物材料6w 雄性BALB/c小鼠购自上海斯莱克实验动物中心;日本血吸虫尾蚴来自于中国农业科学院上海兽医研究所钉螺室;辣根过氧化物酶(HRP)标记的羊抗小鼠 IgG 购自鼎国生物公司;HRP 标记羊抗小鼠IgE 购自 AbD Serotec 公司;Agrose 购自上海生工生物工程公司。
1.2 尾蚴性别鉴定单只钉螺放置于一个盛满去氯水的试管中,其他条件与常规溢尾蚴一致(保持光照,温度控制在25℃~30℃,加钢丝网罩)[10]。用接种环挑取尾蚴,放到含有10 μL去离子水的1.5 mL EP管中。每个EP管中加入1~2 μL的20 mg/mL蛋白酶K,在恒温水浴锅中进行孵育,温度为55℃~65℃,时间为15 min至1 h。消化完毕后从EP管中取出5 μL,作为虫体模版,进行 PCR扩增。扩增程序:94℃预变性5 min;94℃变性1 min,52℃退火30 s,72℃延伸1 min,35个循环;72℃后延伸5 min。PCR产物在1.0% TBE琼脂糖凝胶中电泳,紫外透射仪下观察结果,凝胶成像系统摄像。
1.3 日本血吸虫单性带虫免疫6w 雄性BALB/c 小鼠随机分成单性免疫组和对照组,每组10只。免疫组小鼠进行雄性尾蚴感染,每只小鼠经腹部贴片感染100±5条雄性尾蚴,对照组不做处理。全部小鼠于单性感染后的第5、7 w进行吡喹酮治疗(300 mg/kg),第9 w进行攻击感染,每只小鼠经腹部皮肤贴片攻击感染40±2条两性血吸虫尾蚴,第15 w剖杀小鼠,收集血清,以肝门静脉灌注法收集虫体并计数。取下肝脏分别进行减虫率、减卵率、减孵化率计算,固定部分肝脏进行病理切片,观察单性带虫免疫组与对照组之间的病理差异。
1.4 成虫全虫蛋白的提取及浓度测定成虫虫体(200 mg虫体,PMSF终浓度为1 mmol/mL的PBS 1 mL)置于玻璃研磨器中,冰水浴中研磨,反复冻融、超声5 s 静止30次15 s,依次重复30次。然后12 000×g离心1 h,取上清。BCA法测定蛋白浓度,酶标仪测定A562,绘制标准曲线,计算样品的浓度。
1.5 ELISA方法检测特异性抗体水平免疫后0、2、4、7、9 w对各组小鼠分别进行采血,收集血清,间接ELISA方法检测各个时期特异性抗体水平,以提取的全虫可溶性蛋白包被96孔板,具体实验步骤如下:10 μg/mL的全虫蛋白100 μL包被酶标板,4℃过夜,PBST洗板3次,每次10 min, 每孔200 μL,甩干。1.5% BSA封闭,37℃ 孵育1 h,每孔150 μL,如上洗涤。小鼠抗血清按照1:100稀释,每孔100 μL, 37℃ 孵育1 h,如上洗涤。加入二抗,每孔100 μL HRP-羊抗小鼠IgG(1:5000)100 μL/IgG1(1: 5000)100 μL/IgG2a(1:2000),37℃ 孵育1 h。如上洗涤后,每孔加入100 μL的TMB底物溶液,避光显色20 min。最后以 50 μL的2 mol/L硫酸终止反应,酶标仪测定其OD450值。
1.6 免疫保护效果评估经肝门静脉灌注法冲出的虫体进行计数,计算减虫率,减虫率=(对照组平均载虫数-单性免疫组平均载虫数)/对照组平均载虫数。
肝减卵率的计算:收集每只小鼠的肝脏,称重后放入50 mL的离心管,加入去氯水至终体积20 mL,组织匀浆器充分匀浆,混匀后取1 mL 匀浆液加入到含1 mL10%NaOH的EP管中,置56℃水浴消化1 min左右,混匀吸取50 μL,每个样品重复3次,镜检计数肝组织虫卵,最后换算成平均每克肝组织负荷虫卵数(EPG)。按下面公式计算肝脏减卵率,减卵率=(对照组平均载卵数-单性免疫组平均载卵数)/对照组平均载卵数×100%
减孵化率的计算:取4 mL匀浆液加入到孵化瓶中,加入去氯水至瓶颈上方5 cm处,塞入一层脱脂棉,上层加8 mL的去氯水,在27℃、光下诱导孵化4 h。之后取上清8 mL加入1滴碘酊固定,4℃、4000×g离心5 min,取上清7 mL,重悬,取100 μL,每个样品重复3次,镜检计数毛蚴,计算减孵化率,减孵化率=(对照组平均孵化率-单性免疫组平均孵化率)/对照组平均孵化率×100%
单虫卵肉芽肿大小的测量:实验动物剖杀冲虫后,免疫组与对照组随机取3只小鼠的肝左叶置于4%多聚甲醛固定,用于石蜡切片。肝组织经固定、脱水、透明、浸蜡、包埋,制成石蜡组织块,10 μm切片,按常规方法进行HE染色。按Hsu等[11]的方法计算虫卵肉芽肿的体积:V=πAB2/6,其中π为常数3.14,A为肉芽肿横径,B为肉芽肿纵径,6为常数。每组测量20个单虫卵肉芽肿大小,按公式计算每个虫卵肉芽肿的体积,并求得每组小鼠肝脏虫卵肉芽肿的平均体积。
2 结果
2.1 单钉螺逸出尾蚴性别检测以单钉螺溢出尾蚴的DNA作为模版,用特异性检测引物进行PCR扩增,扩增产物进行1%琼脂糖凝胶电泳,雌性有特异性条带(153 bp),雄性无特异性条带(图1)。
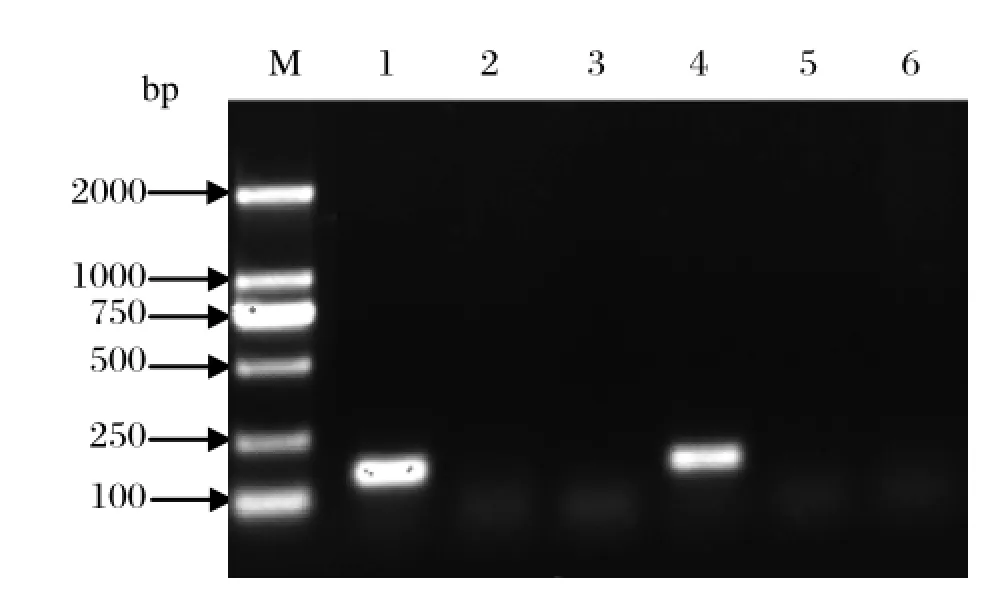
图1 PCR鉴定尾蚴性别Fig.1 Identifi cation of cercaria gender by PCR
2.2 单性免疫后小鼠特异性抗体水平的变化抗原为感染5 w血吸虫全虫可溶性蛋白,在单性免疫后0、2、4、7、9 w时收集小鼠血清,利用ELISA方法对抗体水平进行检测。IgG抗体水平检测结果发现,与感染对照组相比,单性带虫免疫组的IgG抗体水平持续升高,6 w后抗体水平即达峰值(图2)。
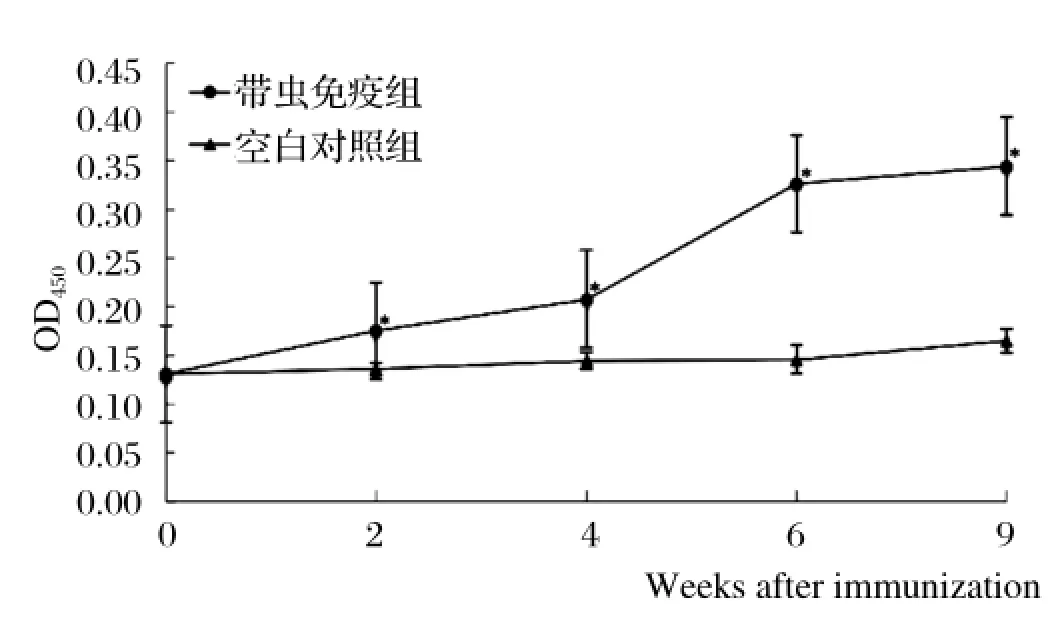
图2 雄性尾蚴感染小鼠后特异性抗成虫可溶性全虫蛋白IgG抗体检测 (* P<0.05, ** P<0.01)Fig.2 Analysis of specifi c anti-whole worm soluble protein IgG induced in mice immunized with male parasite (* P<0.05, ** P<0.01)
为了确定该免疫反应引起的免疫类型,我们还分析了IgG1和 IgG2a的水平,IgG1是Th2免疫反应的标志,IgG2a是Th1免疫的标志。通过ELISA的结果发现,单性免疫后,前2 w IgG1水平缓慢上升,第2 w 至第7 w 快速上升,第9 w 达到峰值;IgG2a的抗体水平上升缓慢,上升幅度较小。单性免疫后,IgG1/IgG2a的比值前15d缓慢上升,第2 w 至第4 w快速上升,第4 w 至第7 w 的上升迅速,直至第9 w达到最高值,混合尾蚴感染后IgG1/IgG2a值开始不断下降(表1)。
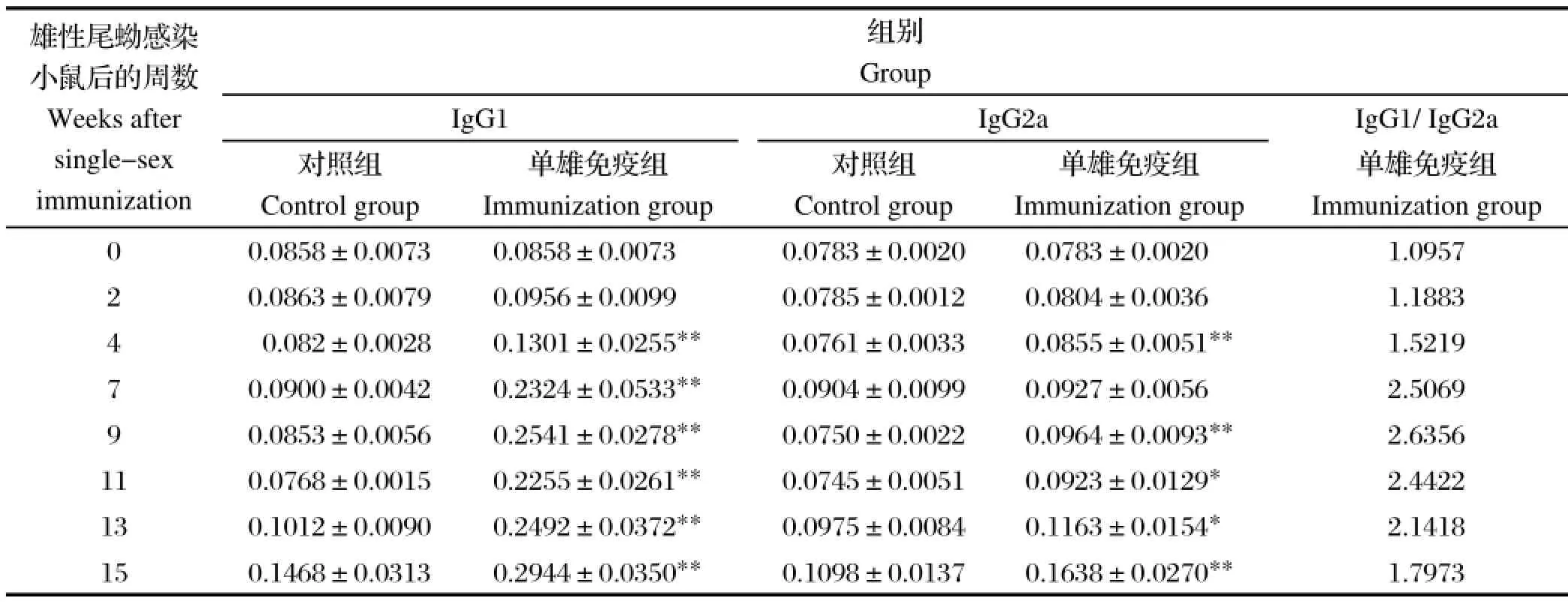
表1 雄性尾蚴感染小鼠后IgG抗体亚型的分析Table 1 IgG1 and IgG2a immune profi le induced by vaccination with single-sex male worms
2.3 单性带虫免疫的保护性效果小鼠剖杀后进行静脉灌注法冲取虫体,收集并计数。取部分小鼠肝脏用于病理切片观察,其余肝脏匀浆后一部分用于计数,一部分进行孵化毛蚴。计算减虫、减卵、减孵化和减合抱率。结果发现单性免疫的小鼠相比空白小鼠出现了显著的减孵化率,第1次实验的减孵化率为85.59%,重复实验的减孵化率为85.70%(表2)。
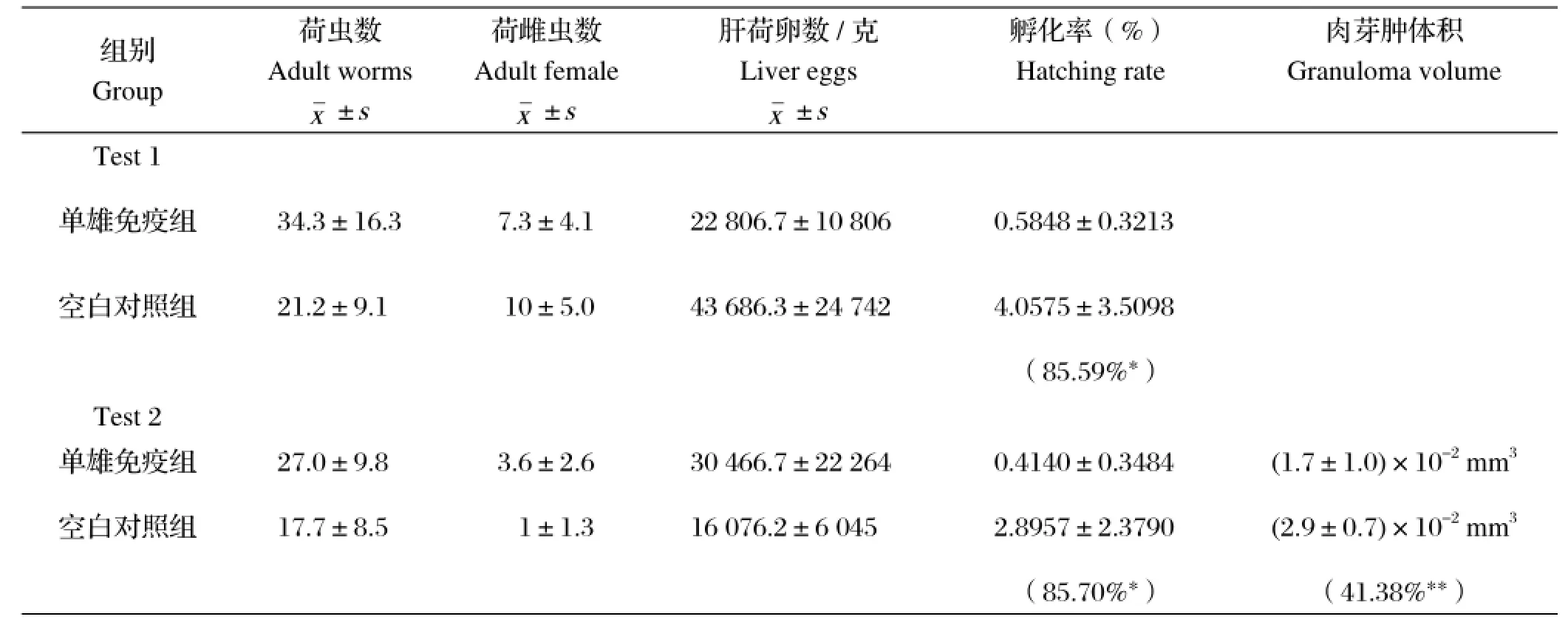
表2 两次免疫保护结果分析Table 2 Protective levels of BALB/c mice immunized with single-sex male cercaria in two experiments
在虫卵肉芽肿大小比较上发现,单雄带虫免疫组与对照组的单卵肉芽肿的体积分别为(1.7±1.0)×10-2mm3、(2.9±0.7)×10-2mm3。与对照组相比,单雄带虫免疫组小鼠肝脏单个虫卵肉芽肿的体积减小率为41.4%,且差异具有极显著统计学意义(P<0.01)。肝脏虫卵肉芽肿的形态学观察发现,对照组肝脏虫卵肉芽肿周围有大量嗜酸性粒细胞为主的炎性细胞浸润,单雄免疫组的肝脏虫卵周围仅有少量嗜酸性粒细胞聚集(图3)。
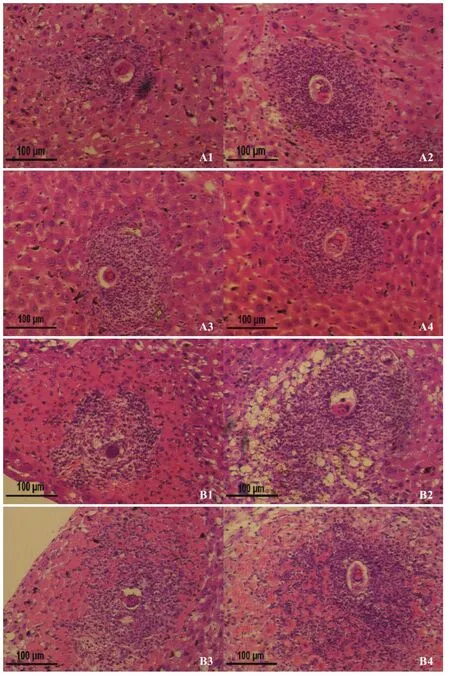
图3 虫卵肉芽肿形态学观察Fig.3 Histological morphology of egg granuloma
3 讨论
本研究利用单性感染的血吸虫雄虫对宿主进行了带虫免疫,对实验组和对照组之间减虫、减肝卵负荷、肝虫卵孵化减少及宿主肝脏的单个虫卵肉芽肿体积减小情况进行了统计,对单性血吸虫雄虫带虫免疫对宿主继发血吸虫病的免疫保护作用进行了评估。结果显示虽然单性血吸虫雄虫带虫免疫在减虫、减宿主肝卵负荷方面并没有保护性效果,但在两次独立的免疫保护试验中,带虫免疫组获得了稳定的较高水平的肝卵减孵化效果,虫卵孵化效果分别减少85.6%、85.7%;其中一次实验,宿主肝脏的单虫卵肉芽肿体积减小41.38%,显示了较好的抗疾病传播和抗病理效果。
本研究中,单性带虫免疫并没有减虫和减肝卵负荷效果。相反,由于吡喹酮对童虫期的血吸虫杀灭效果并不理想,带虫免疫组最终携带虫体反而多于空白对照组,这也从侧面说明由于没有和雌虫合抱,单性感染的雄虫在体内发育至5~7 w时仍处于童虫状态,因而不能被吡喹酮完全杀灭(我们前期的实验结果也证明吡喹酮不能完全杀灭单性感染的虫体)。以往在血吸虫疫苗研究中,肝卵负荷减少率被作为一项衡量候选抗原优劣的参数,但我们从相关研究中发现:宿主肝卵负荷与感染时进入宿主体内发育成熟的雌虫数目极为相关。
正常情况下,生物体内的免疫状态处于动态平衡,共同维持体内的细胞免疫和体液免疫,但其动态平衡又受着多种因素的调节。先前研究表明曼氏血吸虫感染小鼠后,在感染的早期,即血吸虫成虫产卵之前以Th1型免疫反应为主,而感染后期,即成虫产卵后则以Th2型免疫反应为主[12,13]。很多报道显示,当Th细胞向Th1亚群分化时,其诱导的以细胞免疫为主的Th1型免疫反应对血吸虫感染具有免疫保护作用,且Th1型免疫反应对虫卵肉芽肿的纤维化有抑制作用;而Th2型免疫反应对肉芽肿的形成及纤维化起关键作用[14]。本研究对单性雄虫免疫小鼠后抗体水平变化的分析表明,单雄免疫小鼠可刺激宿主产生针对血吸虫的特异性抗体。对IgG1和IgG2a抗体亚型水平分析发现在单性免疫后,IgG1和IgG2a水平不断升高,但是IgG1升高幅度大,IgG2a水平升高幅度小,IgG1/IgG2a的比值在不断的升高,宿主机体呈现Th2免疫发应类型;但继发血吸虫感染后,宿主体液内IgG1水平变化幅度甚微,而IgG2a快速上升,IgG1/IgG2a比值不断下降,这说明在宿主继发血吸虫病后,单雄带虫免疫诱导宿主向有保护作用的Th1型免疫反应类型转化[15],并最终减轻了宿主的病理损伤(宿主肝脏虫卵肉芽肿显著减小)。
血吸虫病是一种以虫卵肉芽肿和肝纤维化为主要病变特征的免疫性疾病,血吸虫所致病变的严重程度,直接影响到血吸虫病的病情和预后。虫卵肉芽肿对宿主的致病影响远远大于尾蚴侵入、童虫移行、成虫定居。因此控制肉芽肿的发展,尽量减轻免疫病理损伤,应是目前提高对宿主保护作用的有效途径。血吸虫虫卵肉芽肿一定程度上反映了血吸虫病造成的损伤程度,虫卵肉芽肿的大小也能在一定情况下说明免疫保护效果。日本血吸虫成熟雌虫每天约产500~3500虫卵,部分沉积于肝脏,沉积在宿主体内的卵经10 d左右发育为毛蚴,发育成熟的血吸虫毛蚴分泌的SEA会引起宿主的炎症反应,导致宿主肝脏肉芽肿的形成,引起宿主肝组织的坏死,造成严重的病理损害。而单性带虫免疫组小鼠肝脏虫卵肉芽肿的体积明显减小,可能是由于单性带虫免疫组小鼠肝脏内的血吸虫虫卵不能正常发育为成熟毛蚴,进而导致分泌的SEA减少。这种分泌SEA的减少对降低宿主病理损伤具有重要意义。
同时,血吸虫为吸虫中独特的雌雄异体形式,发育成熟雌虫所产虫卵不仅会沉积在宿主肝脏中引起宿主严重的病理反应,流入肠系膜的虫卵也会引起宿主肠道炎症进而造成组织破溃,且最终落入肠腔并随粪便排出体外,污染水体并造成血吸虫病的进一步传播。本研究中单性免疫组的虫卵孵化率显著降低(>85%),可在一定程度上减弱该病的传播[16]。
因此,单性带虫免疫不仅能够明显减轻宿主继发血吸虫病时的病理损害,而且能够大大降低虫卵的孵化率,可阻抑血吸虫病传播和降低宿主病理损害,这一结果对以后血吸虫病疫苗研制具有一定的指导意义。
参考文献
[1] Bergquist N R. Schistosomiasis: from risk assessment to control[J]. Trends Parasitol, 2002, 18(7): 309-314.
[2] Engels D, Chitsulo L, Montresor A,et al. The global epidemiological situation of schistosomiasis and new approaches to control and research[J]. Acta Trop, 2002, 82(2): 139-146.
[3] Utzinger J, Raso G, Brooker S,et al. Schistosomiasis and neglected tropical diseases: towards integrated and sustainable control and a word of caution[J]. Parasitology, 2009, 136(13): 1859-1874.
[4] Mathers C D, Ezzati M,Lopez A D. Measuring the burden of neglected tropical diseases: the global burden of disease framework[J]. PLoS Negl Trop Dis, 2007, 1(2): e114.
[5] 吴月英, 宁安. 血吸虫对吡喹酮抗药性的研究现状[J]. 中国人兽共患病学报, 2009, 25(1): 83-85.
[6] Reynolds S R, Harn D A. Comparison of irradiatedcercaria schistosome vaccine models that use 15 and 50 kilorad doses: the 15 kilorad dose gives greater protection, smaller liver sizes, and higher gamma interferon levels after challenge[J]. Inf Immun, 1992, 60(1): 90-96.
[7] Shi Y E. Schistosoma japonicum: an ultravioletattenuated cercarial vaccine applicable in the field for water buffaloes[J]. Exp Parasitol, 1990, 71(1): 100-106,
[8] Hsu S Y. Evaluation of lung recovery ass ay for schistosomula in mice immunized with x-irradiated cercariae of Schistosoma mansoni[J]. Z Parasitenkd, 1979, 59(3): 235-243.
[9] 陈家旭, 刘述先, 曹建平, 等. 日本血吸虫97 kDaDNA疫苗与致弱尾蚴疫苗诱导免疫应答特征的比较研究[J]. 中国寄生虫学与寄生虫病杂志, 2002, 20(5): 257-261.
[10] 黄柏青, 金露萍, 李巧, 等. 不同条件饲养钉螺和释放尾蚴的对比观察[J]. 中国民康医学, 2007, 19(7): 523-524.
[11] Hsu S Y, Hsu H F, Davis J R,et al. Comparative studies on the lesions caused by egg of Schistosoma japonicum and Schistosoma mansoni in livers of albino mice and rhesus monkeys[J]. Ann Trop Med Parasitol, 1972, 66(1): 89-97.
[12] Sher A D, Fiorentino P, Casper E,et al. Production of IL-10 by CD4T lymphocytes correlates with downregulation of Th1 cytokine synthesis[J]. J Immunol, 1991, 147(8): 2713-2716.
[13] Kaplan M H, Whitefield J R, Boros D L,et al. Th2 cells are required for the Schistosoma mansoni egg-induced granulomatous response[J]. J Immunol, 1998, 160(4): 1850-1856.
[14] 程喻力, 宋文剑, 孔争, 等. STAT4和STAT6对日本血吸虫发育生殖及虫卵肉芽肿形成的影响[J].中国血吸虫病防治杂志, 2011, 23(1): 61-64.
[15] Cardoso F C, Macedo G C, Gava E,et al. Schistosoma mansoni tegument protein Sm29 is able to induce a Th1-type of immune response and protection against parasite infection[J]. PLoS Negl Trop Dis, 2008, 2(10): e308.
[16] 刘萍萍. 日本血吸虫抱雌沟蛋白相互作用分子的鉴定及两个相关蛋白的研究[D]. 北京: 中国农业科学院, 2011.
EFFECT OF INFECTION OF SINGLE-SEX SCHISTOSOMA ON SECONDARY SCHISTOSOMIASIS
QIAO Hong-bin, CAO Yu-fan, HAN Yu, SHI Yao-jun, LU Ke, LI Hao, LIU Jin-ming, LIN Jiao-jiao, JIN Ya-mei
(Key Laboratory of Animal Parasitology of the Ministry of Agriculture, Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
Previous studies have shown that irradiated schistosome cercariae can induce higher immunoprotection. In the hosts, the radiation attenuated cercariae can neither mature nor cause serious pathological damage. Single-sex schistosoma perform similar behaviors but induce uninterrupted immune stimulation. Whether or not single-sex schistosoma can induce immune protection in hosts is unknown. To explore this problem,we fi rst infected male BALB/c mice with single-sex male schistosoma and then examined its impact on the secondary schistosomiasis. BALB/c mice were randomly divided into two groups. Each mouse in test group was infected with 100 male cercariae and untreated mice used as controls. At 5 and 7 weeks post-infection, all mice in two groups were treated with praziquantel (300 mg/kg). Then at 9 weeks post-infection, all mice were infected with 40 sex-mixed cercariae. At 15 weeks post-infection, all mice were sacrifi ced and liver tissues and blood samples were collected for detection of eggs, pathological changes and seroconversion. The results showed that single-sex male worm caused signifi cant reduction in eggs hatching rate and pathological damages in livers, indicating a certain immunoprotective effect in hosts.
S852.735
A
1674-6422(2014)03-0041-07
2014-03-20
中央级公益性科研院所基本科研业务费项目(2012ZL091;2013JB17)
乔洪宾,男,硕士研究生,预防兽医学专业
金亚美, E-mail: yameijin@ shvri.ac.cn
——以江苏省为例

