丹参酮ⅡA诱导体外胃癌细胞的自噬
赵雪峰, 魏敬妙, 李 勇*, 张志栋, 贾 楠
(1.河北医科大学第四医院普外科, 河北 石家庄 050011; 2.河北医科大学第四医院肝胆外科, 河北 石家庄 050011)
丹参酮ⅡA诱导体外胃癌细胞的自噬
赵雪峰1, 魏敬妙2, 李 勇1*, 张志栋1, 贾 楠1
(1.河北医科大学第四医院普外科, 河北 石家庄 050011; 2.河北医科大学第四医院肝胆外科, 河北 石家庄 050011)
目的 探讨丹参酮ⅡA体外对人胃癌 SGC7901 细胞自噬的影响, 初步探讨其抑制肿瘤的机制。 方法 MTT法检测不同质量浓度 (0.5、 1、 2 和 4 μg/mL) 丹参酮ⅡA作用体外培养的胃癌 SGC7901 细胞共孵 24、 48、 72 h 后, 细胞增殖活力的改变; 1、 2 和 4 μg/mL丹参酮ⅡA作用 SGC7901 细胞 48 h 后, 流式细胞术检测细胞凋亡率和细胞自噬小体的水平; 实时定量 RT-PCR和 Western blot分别测定自噬相关蛋白 Beclin 1、 磷酸酯酶与张力蛋白同源物 ( PTEN) 、LC3-Ⅱ和 LC3-I的 mRNA和蛋白的表达水平。 结果 0.5 μg/mL丹参酮ⅡA对胃癌 SGC7901 细胞没有明显的生长抑制作用, 1 μg/mL以上各质量浓度丹参酮ⅡA对胃癌 SGC7901 细胞则有明显的生长抑制作用; 流式细胞分析结果显示, 与对照组相比, 丹参酮ⅡA诱导细胞凋亡 (P<0.05); 细胞内酸性自噬小体含量增加 (P<0.05); 实时定量 RTPCR和 Western blot结果显示, 与对照组相比, Beclin-1、 PTEN和 LC3-ⅡmRNA和蛋白表达水平逐渐升高, LC3-I表达下降 (P<0.05)。 结论 丹参酮ⅡA可诱导人胃癌 SGC7901 细胞自噬, 其机制可能涉及上调自噬相关基因表达Beclin-1, 促进自噬标志蛋白 LC3-I向 LC3-Ⅱ转化, 促进自噬调控蛋白 PTEN表达。
丹参酮ⅡA;胃癌;自噬
KEY WORDS: tanshinoneⅡA; gastric cancer; autophagy
中医学理论认为,“瘀血在经络脏腑之间,结为症瘕 (肿瘤)”, 基于肿瘤与血瘀证的关系, 临床常采用丹参、当归、莪术等活血化瘀药进行抗肿瘤治疗, 并取 得了良 好的疗效[1]。 丹参 酮 ⅡA (tanshinoneⅡA, Tan ⅡA)是丹参 Salvia miltiorrhiza中提取的重要脂溶性单体成分之一,近年的研究表明,丹参酮ⅡA具有广泛的抗肿瘤活性,可抑制细胞生长、 诱导凋亡和分化[2]。 自噬是细胞通过溶酶体降解自身受损的细胞器和大分子物质的过程。由于多肿瘤细胞均发生自噬活性的改变,因此,肿瘤治疗中,以自噬为靶标的药物的研发受到广泛关注[3]。 丹参酮ⅡA对人胃癌细胞自噬作用的研究国内外尚未见报道。本实验主要通过观察丹参酮ⅡA对胃癌 SGC-7901 细胞自噬的影响, 探讨其对胃癌抑制的作用机制。
1 材料和方法
1.1 药物及试剂及主要仪器 SGC-7901 细胞为人胃癌细胞株,购自中国科学研究院上海细胞研究所。 胎牛血清、 RPMI 1640 细胞培养基、 胰蛋白酶, 购自美国 GIBCO公司; MTT和丹参酮ⅡA( 纯度 >99%) 购 自 Sigma公 司; 吖 啶 橙 购 自Sigma-Aldrich 公司, Beclin 1、磷酸酯酶与张力蛋白同源物 ( PTEN) 、 LC3-Ⅱ、 LC3-I和 β-actin 抗体购 自 Santa Cruz公 司; TRIzol试 剂 为 美 国 invitrogen 公司产品;逆转录试剂盒为 Promega公司产品; Real-Time PCR试 剂 盒 为 fermentas公 司 产品; 引物由上海生工生物技术公司合成。 Real-Time PCR仪为美国 ABI公司产品; Becton Dickinsor FACscan 流式细胞仪为美国 BD公司产品; 电泳和 转 膜系 统 为 Bio-Rad 公 司 产 品; PVDF膜 为Millipore公司产品。
1.2 细胞培养 SGC-7901 细胞在含有 10%胎牛血清、 100 kU/L青霉素和 100 mg/L链霉素的 RPMI 1640 培养基中培养, 在含 5%CO2、 37 ℃条件下恒温孵育。 每 3 天用含 0.02%EDTA的 0.25%胰蛋白酶溶液消化以1∶3的比例传代。
1.3 MTT SGC7901 细胞以 5 ×103个/mL密度接种于 96 孔板,于 37 ℃和 5%的 CO2条件下培养24 h后, 用含有不同质量浓度的丹参酮ⅡA(0.5、1、 2、 4 μg/mL) 分别处理细胞 24、 48、 72 h, 对照组加入 0.1%DMSO。 每组设置 6 个复孔。 各实验组于实验结束前4 h 加入 20 μL的 MTT(质量浓度为 5 mg/mL), 培养 4 h 后弃去培养液, 加入DMSO 150 μL于室温振荡 15 min 使结晶溶解, 酶标仪于490 nm处测光密度值 (OD值), 以 OD值表示 SGC7901 细胞增殖能力。 以上实验重复 3 次。
1.4 AnnexinV/PI流式细胞分析法检测细胞凋亡5 ×103个/mL接种于 12 孔板中, 于 37 ℃和 5%的 CO2条件下培养24 h 后, 加入不同质量浓度的丹参酮ⅡA(1、 2 和 4 μg/mL), 分别处理细胞 48 h,溶剂对照加入0.1%DMSO。 收集各组细胞 (包括培养基中的和贴壁的), 用冷的 PBS 清洗 1 遍, 每管加入 500 μL结合缓冲液和 5 μL的 AnnexinV和 PI,室温避光染色 5 min, 用流式细胞仪检测细胞凋亡。
1.5 细胞自噬小体的定量检测 SGC-7901 细胞以5 ×103个/mL接种于 6 孔板, 于 37 ℃和 5%的CO2条件下培养 24 h, 用不同质量浓度的丹参酮ⅡA(1、 2 和 4 μg/m L) 分别处理细胞 48 h, 溶剂对照加入 0.1%DMSO,收集各组细胞, 用吖啶橙 (1 μg/mL) 室温避光染色 20 min,离心后弃去染液, 用 1 ×PBS 清洗 3 次后, 再用 1 ×PBS 重悬细胞, 上流式细胞仪检测荧光信号, FL1 通道检测绿色荧光,FL3 通道检测红色荧光,以红色荧光的强弱反映细胞内酸性自噬小体的多少。
1.6 总 RNA 提取及 Real-Time PCR SGC-7901细胞以 5 ×103个/mL接种于 6 孔板, 于 37 ℃和5%的 CO2条件下培养24 h, 用不同质量浓度的丹参酮Ⅱ A (1、 2、 4 μg/mL) 作用 SGC7901 细胞48 h, 溶剂对照加入 0.1%DMSO, 收集各组细胞,用 Trizol试剂提取各组细胞总 RNA, 紫外分光光度仪测定 RNA浓度及纯度, 并经电泳鉴定后进行逆转录, 以 cDNA为 模板进行 Real-Time PCR 反应。以 GAPDH为内参照。
Beclin1 基因上游引物 5′-ATCCTGGACCGTGTCACCATCCAGG-3′, 下游引物 5′-GTTGAGCTGAGTGTCCAGCTG G-3′。 LC3-I上 游 引 物 5′-TCCCGGACCATGTCAACAT-3′; 下 游 引 物 5′-ACCATGCTGTGCTGGTTCAC-3′。 LC3-Ⅱ上游引 物 5′-ACCATGCCGTCGGAGAAG-3′;下游引物 5′-ATCGTTCTATTATCACCGGGATTTT-3′。 PTEN上游引物 5′-TCACCAACTGAAGTGGCTAAAGA-3′; 下游引物 5′-CTCCATTCCCCTAACCCGA-3′。 GAPDH 上 游 引物 5′-GTAAAGACCTCTATGCCATCA-3′; 下 游 引 物 5′-GGACTCATCGTACTCCTGCT-3′。
根据实时荧光定量扩增曲线获取目的基因和内参基 因 的 Ct值, 以 目 的 基 因 Beclin 1、 PTEN、LC3-Ⅱ和 LC3-I表达的相对定量值 (RQ值) 进行统计学分析。1.7 Western blot检测自噬相关分子的蛋白水平SGC-7901 细胞以 5 ×103密度接种于 6 孔板, 于 37℃和5%的 CO2条件下培养24 h, 用不同质量浓度的丹参酮ⅡA(1、 2 和 4 μg/mL) 作用 SGC7901 细胞 48 h, 溶剂对照加入 0.1%DMSO,收集各组细胞, 用 裂 解 缓 冲 液 (50 mmol/L Tris pH 7.2, 1% Triton X-100, 0.5% 脱氧胆酸 钠, 0.1% 十二烷基硫 酸 钠 , 500 mmol/L NaCl, 10 nmol/L MgCl2, 10 mg/mL亮 抑 蛋 白 酶 肽, 10 mg/mL 抑 肽 酶, 1 mmol/L苯甲基磺酰氟) 裂解整个细胞, 细胞总蛋白经 10%SDS-PAGE分 离 后 转 到 PVDF膜 上。PVDF膜在5%脱脂奶粉室温封闭 1 h, 各目标分子特异性一抗4℃过夜,接着,用辣根过氧化酶标记的相应的二抗室温孵育 2 h。 ECL法检测结合的目的条带。 以磷酸生油醛脱氢酶 (GAPDH) 作为内参 照, 用 目 的 蛋 白 Beclin 1、PTEN、 LC3-Ⅱ 和LC3-I光密度值/内参照光密度值的比值进行比较。1.8 统计学方法 计量资料以表示, 采用SPSS 13.0 统 计 分 析 软 件 进 行 单 因 素 方 差 分 析 和Dunnett检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 丹参酮ⅡA抑制 SGC7901 细胞增殖 丹参酮ⅡA(0.5、 1、 2 和 4 μg/m L) 作用 SGC7901 细胞 24、 48、72 h 后, 与 对 照 组 相 比, 1、2、4 μg/mL丹参酮ⅡA对胃癌细胞以质量浓度和时间依赖的方式抑制细胞增殖 (P<0.05)。 结果见表 1。
2.2 丹参酮ⅡA诱导 SGC7901 细胞凋亡 丹参酮ⅡA (1、 2、 4 μg/mL) 作 用 SGC7901 细 胞 48 h后,流式细胞分析结果显示,与溶剂对照组细胞凋亡率相比,各质量浓度丹参酮ⅡA明显诱导细胞凋亡 (P<0.05)。 结果见表 2。
表1 丹参酮ⅡA对 SGC7901 细胞增殖的影响 (, n=6)Tab.1 Effect of TanⅡA to Proliferation for gastric cancer cells line SGC7901 (, n=6)
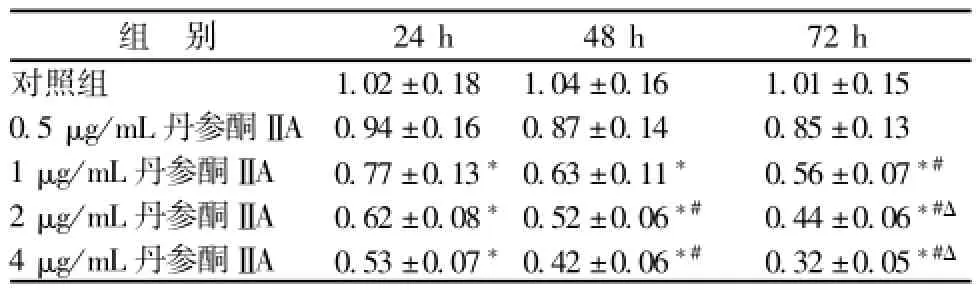
表1 丹参酮ⅡA对 SGC7901 细胞增殖的影响 (, n=6)Tab.1 Effect of TanⅡA to Proliferation for gastric cancer cells line SGC7901 (, n=6)
注: 与对照组比较,*P<0.05; 与同组 24 h 比较,#P<0.05;与同组48 h 比较,ΔP<0.05
组 别 24 h 48 h 72 h对照组 1.02 ±0.18 1.04 ±0.16 1.01 ±0.15 0.5 μg/mL丹参酮 ⅡA 0.94 ±0.16 0.87 ±0.14 0.85 ±0.13 1 μg/mL丹参酮ⅡA 0.77 ±0.13*0.63 ±0.11* 0.56 ±0.07*#2 μg/mL丹参酮ⅡA 0.62 ±0.08*0.52 ±0.06*# 0.44 ±0.06*#Δ4 μg/mL丹参酮ⅡA 0.53 ±0.07*0.42 ±0.06*# 0.32 ±0.05*#Δ
表 2 丹参酮ⅡA对 SGC7901 细胞细胞凋亡率、 自噬小体的影响 (, n=6)Tab.2 Effect of TanⅡA to aPoPtosis for gastric cancer cells line SGC7901 (, n=6)

表 2 丹参酮ⅡA对 SGC7901 细胞细胞凋亡率、 自噬小体的影响 (, n=6)Tab.2 Effect of TanⅡA to aPoPtosis for gastric cancer cells line SGC7901 (, n=6)
注: 与对照组比较,*P<0.05
组 别 细胞凋亡率/% 自噬小体 /%对照组 2.92 ±0.35 4.16 ±0.64 1 μg/m L丹参酮ⅡA 8.73 ±1.51* 9.77 ±1.92*2 μg/m L丹参酮ⅡA 12.24 ±2.27* 13.28 ±2.95*4 μg/m L丹参酮ⅡA 15.39 ±3.15* 16.54 ±3.28*
2.3 丹参酮ⅡA促进 SGC7901 细胞生成酸性自噬小体 与溶剂对照组酸性自噬小体的比例相比,丹参酮ⅡA组酸性自噬小体的比例明显增加 (P<0.05), 表明丹参酮ⅡA可诱导 SGC7901 细胞自噬。结果见表2。
2.4 丹参酮ⅡA对 SGC7901 细胞自噬相关蛋白表达的影响 为了进一步观察丹参酮ⅡA对 SGC7901细胞自 噬 影响的 机 制,通过 real-time RT-PCR和Western blot对 自 噬 相 关 蛋 白 Beclin-1、 PTEN、LC3-I和 LC3-ⅡmRNA和蛋白水平进行了检测, 结果表明, 与对照组相比, 丹参酮ⅡA作用 SGC7901细胞 48 h 后, Beclin-1、 PTEN和和蛋白表达水平逐渐 升 高, LC3-I表 达 下 降,除 1 μg/mL丹 参酮ⅡA组 LC3-ⅡmRNA外, 其他差异均有统计学意义 (P<0.05)。 结果见表 3, 表 4, 图 1。
表 3 丹 参酮ⅡA对 SGC7901 细胞 Beclin 1、 PTEN、 LC3-Ⅱ 和 LC3-I m RNA的影响 (, n=3)Tab.3 Effect of TanⅡ A to Beclin 1, PTEN, LC3-Ⅱ,LC3-I m RNA in gastric cancer cells line SGC7901(, n=3)
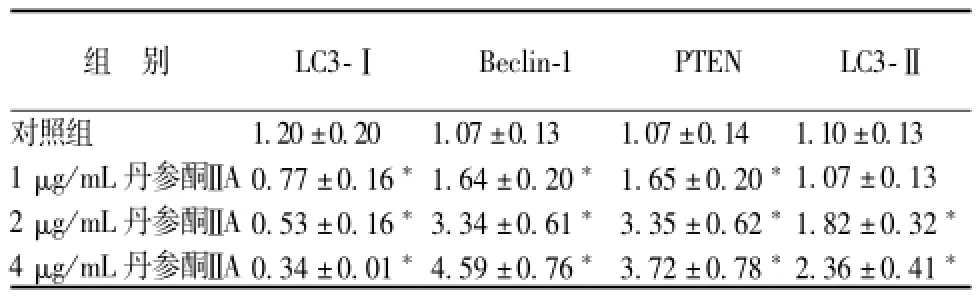
表 3 丹 参酮ⅡA对 SGC7901 细胞 Beclin 1、 PTEN、 LC3-Ⅱ 和 LC3-I m RNA的影响 (, n=3)Tab.3 Effect of TanⅡ A to Beclin 1, PTEN, LC3-Ⅱ,LC3-I m RNA in gastric cancer cells line SGC7901(, n=3)
注: 与对照组比较,*P<0.05
组 别 LC3-Ⅰ Beclin-1 PTEN LC3-Ⅱ对照组 1.20 ±0.20 1.07 ±0.13 1.07 ±0.14 1.10 ±0.13 1 μg/mL丹参酮ⅡA 0.77 ±0.16*1.64 ±0.20*1.65 ±0.20*1.07 ±0.13 2 μg/mL丹参酮ⅡA 0.53 ±0.16*3.34 ±0.61*3.35 ±0.62*1.82 ±0.32*4 μg/mL丹参酮ⅡA 0.34 ±0.01*4.59 ±0.76*3.72 ±0.78*2.36 ±0.41*
表 4 丹 参酮ⅡA对 SGC7901 细胞 Beclin 1、 PTEN、 LC3-Ⅱ和 LC3-I 蛋白的影响 (, n=3)Tab.4 Effect of TanⅡ A to Beclin 1, PTEN, LC3-Ⅱ,LC3-I Protein in gastric cancer cells line SGC7901 (, n=3)
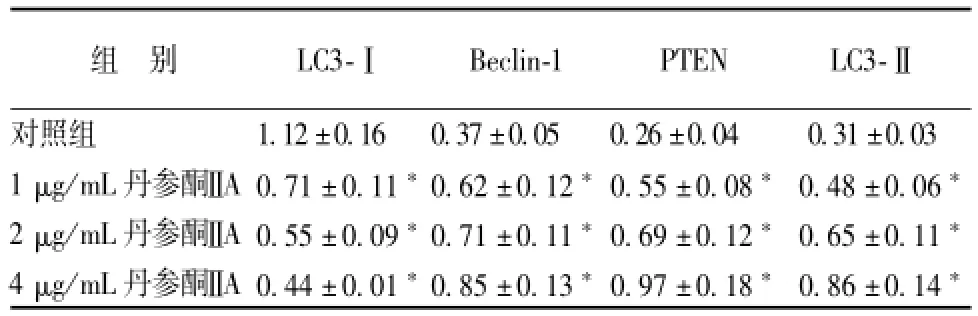
表 4 丹 参酮ⅡA对 SGC7901 细胞 Beclin 1、 PTEN、 LC3-Ⅱ和 LC3-I 蛋白的影响 (, n=3)Tab.4 Effect of TanⅡ A to Beclin 1, PTEN, LC3-Ⅱ,LC3-I Protein in gastric cancer cells line SGC7901 (, n=3)
注: 与对照组比较,*P<0.05
组 别 LC3-Ⅰ Beclin-1 PTEN LC3-Ⅱ对照组 1.12 ±0.16 0.37 ±0.05 0.26 ±0.04 0.31 ±0.03 1 μg/mL丹参酮ⅡA 0.71 ±0.11*0.62 ±0.12*0.55 ±0.08*0.48 ±0.06*2 μg/mL丹参酮ⅡA 0.55 ±0.09*0.71 ±0.11*0.69 ±0.12*0.65 ±0.11*4 μg/mL丹参酮ⅡA 0.44 ±0.01*0.85 ±0.13*0.97 ±0.18*0.86 ±0.14*

图 1 丹参 酮 ⅡA对 SGC7901 细 胞 Beclin 1、 PTEN、LC3-Ⅱ和 LC3-I蛋白的影响Fig.1 Effect of TanⅡ A to Beclin 1, PTEN, LC3-Ⅱ , LC3-I Protein in gastric cancer cells line SGC7901 (, n=3)
3 讨论
近年研究发现一些中国传统中药具有明显的抗肿瘤活性。已有研究证实,丹参酮ⅡA是具有广泛抗癌作用的新型抗癌中药单体,可抑制等多种癌细胞生长。丹参酮ⅡA可通过抑制胃癌细胞增殖促进凋亡抑制胃癌生长[4-5], 但对胃癌自噬的影 响未见报道。自噬对于细胞存活而言可谓是把双刃剑,一方面当细胞在机体出现感染或者缺氧等应激刺激时,自噬会保护细胞使其存活,如果应激持续时间太长,则可出现自噬性细胞死亡。可见,细胞发生自噬有可能促进生长也有可能抑制细胞生长。因此,若能有效调控自噬,将对癌症治疗和退行性疾病的疗效有很大提高[6]。
本实验首先观察了丹参酮ⅡA对胃癌细胞株SGC7901 增殖和凋亡的影响, 与报道一致, 本实验也发现丹参酮ⅡA可抑制细胞生长促进其凋亡。有报道表明,某些抗肿瘤药物在促进凋亡的同时会促进细胞自噬[7-8]。 自噬的 重要特征是胞质内 大量的酸性自噬小体形成,这些酸性自噬小体吞噬了细胞质和 (或) 细胞器后, 经过吖啶橙染色呈现出亮红色荧光,且荧光强度可反映酸性自噬小体的酸度和 (或) 容积。本实验通过流式细胞仪检测红色荧光的强度, 初步证实了丹参酮ⅡA作用 SGC7901细胞后,细胞自噬增加。
自噬是受一系列自噬相关基因调控的,比如Beclin 1 基因是研究较多的自噬相关基因, 可通过促进自噬抑制肿瘤的生长,是候选的肿瘤抑制基因[5]。 有研究发现胃癌组织中 Beclin 1 的阳性表达率低于正常组织, 且 Beclin 1 的蛋白表达水平与胃癌分化程度有关[9]。 最近有人认为 Beclin 1 可作为有淋巴结转移的胃癌患者生存时间的预测因子[10]。PTEN是已知的抑癌基因, 可使细胞自噬开启, 研究表明 PTEN的突变 可 抑制自噬[11-12]; 而且 PTEN的阳性表达率与胃癌组织的分化程度、浸润深度、淋 巴 转 移 呈 正 相 关[6]。 因 此, 认 为 Beclin 1 和PTEN高表达可促进胃癌自噬, 本实验的结果也表明, 丹参酮ⅡA作用后, Beclin 1 和 PTEN的表达随着质量浓度增加逐渐升高。
LC3, 即微管相关蛋白 1 轻链 3,酵母自噬相关蛋白8在哺乳动物的同源类似物,是目前自噬的唯一标志蛋白[13-14]。 LC3 有两种存在形式: LC3-Ⅰ和 LC3-Ⅱ[15], 自 噬 发 生 时, LC3-Ⅰ 可 转 化 形 成LC3-Ⅱ,二者的水平和比值可以反应细胞自噬活性。 通过实时定量 PCR和 Western blot分析, 发现丹参酮ⅡA作用后 LC3-ⅡmRNA和蛋白表达水平逐渐 升 高, LC3-Ⅰ 表 达 下 降, 出 现 LC3-Ⅰ 向LC3-Ⅱ的转化, 此结果提示丹参酮ⅡA可促进胃癌自噬,其具体机制值得进一步探索。
综上所述,丹参酮ⅡA可通过促进自噬相关基因 Beclin 1、 PTEN和 LC3-Ⅱ的表达促进细胞自噬。然而,由于自噬在肿瘤的作用及机制还存在较大争议以及自噬的复杂性,需要进行更深入的研究以明确丹参酮ⅡA对胃癌自噬的影响。
[ 1 ] 闫俊杰, 陈信义.恶性肿瘤与活血化瘀研究进展[J].北京中医药大学学报, 2000, 23(S1): 77-79.
[ 2 ] Zhang Y, Wei R X, Zhu X B, et al.TanshinoneⅡA induces apoptosis and inhibits the proliferation, migration, and invasion of the osteosarcoma MG-63 cell line in vitro[ J] .Anticancer Drugs, 2012, 23(2) : 212-219.
[ 3 ] Han J, Hou W, Goldstein L A, et al.Involvementof protective autophagy in TRAIL resistance of apoptosis-defective tumor cells[ J] .JBiol Chem, 2008, 283(28) : 19665-19677.
[ 4 ] Chen J, Shi D Y, Liu S L, et al.TanshinoneⅡ A induces growth inhibition and apoptosis in gastric cancer in vitro and in vivo[ J] .Oncol Rep, 2012, 27(2) : 523-528.
[ 5 ] Dong X, Dong J, Peng G.Growth-inhibiting and apoptosis-inducing effects of tanshinoneⅡ A on human gastric carcinoma cells[ J] .J Huazhong Univ Sci Technolog Med Sci, 2007, 27(6): 706-709.
[ 6 ] Dalby K N, Tekedereli I, Lopez-Berestein G, et al.Targeting the prodeath and prosurvival functions of autophagy as noveltherapeutic strategies in cancer[ J] .Autophagy, 2010, 6( 3 ):322-329.
[ 7 ] Li X, Fan Z.The epidermal growth factor receptor antibody cetuximab induces autophagy in cancer cells by downregulating HIF-1alpha and Bcl-2 and activating the beclin 1/hVps34 complex[ J] .Cancer Res, 2010, 70(14) : 5942-5952.
[ 8 ] Sasaki K, Tsuno N H, Sunami E, et al.Chloroquine potentiates the anti-cancer effect of5-fluorouracil on colon cancer cells[J].BMC Cancer, 2010, 10: 370.
[ 9 ] 郭长青, 邵经浩, 卢瑞利, 等.胃癌组织中 Beclin1 和 PTEN蛋白的表达[ J].郑州大学学报: 医学版, 2010, 45 (3):463-466.
[ 10] Geng QR, Xu D Z, He L J, etal.Beclin-1 expression is a significant predictor of survival in patientswith lymph node-positive gastric cancer[ J] .PLoSOne, 2012, 7(9) : e45968.
[11] Arico S, Petiot A, Bauvy C, etal.The tumor suppressor PTEN positively regulatesmacroautophagy by inhibiting the phosphatidylinositol 3-kinase/protein kinase B pathway[ J] .J Biol Chem, 2001, 276(38): 35243-35246.
[12] Kim E J, Jeong JH, Bae S, et al.mTOR inhibitors radiosensitize PTEN-deficient non-small-cell lung cancer cells harboring an EGFR activatingmutation by inducing autophagy[J] .JCell Biochem, 2013, 114(6) : 1248-1256.
[13] Chang Z, ShiG, Jin J, etal.Dual PI3K/mTOR inhibitor NVPBEZ235-induced apoptosis of hepatocellular carcinoma cell lines is enhanced by inhibitors of autophagy[ J] .Int J Mol Med,2013, 31(6): 1449-1456.
[14] Li X, Yan J, Wang L, et al.Beclin1 inhibition promotes autophagy and decreases gemcitabine-induced apoptosis in Miapaca2 pancreatic cancer cells[ J] .Cancer Cell Int, 2013, 13(1): 26.
[15] Zhou Z R, Zhu X D, Zhao W, et al.Poly( ADP-ribose) polymerase-1 regulates themechanism of irradiation-induced CNE-2 human nasopharyngeal carcinoma cell autophagy and inhibition of autophagy contributes to the radiation sensitization of CNE-2 cells[J] .Oncol Rep, 2013, 29(6) : 2498-2506.
TanshinoneⅡA induces autoPhagy of human gastric cancer SGC7901 cells line in vitro
ZHAO Xue-feng1, WEI Jing-miao2, LIYong1*, ZHANG Zhi-dong1, JIA Nan1
(1.Departmentof General Surgery, The Fourth Hospital Affiliated to HebeiMedical University, Shijiazhuang 050011, China; Departmentof Hepatobiliary Surgery, The Fourth Hospital Affiliated to HebeiMedical University, Shijiazhuang 050011, China)
AIM To investigate the effect of tanshinoneⅡ A ( Tan Ⅱ A) on the autophagy of human gastric cancer SGC7901 cells and possible mechanism.M ETHODS SGC7901 cells were cultured in vitro and incubated with different concentrations(0.5, 1, 2, 4 μg/m L) TanⅡA in different time(24, 48, 72 h).MTT assay was developed to detect the cell proliferation.The cell apoptotic rate and the content of acidic vesicular organelles contentwere detected by flow cytometry in 48 h.The expressions of autophagy-associated protein Beclin 1, phosphatase and tensin homolog(PTEN), LC3-I and LC3-Ⅱ were detected by real-time RT-PCR and western blot. RESULTS TanⅡA(0.5 μg/mL) had no significant effect on proliferation of SGC7901 cells compared to DMSO group ( P>0.05 ) .Tan Ⅱ A showed a dose-and time-dependent growth inhibition at the concentration above 1 μg/mL(P<0.05) .Compared with DMSO group, the cell apoptotic rate and content acid vesicular organelles content increased with the treatment of Tan ⅡA.The results of real-time RT-PCR and western blot showed that compared with DMSO group, the expressions of Beclin 1, PTEN and LC3-Ⅱ were significantly up-regulated aswell as the experssion of LC3-Iwas significantly down-regulated (P<0.05).CONCLUSION Tan ⅡA induces the auophagy of human gastric cancer SGC7901 cells in time-and dose-dependentmanner in vitro, whichmay be related to the up-regulation of Beclin 1, PTEN and LC3-Ⅱ, as well as down-regulation of LC3-I.
R285.5
: A
: 1001-1528(2014)01-0010-05
10.3969/j.issn.1001-1528.2014.01.003
2013-02-18
赵雪峰 ( 1976—), 男, 副 主 任 医 师, 博 士, 从 事 消 化 道 肿 瘤 的 临 床 与 基 础 研 究。 Tel: 13933012139, E-mail: xuexuexue1976@126.com
*通信作者: 李 勇 (1958—), 男, 教授, 主任医师, 博士生士师, 博导, 从事消化道肿瘤的临床与基础研究。 Tel: 13931116966

