帕金森病与微量元素及氧化应激的关系
侯焕喜 王训
帕金森病(Parkinson disease, PD)是较常见的神经系统退行性疾病之一,主要病理变化为脑黑质纹状体多巴胺能神经元变性,导致多巴胺耗竭,临床特征为静止性震颤、肌强直、运动迟缓和姿势平衡障碍。目前PD的病因仍不完全清楚:少部分PD为家族性,可能由α-synuclein和Parkin等基因表达异常所致;大部分PD为散发性,可能由环境因素诱发,或者为环境因素和遗传因素共同作用的结果。本研究拟探讨PD与微量元素及氧化应激的关系。
1 对象和方法
1.1研究对象收集2009-01-2010-01安徽中医学院神经病学研究所附属医院门诊及住院的PD患者50例,依据英国帕金森病协会脑库临床诊断标准进行确诊,其中男34例,女16例,年龄50~80岁,平均(66±8)岁,所有患者未曾口服或静脉注射过任何金属络合药物。对照组40名,均为门诊健康体检者,其中男27名,女13名,年龄36~81岁,平均(64±12)岁。PD组与对照组年龄及性别构成无统计学差异(P>0.05)。
1.2方法
1.2.1血样采集:均于早晨采空腹静脉血4~5 mL,离心后留取血清放入两个1.5 mL的塑料离心管中,然后置-80℃冰箱中待测,其中一个塑料离心管中的血清用于检测微量元素、铜蓝蛋白及金属硫蛋白,另一离心管中的血清用于检测铜氧化酶、铜锌超氧化歧化酶及丙二醛。
1.2.2微量元素、金属蛋白及氧化应激相关指标测定:采用等离子体原子发射光谱法测定血清铜、锌、铁、铝、钙、镁、锰水平,采用等离子体质谱法测定血清铅水平,测定前分别用空白与标准溶液上机,当以标准溶液反复测定的同位素比值精密度<1%时,开始测定样品;利用全自动生化分析仪采用酶法检测血清铜蓝蛋白水平,以对苯二胺比色法测定血清铜氧化酶水平,血清铜锌超氧化物歧化酶活力的测定采用黄嘌呤氧化酶法,丙二醛测定利用硫代巴比妥酸比色法(均由南京建成公司提供试剂盒);采用ELISA法测定(美国ADL公司提供试剂盒)血清金属硫蛋白水平。
1.3统计学处理采用SPSS13.0统计软件进行分析,计量资料以均数±标准差表示,两均数间比较采用t检验。以P<0.05表示差异有统学意义。
2 结果
2.1血清微量元素PD组血清铜、锌水平较对照组显著降低(P<0.01),PD组血清铅水平较对照组显著升高(P<0.01),余微量元素两组间比较均无统计学差异(P>0.05,表1)。
2.2金属蛋白及氧化应激相关指标比较与对照组比较,PD组血清铜蓝蛋白、铜氧化酶活力、铜锌超氧化物歧化酶活力显著降低(P<0.01,P<0.05),而血清丙二醛水平明显升高(P<0.05),血清金属硫蛋白水平无统计学改变(P>0.05,表2)。
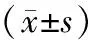
表 1 两组间血清微量元素的比较
注:与对照组比较,*P<0.01
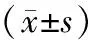
表 2 两组间血清铜蓝蛋白、铜氧化酶、金属硫蛋白等指标比较
注:与对照组比较,*P<0.05,**P<0.01
3 讨论
本研究结果显示,与对照组比较,PD组血清铜、锌水平显著降低,而血清铅水平显著升高,血清铁、钙、镁、铝及锰水平无统计学改变,表明铜、锌等在体内失稳态可能导致了PD。目前仍不清楚铜、锌的减少是PD的病因,还是参与了PD的进展。近年来已经有越来越多的证据表明微量元素,特别是参与氧化还原活性的微量元素参与了PD的发病机制,最可能的机制是通过氧化应激实现,与氧化还原活性最密切的微量元素是铁、铜和锰,增加氧化应激可以导致这些微量元素的失稳态[1]。铜、锌是主要的抗氧化剂酶(超氧化物歧化酶、过氧化氢酶和过氧化物酶)的辅助因子。本研究发现PD组血清铜锌超氧化物歧化酶活力较对照组显著降低,而血清丙二醛水平较对照组明显升高,表明氧化应激反应参与了PD的发病。
铜存在于整个大脑,而在基底核、海马、小脑、皮质锥体细胞和小脑颗粒细胞含量最多[2]。本研究发现PD患者血清铜水平偏低。关于PD患者血清铜变化的报道结果不一致。Younes-Mhenni 等[3]、Bocca等[4]及 Forte等[5]报道PD患者血清铜水平降低,Hegde等[6]报道PD患者血清铜水平增加,而Qureshi等[7]报道PD患者血清及脑脊液铜水平无明显变化。铜在体内作为许多金属蛋白质的组成部分,除参与构成铜蓝蛋白外,还参与30多种金属蛋白质和酶的构成,如细胞色素C氧化酶、酪氨酸酶、赖氨酸氧化酶、多巴胺-β-羟化酶、单胺氧化酶、超氧化物歧化酶等。本研究发现PD患者血清铜蓝蛋白和铜氧化酶较对照组明显降低,进一步支持PD患者体内缺铜的可能。铜是许多氧化还原酶的辅助因子,铜稳态失衡可能会导致自由基的产生增加,这可能参与了PD的神经病理学改变[8]。本研究还发现,铜参与的一个重要氧化还原酶——铜锌超氧化物歧化酶的活性较对照组明显降低,推测铜缺乏参与PD的机制为:铜缺乏降低了铜锌超氧化物歧化酶活力,而使机体发生氧化应激反应,促使神经元凋亡、坏死,最终导致神经变性疾病的发生。
锌存在于所有生物体中,参与体内多种生理活动,具有广泛的生理功能。在细胞的DNA复制、RNA转录、增殖、分化等活动中起重要作用,同时可调节细胞蛋白质、核酸的代谢,对调节免疫和抗氧化及维持正常的细胞周期也有一定作用[9]。在生物体内,锌对机体抗氧化体系有重要作用,它能防止细胞膜氧化、减少超氧阴离子形成。本研究发现PD组血清锌水平较对照组显著降低,这与Hegde等[6]和Qureshi等[7]报道的结果一致,而与Younes-MhenniS等[3]、Bocca等[4]及 Forte等[5]报道的PD患者血清锌水平与对照组比较无统计学变化不一致。机体在锌缺乏时,会导致脂质过氧化加强,诱发机体产生氧化损伤,而补锌能使该损伤得以恢复,锌能减少铁离子进入细胞,并抵制其在羟自由基引发的链式反应中的催化作用[9]。因为锌是金属硫蛋白基因表达的有效促进因子,通过诱导合成金属硫蛋白而抵制自由基的损害。本研究发现PD患者血清金属硫蛋白较对照无明显变化,考虑可能与样本数较少有关。超氧化物歧化酶是能够有效清除超氧化物阴离子自由基的一类重要的抗氧化酶,真核细胞内存在二类超氧化物歧化酶:铜锌超氧化物歧化酶和锰超氧化物歧化酶,锌缺乏可以显著降低铜锌超氧化物歧化酶的活力,而锰超氧化物歧化酶活力代偿性升高。但当缺锌严重时,锰超氧化物歧化酶活性的代偿性升高仍然不能弥补铜锌超氧化物歧化酶活性的降低,所以使总超氧化物歧化酶活性下降。保持良好的锌营养有利于减轻过氧化损伤。本研究发现PD组患者血清铜锌超氧化物歧化酶活力较同龄健康中老年人明显低下,而血清丙二醛水平较对照组明显升高,表明锌缺乏亦可能通过降低铜锌超氧化物歧化酶活力,使机体发生氧化应激反应,而锌的生理功能较为广泛,亦有可能从其他途径参与PD的发病机制。
此外,本研究还发现PD患者血清铅水平较同龄健康对照组明显升高。大量流行病学调查也发现铅的长期暴露与PD患病率增高存在联系。Adonaylo等[10]采用慢性铅中毒动物测定脑内氧化应激参数发现:慢性铅中毒在鼠脑内诱导了一种氧化应激状态。而氧化应激是PD的一个重要发病机制,预示过多的铅可能导致PD。
综上所述,铜、锌缺乏可能参与PD的致病,而体内铅的过量亦可能是PD的一个高危因素。这些微量元素在体内的失平衡导致机体发生氧化应激反应,促使神经元凋亡、坏死,最终导致PD的发生。
[1]Halliwell B. Oxidative stress and neurodegeneration: where are we now?[J]. J Neurochem,2006,97: 1634-1658.
[2]Desai V, Kaler SG. Role of copper in human neurological disorder[J]. Am J Clin Nutr,2008,88:S855-S858.
[3]Younes-Mhenni S, Aissi M, Boughammoura-Bouatay A, et al. Serum copper, zinc and selenium levels in tunisian patients with Parkinson’s disease[J]. Tunis Med, 2013,91(6):402-405.
[4]Bocca B, Alimonti A, Senofonte O, et al. Metal changes in CSF and peripheral compartments of parkinsonian patients[J]. J Neurol Sci,2006,248: 23-30.
[5]Forte G, Bocca B,Senofonte O, et al. Trace and major elements in whole blood, serum, cerebrospinal fluid and urine of patients with Parkinson’s disease[J]. J Neural Transm,2004,111: 1031-1040.
[6]Hegde ML, Shanmugavelu P, Vengamma B, et al. Serum trace element levels and the complexity of inter-element relations in patients with Parkinson’s disease[J]. J Trace Elem Med Biol,2004,18: 163-171.
[7]Qureshi GA, Qureshi AA, Memon SA, et al. Impact of selenium, iron, copper and zinc in on/off Parkinson’s patients on L-dopa therapy[J]. J Neural Transm Suppl,2006,71:229-236.
[8]Gellein K, Syversen T, Steinnes E, et al. Trace elements in serum from patients with Parkinson’s disease—a prospective casecontrol study The Nord-Trondelag Health Study (HUNT)[J]. Brain Res,2008,1219: 111-115.
[9]Jomova K, Valko M. Advances in metal-induced oxidative stress and human disease[J]. Toxicology,2011,283(2-3):65-87.
[10]Adonaylo VN, Oteiza PI. Lead intoxication: antioxidant defenses and oxidative damage in rat brain[J]. Toxicology,1999,135(2-3):77-85.

