头痛、左侧肢体无力7个月伴智能减退1.5个月
1临床资料患者女,35岁,因“头痛、左侧肢体无力7个月伴智能减退1.5个月”于2008-04入院。患者于2007-09中旬出现头痛,右眶额部持续胀痛渐加重伴视物模糊,并出现左侧肢体无力、麻木,步态不稳。头颅MRI提示颅内大面积占位,于10-19行开颅手术,病理报告为“炎症”,未治疗。11月初头痛及左侧肢体无力加重,伴阵发性四肢颤动,予甲泼尼龙治疗,起始剂量1000 mg/d,半量递减,减量至2008-01下旬病情未见明显缓解,予大剂量青霉素治疗近两周(具体剂量不详)。2008-02初发生脑疝,行去骨瓣减压术并再次活检,病理报告仍为“炎症”,停用青霉素,改为复方新诺明0.96 g/d,口服。术后左侧肢体及右下肢无力,小便失禁。2008-03初出现智能渐减退,反应迟钝,言语减少,回答不切题,定向力、记忆力、理解力下降。2008-04-18以“颅内占位病变”收入海军总医院神经内科。发病后无咳嗽、咳痰、腹痛、腹泻、关节肿痛,2008-02初开始体温波动于37.3℃~37.8℃。多食,体质量增加,大便正常,小便失禁,停经2个月。既往史、个人史、家族史无特殊。查体:内科系统未见异常。神经系统:被动体位,右颞颅骨缺损,局部包块膨出。神清语利,计算力、记忆力、定向力减退。眼球垂直活动稍差,左侧外展受限,左侧偏盲,左侧鼻唇沟略浅。四肢肌肉轻度萎缩,左侧肢体肌张力高,呈齿轮样改变,四肢偶见抽动;肌力左上肢远端0级、近端1级,双下肢1级;左侧肢体痛、温、音叉震动觉减退;左侧肢体腱反射+++。左侧Hoffmann征、Rossolimo征及双侧Babinski征阳性。留置导尿。血常规:Hb 115 g/L, WBC 6.4×109/L, 中性粒细胞54.6%, 淋巴细胞36.1%, 单核细胞10.8%(3.5%~8%),嗜酸性细胞0.2%(0.5%~5%),血小板 210×109/L。尿便常规、血生化、乙肝、HIV及梅毒抗体、ANCA、免疫球蛋白正常。红细胞沉降率(ESR) 22 mm/h(0~20),CRP 29 mg/L(<8),RF<20 IU/mL, ENA抗体7项均(-)。心电图提示部分导联ST-T改变。胸部X线片、腹部B超、盆腔B超均正常。脑电图示右前额、颞部慢波。简明精神状态检查(MMSE)评分11分,蒙特利尔认知评估量表(MOCA)评分11分。脑脊液(CSF;2008-2-15):细胞学未见异常,糖3.0 mmol/L,氯121 mmol/L,蛋白1700 mg/L,髓鞘碱性蛋白(MBP)2.23 nmol/L(<0.55),寡克隆区带(OB;+)。头颅MRI(2007-10-11):右侧半卵圆中心大片长T1信号,伴中心不均匀增强。周边水肿样改变,中线结构无移位(图1)。2008-01-15:病灶较前显著增大,但仍限于右侧半球,轻度中线移位(图2)。2008-04-23:右侧半卵圆中心及基底节区病灶显著增大,跨越胼胝体累及左侧侧脑室旁及扣带回,右额硬膜下囊肿形成(图3)。
入院后给予甘露醇、甘油果糖脱水降颅压及对症支持处理,于2008-04-23行无框架立体定向右额顶占位活检术。
2临床讨论
2.1协和医院神经内科代表病例特点:(1)青年女性,隐袭起病,进行性加重,病程7个月。首发症状为头痛、视物模糊,左侧肢体麻木力弱,步态不稳。随后相继出现阵发性四肢颤动、小便失禁、智能减退、体温波动、多食、体质量增加、停经等症状。予青霉素、磺胺类药物治疗无效。(2)查体:智能减退;眼球活动障碍,左侧偏盲;左侧鼻唇沟略浅。四肢肌容量略减少;左侧肢体肌张力高,呈齿轮样,左上肢肌力远端0级、近端1级,双下肢肌力1级。四肢偶见抽动,左侧肢体深浅感觉减退。左侧Hoffman征、Rossolimo征阳性,双侧Babinski征、Chaddock征、Pussep征阳性。(3)实验室检查:多次头颅MRI提示右基底节区、侧脑室旁、半卵圆中心大片长T1长T2信号,周围水肿、占位效应明显,不均匀团状强化,中线结构移位,病灶渐增大并波及左半球。行腰穿查CSF示蛋白1700 mg/L,MBP 2.23 nmol/L,OB(+)。脑电图显示右前额、颞部慢波。
定位诊断:头痛、视物模糊考虑为高颅压;高级智能减退定位于大脑皮层;眼球向左侧活动受限定位于右侧视中枢;左侧鼻唇沟浅定位于右侧皮质核束;左上肢、双下肢肌力1级,双侧病理征阳性定位于双侧锥体束,以右侧为著;左侧肢体痛、温、音叉震动觉减退定位于右侧脊丘束和三叉丘系;四肢震颤、左侧肢体肌张力齿轮样增高,定位于锥体外系;多食、体质量增加、停经定位于下丘脑。综合定位于右侧大脑半球,并累及左侧,与影像学所见一致。
定性诊断:(1)感染性:患者2次活检病理均报告为炎性反应,支持感染性疾病,青霉素和磺胺类药物治疗无效,不支持细菌性感染,考虑可能为如下病原体感染:①真菌:颅内真菌感染分继发和原发两类,继发性颅内真菌感染主要发生在免疫抑制、长期大量应用抗生素的患者,此患者无相关病史,考虑为原发性真菌感染可能性大。原发性颅内真菌感染多呈慢性或亚急性起病,出现的高颅压症状和神经定位体征缺乏特异性,临床诊断比较困难,早期全身反应或脑膜刺激征不明显时CSF检查易被忽视,后期病理表现主要是真菌性肉芽肿,CSF检查几乎查不出致病菌。影像学表现为占位病变,CT平扫表现为低密度,MRI呈长T1、长T2改变,可出现高低混杂信号,病变周围有不同程度水肿, MRI增强扫描像上呈形状不规则的不均匀强化灶,MRI上斑点样或颗粒状强化是真菌性肉芽肿相对特征性表现,可与肿瘤鉴别。此患者MRI改变符合上述特点,支持真菌性肉芽肿的诊断。②结核瘤:单发少见,一般表现为环状强化灶或结节样强化,水肿通常较轻,其内为干酪样坏死灶,坏死程度随病期不同而有差别,结核瘤引起的临床症状主要为对邻近组织压迫引起的相应症状,脑组织毁损症状往往比较轻,大部分结核瘤为继发性,常继发于肺结核,本例患者脑组织损害症状突出,亦无其他部位结核,结核瘤可能性不大。③寄生虫感染:弓形体、阿米巴、棘球蚴病等感染,通常为多发病灶,单发者少见,而且本例患者血和CSF嗜酸性细胞比例不高,对磺胺类药物治疗无反应,不支持此诊断。(2)肿瘤:患者隐袭起病,病情进行性加重,予抗生素、糖皮质激素等(简称“激素”)治疗无效,影像学表现为病变有占位效应、团状强化、周围水肿明显,需要考虑肿瘤可能,但两次活检病理报告均为炎性反应,为不支持点。肿瘤方面需考虑:①淋巴瘤:淋巴瘤可发生在中枢神经系统的任何部位,常发生在中线深部脑组织,也可以轻易累及胼胝体而侵犯对侧半球。组织学可见淋巴细胞和(或)组织细胞的肿瘤性增生,有时易与炎性反应的反应性淋巴细胞增生混淆。淋巴瘤多为边界不清的肿块,弥漫浸润生长,无包膜,基本无坏死出血,囊变少见,CT呈略高密度或等密度,增强MRI一般呈拳样明显强化,与本例影像学表现不一致,此外,激素治疗无效也不支持淋巴瘤诊断。②胶质瘤:恶性度高的星形细胞瘤如多形性胶质母细胞瘤,水肿及占位效应均明显,肿瘤常跨越中线生长浸润对侧大脑半球,边界不清,CT像一般呈混杂密度,MRI呈肿瘤实体明显强化或环状厚壁不规则强化伴壁结节,本例病灶边界相对较清,MRI强化特点亦不符合,胶质瘤可能性较小。(3)炎性脱髓鞘假瘤:炎性脱髓鞘假瘤MRI主要表现为局灶性肿物,多伴有占位效应以及周围水肿,可呈均匀或混杂信号,内部可合并囊变或出血,由于病灶实性部分血-脑脊液屏障破坏,病灶内可呈现条状、环形或均匀的明显强化,强化方式通常无特征性,临床和影像学表现常难与肿瘤鉴别,确诊依靠病理结果。本例为青年女性,CSF OB阳性,需要考虑炎性脱髓鞘假瘤,起病隐袭、甲泼尼龙冲击治疗无效为脱髓鞘不支持点,病变波及到对侧也难以解释,因此不支持脱髓鞘假瘤。
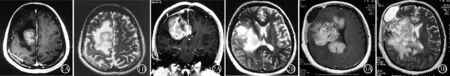
A: T1WI增强;B:T2WI
图12007-10-11患者头颅MRI表现:右侧半卵圆中心大片长T1信号,伴中心不均匀增强。周边水肿样改变,中线结构无移位
A: T1WI增强;B:T2WI
图22008-01-15患者头颅MRI表现:与2007-10-11比较,病灶较前显著增大,但仍限于右侧半球,轻度中线移位
A: T1WI增强;B:T2WI
图32008-04-23患者头颅MRI表现:右侧半卵圆中心及基底节区病灶显著增大,跨越胼胝体累及左侧侧脑室旁及扣带回,右额硬膜下囊肿形成
2.2宣武医院神经内科代表定性主要考虑颅内感染性病变:(1)结核性肉芽肿:支持点包括:青年女性,亚急性起病,逐渐加重;早期表现为头痛、恶心呕吐等脑膜刺激症状,未系统治疗后加重,出现定位症状及体征;颅内占位性病变主要位于顶叶皮层及皮层下,与结核病血行播散途径符合,病灶增强后有环形强化;CSF蛋白明显升高,细胞学正常,可排除脑脓肿的可能。不支持点:无结核病史及结核中毒症状,胸部X线片正常,CSF糖、氯化物正常,但不典型病例亦可出现上述表现。(2)其他特殊类型感染:①真菌性脑炎:也多见于青壮年,呈亚急性或慢性起病,可反复发作。以头痛起病,逐渐加重呈持续性,如未经抗真菌治疗,疾病进展迅速,可出现不同程度意识障碍,甚至昏迷。皮肤、口腔黏膜等处可找到霉菌病灶。CSF表现与结核性脑膜炎相似,早期糖和氯可以正常;CSF墨汁染色可发现真菌(隐球菌),通常需多次检查才能发现;影像学表现早期可正常,周围水肿呈低密度,增强呈明显强化结节或环状强化,后期脑膜黏连可导致脑积水。确诊主要依靠墨汁染色找到真菌。本例患者隐袭起病,颅内压高、早期脑膜刺激征阳性、CSF蛋白升高等均与真菌性脑炎表现相符,但此患者CSF糖、氯正常,不支持此诊断,且无墨汁染色证实。②寄生虫感染:起病隐袭,由于虫体寄生的部位、数目、发育阶段不同而临床表现多样,可表现为颅压高、脑膜刺激症状,或局灶性神经功能受累表现,还可累及身体其他部位,如皮肤、肌肉、肺、心包、脊髓等。CSF压力、蛋白均升高,白细胞增多以淋巴细胞为主,糖、氯化物降低。血和CSF特异性抗体检测可发现异常。影像学可发现单发或多发类圆形病灶,增强后可见环形强化。本患者无全身其他部位受累的表现,外周血嗜酸性细胞降低,不支持此诊断,且并未进行相关抗体的免疫学检查。
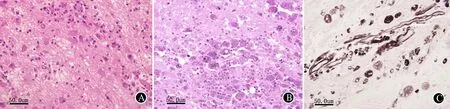
图42008-04患者脑组织病理表现(×400):片状坏死形成,多量炎细胞浸润,大量格子细胞反应,格子细胞胞质丰富(A;HE),内含大量糖原染色(B;PAS)、六胺银阳性(C;六胺银染色)的细小颗粒状物质,星形胶质细胞增生
综上所述,该患者诊断上述感染的证据尚不充分,需要考虑某些特殊的中枢神经系统感染性疾病。
2.3301医院神经内科代表定性诊断:(1)颅内肿瘤:影像学表现为颅内病变沿胼胝体向左侧生长,生长速度快,占位效应明显,病灶范围大,中央有坏死表现,周围水肿显著,增强后明显强化。故颅内肿瘤应作为首要考虑的诊断。在各种颅内肿瘤中,淋巴瘤活检可呈“炎性”表现,与该患者两次病理结果均为“炎症”相符,因此淋巴瘤可能性不除外。(2)非条件致病菌或特殊病原体感染:头颅MRI增强后呈明显的环形强化,经两次活检后病灶播散速度加快,CSF OB阳性,均提示感染。同时,也应考虑毛霉菌等非条件致病菌血行转移所致。但患者无长期免疫抑制剂和抗生素应用史,且病理检查未发现致病菌,不支持点此诊断。
3病理结果及转归
3.1病理结果2007-10第1次开颅手术病理(301医院):送检脑标本镜下主要为脑白质,血管周围及血管壁内多数淋巴细胞浸润,呈血管炎改变,周围脑组织可见变性坏死,坏死区域内髓鞘脱失,吞噬细胞浸润,部分格子细胞PAS强阳性,可见反应性星形细胞。考虑为脑内炎性改变。
2008-02第2次开颅手术病理(宣武医院):送检脑组织(右额颞)标本内脑组织大片坏死,血管周围及脑组织内多量淋巴、浆细胞浸润,伴有大量格子细胞渗出,格子细胞胞质丰富,内含大量六胺银染色、PAS阳性的细小颗粒状物质,病变内及周围可见多量反应性增生的星形细胞。弓形体抗体、TB(-),GFAP(+),CD68多量(+),PAS(+),六胺银染色(+)。符合慢性坏死性炎性病变表现,以神经系统少见特殊感染可能性大。
2008-04脑活检病理(海军总医院病理科孟宇宏主任医师):送检脑组织(右额)片状坏死形成,多量炎细胞浸润,大量格子细胞反应,格子细胞胞质丰富(图4A),内含大量糖原染色(图4B)、六胺银阳性(图4C)的细小颗粒状物质,星形胶质细胞增生;GFAP(+),Vimentin(+),NF(+),EMA(-),PAS(+),六胺银染色(+)。符合慢性坏死性炎性病变,以中枢神经系统Whipple病可能性大(此病理结果在宣武医院卢德宏教授指导下得出)。
3.2治疗及转归末次脑活检后再次出现脑疝,经脱水降颅压及硬膜下囊肿抽吸术后病情稳定。活检后1周后起予青霉素800 万单位,每8 h 1次,静滴15 d,其后予复方新诺明口服0.96 g, 3次/d,共15 d。患者精神、睡眠好,记忆力、理解力渐恢复,MMSE 26分,较入院时明显好转。2008-07-16日出院前复查头颅MRI较前明显好转,中线结构基本正常,强化病灶明显减少(图5A)。出院后改为复方新诺明0.96 g,口服2次/d,共5个月。出院后1年随诊精神、饮食、睡眠正常,尿便正常,月经正常。语言、智能基本正常,左上肢能划圈,双下肢被动屈曲后能伸直,能独坐1 h以上,器械帮助下可站立1 h。2009-04复查头MRI遗留右侧大脑半球软化灶,脑室扩大,无明显增强(图5B)。2013-11电话随访,患者病情无反复,仅遗留左侧肢体活动差。
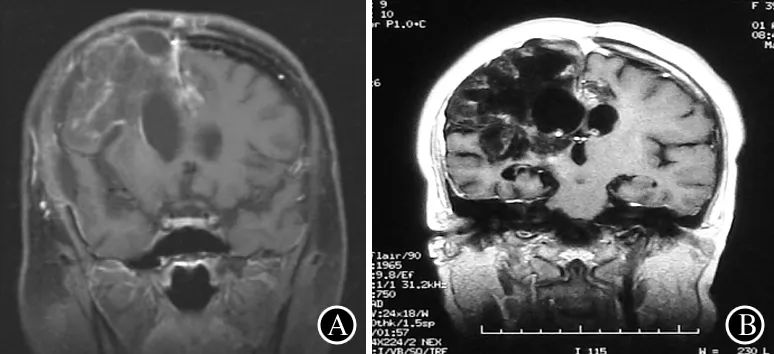
图5患者治疗后MRI表现:出院前复查头颅MRI较前明显好转,中线结构基本正常,强化病灶明显减少(A);2009-04复查头MRI遗留右侧大脑半球软化灶,脑室扩大,无明显增强(B)
4临床病理分析
4.1海军总医院神经内科钱海蓉副主任医师: 1907年Johns Hopkins大学的George Wipple医生首次描述了一种罕见的由T Whipplei菌引起的慢性复发性多系统感染性疾病,后人称之为Whipple病(Whipple disease,WD)[1],该病可累及全身多脏器如胃肠道、关节淋巴系统、心脏等[2]。WD最常见的系统症状是关节痛、体重减少和腹泻三联征,但WD患者约15%临床表现不典型[3]。WD也可以局限性发病,累及中枢神经系统(central nervous system,CNS)者称为中枢神经系统Whipple病(central nervous system Whipple disease,CNS WD)。CNS WD分为3类:(1)伴随系统性WD出现CNS病损;(2)CNS病变在抗生素治疗WD后1年内或数年后,以疾病复发的形式出现;(3)仅有孤立的CNS症状,无胃肠道或其他系统性病变表现。前二者称为继发性CNS WD,后者称原发性CNS WD,仅占WD的5%。
CNS WD症状体征复杂多样,由于T whipplei菌易侵犯导水管周围灰质、下丘脑、海马、大脑皮质、基底节、小脑等部位,临床可表现为认知障碍、意识障碍、精神症状、眼肌麻痹、肌阵挛、癫痫、偏瘫、共济失调、下丘脑功能障碍(烦渴、摄食过量、性欲降低、停经、伴失眠的睡眠觉醒周期改变以及垂体功能低下)、眼咀嚼肌节律性运动(OMM)及眼面骨骼肌节律性运动(OFSM)等[4]。OMM和OFSM是CNS WD的特殊体征,被认为对CNS WD有病理性提示作用,一旦出现,即可诊断CNS WD,但其具体机制不详,也不常见,仅发生于约20%的CNS WD患者[5]。
CNS WD的常规实验室检查一般无特异性改变,ESR可能增快,CRP可能增高,可有贫血和低蛋白血症。CSF轻度白细胞增多和蛋白增高是常见的非特异性改变,白细胞增多的范围为5~900个/mm3(平均91个/mm3),蛋白增高的范围为47~158 mg/dL(平均75 mg/dL)[5]。CSF细胞学检查可在胞质中发现PAS阳性颗粒或镰状颗粒。CSF PCR技术检测病原体比细胞学检查方法更敏感。
CNS WD影像学表现复杂,MRI是诊断和观察该疾病进展的最好方法,但其表现可能是非特异性的,主要包括脑萎缩、颅内多发或孤立肿块、脑膜浸润、灰白质交界处弥漫病变和脑积水等,占位效应和水肿表现可有可无,增强扫描后可有均质、环状、斑片状增强和室管膜增强,部分病例MRI可完全正常[6-7]。
神经病理方面,大体病理可见广泛脑萎缩,皮质多灶性损害或皮质深部病灶。显微镜下可见血管周围有PAS阳性的泡沫样巨噬细胞浸润,周边中有大量反应性星形细胞。PAS阳性细胞浸润到脑白质,可导致脱髓鞘样改变,Nelson等[8]曾报道CNS WD患者表现为类似多发性硬化的脱髓鞘病灶,临床鉴别诊断困难。PAS阳性泡沫样巨噬细胞是本病的特征性病理表现,但并非本病独有,也可见于某些真菌和不典型分枝杆菌如蜡样芽孢杆菌感染,可行墨汁染色、抗酸染色等进一步鉴别。
由于CNS WD临床及影像学表现不典型,需要与多种CNS疾病鉴别,包括一些脑病、慢性脑膜炎、脑血管病、CNS血管炎、痴呆、胶质瘤、自身免疫脱髓鞘病、肉芽肿类疾病等。1996年Louis等提出了 CNS WD的诊断指南[5]:(1)确诊CNS WD必须具备以下 3条中的1条:OFSM或OMM;组织活检病理特征典型;PCR分析结果whipple菌阳性。如组织学检查或PCR分析的标本并非来源于CNS,则必须证明患者存在CNS体征;如组织学检查或PCR分析的标本来源于CNS,则不必证明患者存在CNS体征即可考虑症状性 CNS感染。(2)可能的CNS WD:①至少有下列 4个全身症状之一,且不由其他已知病因引起:不明原因发热;胃肠道症状(脂肪泻、慢性腹泻、腹胀或腹痛);慢性游走性关节痛或多关节痛;难以解释的淋巴结肿大、盗汗或其他不适。②至少有下列4个神经系统症状体征之一,且并非由其他已知病因引起:核上性凝视麻痹;节律性肌阵挛;痴呆伴精神症状;下丘脑症状。
本例患者中枢神经系统症状多样,病程进展相对缓慢,首发症状为头痛、视物模糊,考虑存在颅高压。同时伴有左侧肢体麻木力弱及走路不稳,考虑为右侧半球病变,但临床无发热、癫痫等CNS感染征象,很难鉴别急性脑血管病、血管炎、肿瘤、炎性假瘤,经MRI检查提示大面积占位并有增强效应,考虑为肿瘤或炎性假瘤样病变,但活检提示为感染。病程中症状逐渐增多,相继出现阵发性四肢颤动、右下肢力弱、智能减退、小便失禁、多食、体重增加、停经、体温波动等症状,提示病灶逐渐扩大累及锥体外系、皮层、下丘脑及对侧半球。本次入院前2次脑组织活检病理结果均排除了脑肿瘤、脱髓鞘病变以及炎性假瘤等情况,但对于这种慢性炎性病变的性质一直不能明确,曾多次采用大剂量激素、青霉素、复方新诺明等药物等治疗,由于诊断困难,治疗剂量及疗程均不足,导致病变仍在缓慢进展,颅内压不断增高,在病程中曾两次出现脑疝而危及生命的情况。第3次脑活检后,根据脑组织病理学特征,经充分复习文献及会诊,参照以上诊断指南诊断为CNS WD。由于患者始终无系统性WD证据,考虑为原发CNS WD。
WD一旦累及CNS,如不治疗预后很差,某些患者病程可呈爆发性,进展迅速,组织及功能损伤很难逆转,因此合理治疗尤为重要。2007年欧洲T whipplei菌感染组织完成了第一个前瞻性非随机治疗研究,患者分两组,分别用美罗培南3 g/d或头孢曲松2 g/d静脉治疗2周,后续均以标准的复方新诺明片(甲氧苄胺嘧啶-甲基异恶唑,TMP-SMX)0.96 g,口服 2次/d,治疗1年,共纳入40例CNS WD患者,未发现两组疗效及预后差异有统计学意义[9]。目前普遍接受的CNS WD治疗方案为静脉使用头孢曲松2 g 1次/d或美罗培南1g 3次/d,连续2周,其后口服复方新诺明 0.96 g,2次/d,至少1年。
4.2宣武医院卢德宏教授: 该病例镜下可见右额颞脑组织大片坏死,血管周围及脑组织内多量淋巴、浆细胞浸润,伴大量格子细胞渗出,格子细胞胞质丰富,内含大量六胺银、PAS阳性的细小颗粒状物质,这种小颗粒物非常特殊,病变内及周围可见多量反应性增生的星形细胞,符合慢性坏死性炎性病变表现。该患者病理表现与以前1例经尸检证实的中枢whipple感染结果相似,尽管未进行PCR检查,仍高度考虑为CNS WD等特殊感染,有条件可行电镜检查进一步明确。
4.3海军总医院神经内科戚晓昆教授: 该例患者诊断过程非常曲折,历经2次开颅手术,1次立体定向手术,其病理切片曾提交第49届日本神经病理会议讨论,高桥均教授及鹿岛教授看过切片,考虑不除外T Whipplei菌感染可能。因此,根据国内外专家的意见按照Whipple病给予了青霉素及复方新诺明治疗。患者症状持续好转,影像学可见病灶逐步缩小。此外,对于CNS特殊感染,在诊断不明确的情况下,不应早期使用激素治疗,否则可能加重病情,导致病变扩大。本例仍将继续随访。
[1]Whipple GH. A hitherto undescribed disease characterized anatomically by deposits of fat and fatty acids in the intestinal and mesenteric lymphatic tissues[J]. Johns Hopkins Med Bull,1907,98: 382-391.
[2]Mohamed W, Neil E, Kupsky WJ, et al.Isolated intracranial Whipple’s disease—report of a rare case and review of the literature[J]. J Neurol Sci,2011,308:1-8.
[3]Fenollar F, Puechal X, Raoult D. Whipple’s disease[J]. N Engl J Med, 2007,356:55-56.
[4]de Andrade DC, Nogueira RC, Lucato LT,et al. Isolated CNS Whipple disease with a variant of oculofacial-skeletal myorhythmia (OFSM) [J]. Neurology, 2007,69:E12.
[5]Louis ED, Lynch T, Kaufmann P,et al.Diagnostic guidelines in central nervous system Whipple’s disease[J]. Ann Neurol,1996, 40: 561-568.
[6]Sung VW, Lyerly MJ, Fallon KB, et al. Isolated CNS Whipple disease with normal brain MRI and false-positive CSF 14-3-3 protein: a case report and review of the literature[J].Brain Behav, 2012,2:838-843.
[7]Xavier Puéchal. Whipple’s disease[J]. Ann Rheum Dis, 2013,72:797-803.
[8]Nelson JW, White ML, Zhang Y,et al.Proton magnetic resonance spectrosopy and diffusion-weighted imaging of central nervous system Whipple disease[J]. J Comput Assist Tomogr, 2005,29:320-322.
[9]Feurle GE, Junga NS, Marth T. Efficacy of ceftriaxone or meropenem as initial therapies in Whipple’s disease[J].Gastroenterology, 2010, 138: 478-486.

