帕金森病初诊患者自主神经病变与认知功能障碍的研究
戚飞腾 熊凌杰 陈思砚 张扬 张旭 毕涌
帕金森病(Parkinson disease,PD)是一种以黑质多巴胺能神经元变性缺失和路易小体形成为病理特征,并以静止性震颤、肌强直、运动迟缓及姿势不稳等运动症状为主要临床表现的神经变性疾病。近年来研究发现,PD不仅累及锥体外系引起运动障碍,而且非运动症状(non-motor symptom,NMS)也非常普遍,如自主神经功能障碍、认知功能障碍在PD患者中具有较高的发生率。自主神经功能障碍临床表现多样,可表现为消化、泌尿、心血管、体温调节、瞳孔调节及生殖系统功能中一种或多种功能障碍。PD患者可出现轻度认知功能障碍(mild cognitive impairment,MCI),并进一步发展为痴呆。目前对PD患者自主神经功能障碍和认知功能障碍的研究较多,但两者严重程度间是否存在相关性尚存在争议[1-2]。本文研究了PD伴发自主神经功能障碍、认知功能障碍的特点及对生活质量的影响,并探讨了自主神经功能障碍严重程度与认知功能障碍严重程度的关系。
1 对象和方法
1.1临床资料收集2010-01-2013-04温州医科大学附属第一医院神经内二科门诊首次诊断为PD的患者60例,其中男36例,女24例,年龄43~80岁,平均(62.7±8.9)岁,病程0.5~3.2年,中位数1.2年。所有患者符合PD诊断标准[3],且排除脑血管病、脑炎、脑外伤、中毒等继发性和帕金森叠加综合征。
1.2方法采用PD自主神经症状量表(the scale for outcomes in PD for autonomic symptoms,SCOPA-AUT) 评定患者自主神经功能障碍程度,将患者分为有自主神经症状(autonomic symptom,AS)组和无自主神经症状(none-autonomic symptom,NAS)组。AS组41例,其中男24例,女17例;平均年龄(63.5±9.3)岁,小学文化程度25例,初中文化程度9例,高中文化程度5例,大学及以上文化程度2例。NAS组19例,其中男12例,女7例;平均年龄(61.5±7.4)岁;小学文化程度12例,初中文化程度3例,高中文化程度4例,大学及以上文化程度0例。
应用简易精神状态量表(minimum mental state examination, MMSE)测定患者的认知功能,分为无认知功能障碍(none cognitive impairment,NCI)组、轻度认知功能障碍组(MCI)和痴呆组, 使用帕金森病统一评定量表第三部分来评价患者运动能力(unified Parkinson disease rating scale Ⅲ,UPDRSⅢ)、PD生活质量问卷(activity of daily living scale-39,PDQ-39)评价生活质量。
PD患者MCI诊断标准:采用Petersen等[4]提出的MCI诊断标准并加以修订:(1)主观感觉记忆力减退,并经知情者证实;(2)客观检查存在MCI的证据,如MMSE评分中学以上文化程度25~27分,小学2l~24分,文盲18~20分;(3)总体认知分级量表轻度异常;(4)日常生活能力基本保持正常;(5)不符合痴呆的诊断标准;(6)除外痴呆或任何可以导致脑功能紊乱的躯体和精神疾患;(7)病程>3个月。
痴呆的诊断标准[5]:(1)符合PD 诊断标准;(2)缓慢进展的认知障碍,且此认知障碍足以影响患者的日常生活能力;(3) MMSE评分中学以上文化程度<25分,小学<21分,文盲<18分;(4)排除由系统或代谢性疾病引起的抑郁及精神障碍、药物的副作用或其他有锥体外系症状的神经系统变性疾病。
1.3统计学处理应用SPSS 17.0软件进行分析,符合正态分布的计量资料以均数±标准差表示,两组均数间比较采用两独立样本t检验,多组均数比较采用方差分析,两两比较采用S-N-K法进行检验;不符合正态分布的计量资料以Md(QR)表示,两组间病程比较采用Mann-Whitney U秩和检验,3组间病程、SCOPA-AUT总分和各系统症状评分的比较用Kruskal-Wallis H检验。计数资料比较采用χ2检验。以P<0.05 为差异具有统计学意义。
2 结果
2.1自主神经障碍分析60例患者中出现AS者41例(68.3%),无AS者19例(31.7%)。出现消化系统症状39例(65.0%)、泌尿系统症状36例(60.0%)、心血管系统症状23例(38.3%)、性功能障碍20例(33.3%)。消化系统中以便秘最常见(50.0%),泌尿系统中以夜尿最常见(51.7%)。AS组和NAS组间性别构成、文化程度无统计学差异(P>0.05)。AS组的运动能力、生活质量较NAS组明显下降,而两组间病程未见统计学差异(表1)。

表 1 两组间相关因素比较
2.2认知功能障碍分析60例患者平均MMSE得分22.95±4.59。其中NCI组34例(56.7%),MCI组19例(31.7%),痴呆组7例(11.6%)。除NCI组与MCI的UPDRSⅢ无统计学差异外,余组间两两比较均有统计学差异(表2)。
2.3认知功能障碍与自主神经功能障碍的关系三组患者的总SCOPA-AUT评分以及胃肠道、泌尿系统等各系统症状评分间比较均无统计学差异(表3)。
3 讨论
PD患者除了有运动障碍,往往合并有NMS,如自主神经和认知功能障碍。国外有研究发现服用高剂量多巴胺药物的患者易发生自主神经功能异常[6],故本研究选取PD初诊患者,可排除药物干预的影响,从而研究疾病自然进程。本研究采用SCOPA-AUT量表对PD患者自主神经功能进行评价发现,AS发生率高达68.3%,相对于NAS组,AS组有更明显的运动能力障碍,生活质量也下降。这与以往的研究结果一致[7]。另外该研究发现,NAS组与AS组病程无统计学差异,而且AS严重程度与病程无明显相关性(P>0.05),这可能是由于某些PD患者在疾病早期,甚至在运动症状出现之前,即可表现出明显的自主神经紊乱[8],而有些患者即使在中晚期AS仍不明显。尽管自主神经功能障碍可发生在疾病的早期,但是否可作为PD的预测因子尚需进一步研究。

表 2 各组间相关因素比较
注:与NCI组比较,*P<0.05;与MCI组比较,#P<0.05
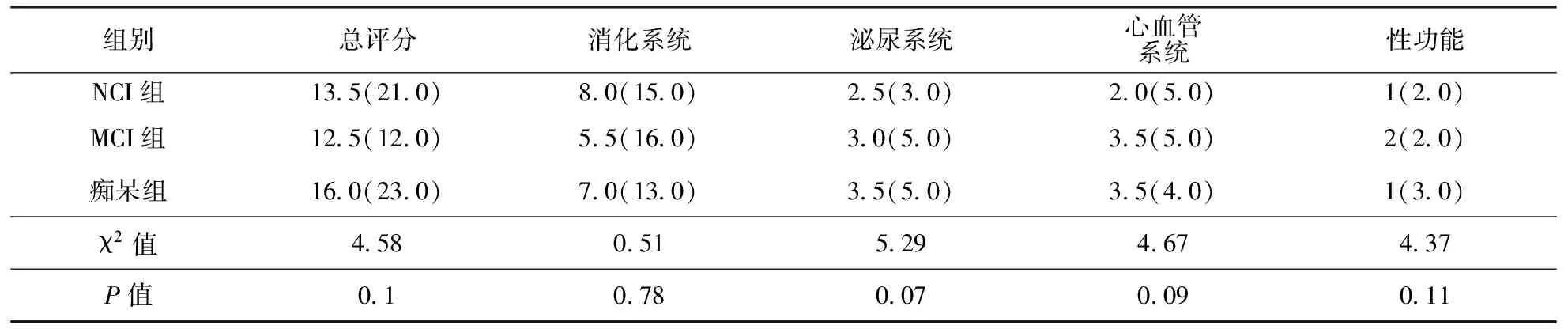
表 3 各组间SCOPA-AUT总分和各系统症状评分的比较 〔Md(QR)〕
由于文化程度直接影响PD患者认知功能的评分,故不宜将MMSE或蒙特利尔认知评估量表(MoCA)评分直接与其他量表分数作相关性分析。本研究将患者分为NCI组、 MCI组和痴呆组,对3组患者运动能力、生活质量、病程进行比较发现,3组间UPDRSⅢ、PDQ-39评分差异有统计学意义,但NCI组与MCI组的UPDRSⅢ评分无统计学差异,表明MCI尚不足以构成对运动能力的影响,但随着认知损害加重,运动能力也随之下降。与自主神经功能障碍不同的是,MCI组的病程大于NCI组,而痴呆组的病程大于MCI组,表明认知功能障碍与病程存在相关性,认知损害随着疾病的进展而加重。国外研究认为,PD患者在疾病早期即可出现MCI,约有30%~40%的患者可进展为痴呆。因此,目前普遍认为MCI是介于认知正常和痴呆的过渡状态,对MCI进行有效治疗或许有助于阻止或延缓患者向痴呆的转变[9]。
目前对于认知功能与自主神经的关系尚未明确。有研究发现PD伴痴呆的患者有更明显的直立性低血压症状,但也有研究认为两者不存在相关性,理由是直立性低血压可出现在疾病的任何阶段[10]。很多研究表明自主神经损害可发生在疾病的任何时期,而认知损害随着疾病的进展而进展,两者在时间上无相关性。本研究结果显示认知损害与病程相关,而自主神经损害与病程无相关性,支持上述观点。该研究还发现,NCI组、MCI组和痴呆组在SCOPA-AUT总分以及胃肠道、泌尿系统、心血管系统等评分间无统计学差异,提示认知功能严重程度与AS严重程度无明显关系。Braak等[11]研究认为,在PD的最早期阶段即可在交感、副交感神经节上观察到路易小体,引发AS;随后逐渐累及中脑黑质,表现出典型的PD运动症状;最后波及边缘系统、大脑皮质,才会出现认知障碍,表明自主神经损害和认知障碍虽然在机制上一致,但两者是独立进展的过程,故临床上PD患者自主神经功能障碍和认知功能障碍出现的时间不同,严重程度也无相关性。
总之,该研究发现PD初诊患者即存在不同程度的自主神经功能障碍和认知功能障碍,两者均影响患者生活质量,但自主神经功能障碍严重程度与认知功能障碍严重程度间无明显关系。由于该研究样本量较小,且只选择了初诊患者,自主神经功能障碍严重程度与认知功能障碍严重程度间的确切关系还需要进一步研究。
[1]Oh ES, Lee JH, Seo JG, et al. Autonomic and cognitive functions in Parkinson’s disease (PD)[J]. Arch Gerontol Geriatr,2011,52:84-88.
[2]Poewe W. Dysautonomia and cognitive dysfunction in Parkinson’s disease[J]. Mov Disord, 2007,22:S374-S378.
[3]中华医学会神经病学分会运动障碍及帕金森病学组. 帕金森病的诊断[J]. 中华神经科杂志,2006,39:408-409.
[4]Petersen R C, Doody R, Kurz A, et al. Current concepts in mild cognitive impairment[J]. Arch Neurol,2001,58:1985-1992.
[5]中华医学会神经病学分会帕金森病及运动障碍学组, 中华医学会神经病学分会神经心理学与行为神经病学组. 帕金森病痴呆的诊断与治疗指南[J]. 中华神经科杂志,2011,44:635-637.
[6]Verbaan D, Marinus J, Visser M, et al. Patient-reported autonomic symptoms in Parkinson disease[J]. Neurology,2007,69:333-341.
[7]孔双艳, 田成林. 帕金森病自主神经功能障碍的回顾性分析[J]. 脑与神经疾病杂志,2009,17:288-290.
[8]Tysnes OB, Muller B, Larsen JP. Are dysautonomic and sensory symptoms present in early Parkinson’s disease? [J]. Acta Neurol Scand Suppl,2010,122(suppl190):72-77.
[9]Meireles J, Massano J. Cognitive impairment and dementia in Parkinson’s disease: clinical features, diagnosis, and management[J]. Front Neurol,2012,3:88.
[10]Idiaquez J, Benarroch E E, Rosales H, et al. Autonomic and cognitive dysfunction in Parkinson’s disease[J]. Clin Auton Res,2007,17:93-98.
[11]Braak H, Del Tredici K, Rub U, et al. Staging of brain pathology related to sporadic Parkinson’s disease[J]. Neurobiol Aging,2003,24:197-211.

