猪胰脂酶的非离子表面活性剂修饰对酶促酯交换过程的影响
安晓东,杨国龙,杨力会,毕艳兰,彭 丹
(河南工业大学 粮油食品学院,河南 郑州 450001)
0 引言
有机溶剂中的酶催化反应已成为近二十年来的研究热点,但由于天然酶分子在有机溶剂中应用时多存在热稳定性差、易失活、不易回收利用等问题,所以研究者多采用不同的方法对酶分子进行修饰.根据酶与修饰分子作用力的不同,可将酶的修饰方法分为:共价修饰和非共价修饰,表面活性剂修饰脂肪酶属于非共价修饰[1].表面活性剂对酶的修饰,主要是通过它的两亲性质实现的;表面活性剂的亲水基团与酶分子的羟基形成氢键结合在一起,亲油部分则伸向有机溶剂,这就避免了酶分子与有机溶剂的直接接触而可能引起的酶变性失活.自从Okahata 等[2]首先报道了表面活性剂包衣酶(即修饰酶)的概念后,因该方法具有制备容易,稳定性高,酶活损失小,酶表面含水量低,有机溶剂选择范围广等优点,受到了人们广泛的关注和研究.多数研究发现修饰过的脂肪酶催化活性高,选择性高,反应条件温和,有利于在有机溶剂的反应,并且方便分离和重复使用,也可以提高酶的利用率[3-5].
在利用专一性酶催化油脂酯交换反应的过程中,往往都会伴随着酰基位移的发生,酰基位移的发生直接影响着酯交换的反应产物组成.科研工作者很早就已经注意到酰基位移方面的问题.影响酰基位移的因素很多,如反应时间、反应温度、加酶量、加水量、底物比、酰基链的长度等,其中,反应温度对酰基位移有直接影响[6-7].一般认为,酰基位移的机理是由于甘二酯或甘一酯的羟基氧原子的孤对电子对羰基碳的亲核进攻引发的,从而形成了一个五元环中间体,五元环随后从碳氧键裂开,形成了更稳定的甘二酯或甘一酯[8].
本研究采用非离子表面活性剂修饰的脂肪酶作为催化剂,以茶油和亚油酸为原料进行酯交换反应,分析反应过程中酯交换量、酰基位移和反应体系中各组分含量,考察非离子表面活性剂的修饰作用对酶催化酯交换反应的影响,为酯交换过程中的酰基位移研究提供一些理论基础.
1 材料与方法
1.1 材料
猪胰脂酶:实验室自制;茶油:河南信阳长园野生茶油有限公司(酸价0.68 mg/g;过氧化值3.98 mmol/kg;脂肪酸组成见表1);亚油酸(≥96%):实验室自制(脂肪酸组成见表2);吐温(Tween40、Tween65)、司盘(Span60、Span80)、蔗糖酯(S1170、S1670)及甘一酯标品、甘二酯标品、甘三酯标品:Sigma 公司.
正己烷、异丙醇、冰乙酸均为色谱纯;无水乙醇、无水乙醚、石油醚(30~60 ℃)、甲酸、异辛烷、无水硫酸钠和硅胶G 均为分析纯;以上试剂均为天津市科密欧化学试剂有限公司生产.
1.2 仪器与设备
6890N 气相色谱仪:美国Agilent 公司;色谱柱BPX-70(30 m×250 μm×0.25 μm):澳大利亚SGE公司;Waters2695 高效液相色谱仪及Waters2420 蒸发光检测器:美国Waters 公司;Yp5002 电子天平:北京科实兴业科技有限公司;ZF-I 型三用紫外分析仪:上海康华生化仪器制造有限公司.
1.3 方法
1.3.1 原料理化性质分析
油脂酸价测定参照GB/T 5530—2005 动植物油脂酸值和酸度测定.
过氧化值的测定参照GB/T 5538—2005 动植物油脂过氧化值测定.
1.3.2 脂肪酶的修饰
各非离子表面活性剂的修饰方法均按其最佳修饰方法修饰,具体修饰方法参照课题组前期研究[9-11].
1.3.3 酶催化酯交换反应
将称量好的茶油、亚油酸加入250 mL 圆底烧瓶中,在60 ℃恒温水浴锅内搅拌.再加入100 mL异辛烷(经分子筛处理)和0.4%(V/V)的蒸馏水,搅拌一定时间后,加入脂肪酶开始反应.反应过程中间隔取点处理,采用气相色谱分析产物中甘三酯全样及sn-2 位脂肪酸组成;采用液相色谱分析产物中甘一酯(MG)、甘二酯(DG)、甘三酯(TG)及脂肪酸(FA)的含量.
酯交换量(%)=L后-L前,
式中:L前为反应前甘三酯中亚油酸的质量百分含量,即茶油中亚油酸的质量百分含量;L后为反应后甘三酯中亚油酸的质量百分含量,即产物甘三酯中亚油酸的质量百分含量.
酰基位移(%)=(O前-O后)/O前×100,
式中:O前为反应前甘三酯sn-2 位脂肪酸组成中油酸的质量百分含量,即茶油sn-2 位脂肪酸组成中油酸的质量百分含量;O后为反应后甘三酯sn-2 位脂肪酸组成中油酸的质量百分含量,即产物甘三酯sn-2 位脂肪酸组成中油酸的质量百分含量.
1.3.4 甘三酯脂肪酸组成及其sn-2 位脂肪酸组成分析
甘三酯脂肪酸组成、sn-2 位脂肪酸组成分析参照孙江彦等[11]的前期研究.气相色谱仪:Agilent 6890N;检测器:氢火焰离化检测器;毛细管脂肪酸分析色谱柱:BPX-70;进样口温度:230 ℃;柱温:180 ℃;检测器温度:300 ℃;氮气流速:1.5 mL/min.
1.3.5 产物组成成分分析
采用液相色谱分析产物中甘一酯(MG)、甘二酯(DG)、甘三酯(TG)及脂肪酸(FA)的含量.条件如下:色谱柱,Sunfire Prep Silica 5 m 4.6×250 mm;流动相,V正己烷∶V异丙醇∶V乙酸=84∶15∶1,流速1 mL/min,梯度洗脱条件参照Marcato 等[12]的研究.ELSD 检测条件:氮气压力,35 psi;漂移管温度,60 ℃.
2 结果与分析
2.1 非离子表面活性剂的修饰作用对酶促酯交换过程中酯交换量的影响(图1)
由图1 可知,在12 h 后所有的酶催化反应基本趋于平衡,酯交换量均达到25%以上且变化不大;反应平衡时,各反应的酯交换量相差不大,都为30%左右.但在反应达到平衡前,不同酶催化酯交换反应时,酯交换量的增加速率即反应速率均不相同.其中,PPLipase 催化反应的反应速率最慢,反应24 h 左右才趋于平衡,平衡时酯交换量为28.3%.Span80-PPLipase、S1170-PPLipase 和S1670-PPLipase 催化酯交换反应的效率明显高于其他酶的催化效率;Span80-PPLipase 催化反应的反应速率最快,反应在2 h 酯交换量已达到25%左右,在12 h 时酯交换量已达到最大值29.9%.Span60-PPLipase、Tween40-PPLipase 和Tween65-PPLipase的催化效果基本相同,但都优于PPLipase.可见用非离子表面活性剂修饰的脂肪酶,其催化活性都得到了提高.
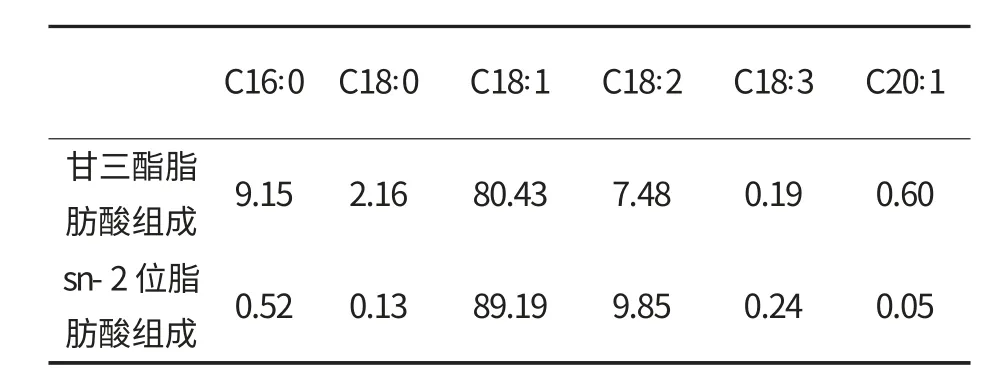
表1 茶油脂肪酸组成 %

表2 亚油酸脂肪酸组成 %
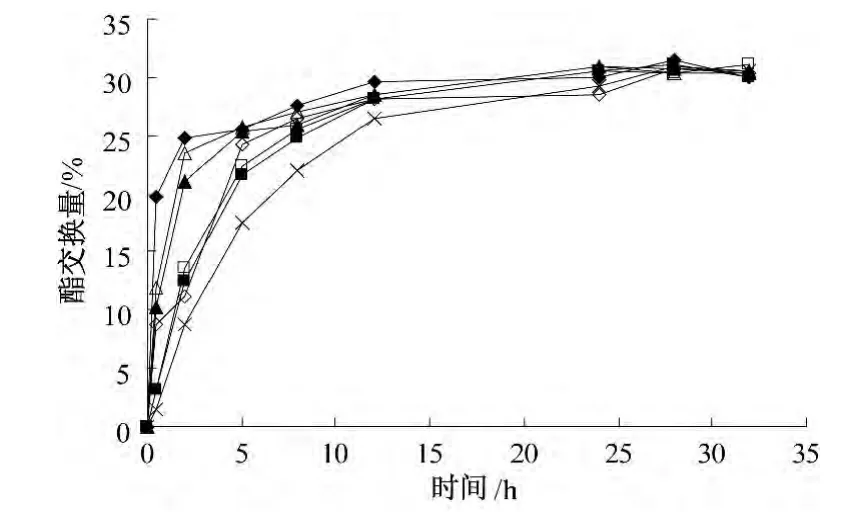
图1 酯交换过程中酯交换量随时间的变化
2.2 非离子表面活性剂的修饰作用对酶促酯交换过程中酰基位移的影响(图2)
由图2 A 可以看出,在反应过程中,各种酶所催化反应的酰基位移的变化趋势基本相同.在酯交换量为20%以前,各反应酰基位移程度都较低且增加十分缓慢,之后酰基位移均快速增加.当酯交换量在20%以下时,Span80-PPLipase、S1170-PPLipase 和S1670-PPLipase 所催化反应的酰基位移基本相同,都在5%以下,且Span80 修饰酶催化的反应酰基位移最小(小于3%);Tween65-PPLipase、Tween40-PPLipase 和Span60-PPLipase 催化反应的酰基位移都在10%以下;猪胰脂酶催化反应的酰基位移最大,酯交换量为20%时,酰基位移已达到16%左右.当酯交换量大于25%时,PPLipase 和修饰PPLipase 催化反应的酰基位移迅速增加,这说明酯交换反应接近平衡以后,反应的酰基位移明显增加.
由图2 B 可知,各种酶所催化反应的酰基位移与时间的关系基本相同.都是随着时间的增加,酰基位移也随之增加.当反应24 h 后,各反应的酰基位移率基本保持不变.反应平衡后,猪胰脂酶催化的反应酰基位移率最低,约为28%,S1670-PPLipase 催化的反应酰基位移率最高,约为41%.S1170-PPLipase、Tween40-PPLipase、Tween65-PPLipase、Span80-PPLipase 和Span60-PPLipase 催化反应的酰基位移率在28%~41%之间.

图2 反应过程中酰基位移随酯交换量(A)和时间(B)的变化
2.3 非离子表面活性剂的修饰作用对酶促酯交换过程中各组分含量的影响
如前所述,在12 h 后所有的酶催化反应基本趋于平衡,酯交换量均达到25%以上(图1).当反应达到平衡以后,各组分的含量虽然有小幅波动,但都是基本趋于稳定的(图3).在PPLipase 和修饰PPLipase 催化酯交换过程中,随着反应时间的延长酯交换量不断增加,体系内甘三酯含量不断减少,基本都在酯交换量大于25%后趋于不变(图3 A);脂肪酸的含量不断增加,当反应趋于平衡时,脂肪酸含量趋于不变(图3D);甘二酯在反应开始的最初阶段,含量迅速增加,稍后甘二酯含量基本维持在8%左右(图3B).
在反应的开始阶段体系中未检测到甘一酯的存在;PPLipase 催化的反应在酯交换量为17%时检测到甘一酯的存在(12.5%),随着酯交换反应的进行甘一酯含量变化不明显(13%左右);Tween40-PPlipase 催化的反应在酯交换量达13%时有少量甘一酯(约为4%)生成,随后甘一酯含量有所增加,反应达平衡时甘一酯含量约为13%;Tween65-PPLipase 催化的反应在酯交换量达到21%时检测到甘一脂的生成(约7%),随着反应进行含量有所增加,最终在12%~17%间波动.Span60-PPlipase催化的反应在酯交换量达到24%时,检测到甘一酯的存在(约10%),随酯交换反应的进行甘一酯含量在10%左右波动.Span80-PPLipase、S1170-PPLipase 和S1670-PPLipase 催化的反应,在酯交换量小于20%前,未检测到甘一酯的存在,随酯交换反应的进行甘一酯含量在10%~16%间波动.

图3 酯交换过程中各组分含量随酯交换量的变化
造成上述现象的原因主要是,脂肪酶在催化酯交换反应时,实际上是分两步进行反应的:水解和酯化,即甘三酯先进行水解生成甘二酯和甘一酯,再催化甘二酯和甘一酯与脂肪酸进行酯化反应[13].因为在反应初期没有检测到甘一酯生成,且本试验所用的脂肪酶为sn-1,3 位专一性脂肪酶,在反应刚开始阶段,专一性脂肪酶先催化甘三酯迅速水解,且只水解掉了sn-1(3)位的一个酰基团生成甘二酯,随后才进行酯化反应.在不同修饰酶催化的反应中,当酯交换量在5%以下时,甘二酯的含量已经在8.0%左右不再变化,可能是因为在酶催化酯化反应时,需要一定量的甘二酯来维持底物浓度,以便充分发挥酶的活性,使甘二酯与脂肪酸的酯化速率达到试验条件下的最大值.Sobhi Basheer 等[14]用脂肪酶催化三棕榈酸甘三酯与硬脂酸进行酯交换反应,发现在反应初期,约有6%的甘二酯会迅速生成并且不再变化.
除PPLipase 催化的反应外,其他酶催化的反应在酯交换量小于20%时,酰基位移率都在5%以下(图2);此时体系内甘二酯含量已经达到最大值,甘一酯的含量几乎为0(图3B 和图3C).由此,可以认为在反应开始阶段,体系内酯交换速率较快,甘三酯水解所生成的甘二酯来不及被脂肪酶进一步水解为甘一酯,就已经开始进行酯化或者酯交换反应了,导致体系内没有甘一酯生成.此时,甘二酯含量虽然已达到最大值,但酰基位移率仅在5%以下,这说明在试验条件下,仅有很少量的甘二酯发生了酰基位移.Kodali 等[15]在研究sn-1,2 甘二酯向sn-1,3 甘二酯转变的过程中发现,当反应达到平衡时,体系内sn-1,3 甘二酯含量达到56%.
3 结论
非离子表面活性剂的修饰作用在一定程度上提高了猪胰脂酶的催化活性.在酯交换量达到20%以前,非离子表面活性剂的修饰作用均可以使猪胰脂酶催化酯交换酰基位移率有所降低.当反应趋于平衡时,猪胰脂酶催化的反应酰基位移率最低,约为28%,S1670-PPLipase 催化反应的酰基位移率最高,约为41%,S1170-PPLipase、Tween40-PPLipase、Tween65-PPLipase、Span80-PPLipase、Span60-PPLipase 催化反应的酰基位移率在28%~41%之间,且依次降低.
在猪胰脂酶催化酯交换过程中,当酯交换量低于20%时,各反应体系内的酰基位移率都低于5%.甘二酯含量在反应开始初期就已达到最大值,且不再随反应变化.当酯交换量高于20%时,酰基位移率和甘一酯含量迅速增加,此时体系内酶催化的水解速率要大于酯化速率.随着反应趋于平衡,体系内各组分含量及酰基位移率均趋于不变.
[1]付海霞,杨国龙,毕艳兰,等.脂肪酶修饰研究进展[J].粮食与油脂,2013,26(1):1-4.
[2]Okahata Y,Ijiro K.A lipid-coated lipase as a new catalyst for triglyceride synthesis in organic media[J].J Chem Soc Chem Commu,1988,17(20):1392-1394.
[3]Goto M,Kamiya N,Miyata M,et al.Enzymatic sterification by surfactant coated lipase in organic media[J].Biotechnol Progr,1994,10(3):263-268.
[4]Goto M,Miyata M,Kamiya N.Novel surfactantcoated enzymes immobilized in poly microcapsule[J].Biothechnology Techniques,1995,9(2):81-84.
[5]周晓云,包广粮,钟卫鸿,等.脂肪酶在表面活性剂介质中的催化反应动力学研究[J].浙江工业大学学报,2000,28(1):19-23.
[6]Vikbjerg A F,Mu H,Xu X.Elucidation of acyl migration during lipase-catalyzed production of structured phospholipids[J].J Am Oil Chem Soc,2006,83(7):609-614.
[7]杨国龙,王梦华,王业涛,等.影响猪胰脂酶催化油茶籽油与亚油酸甲酯酯交换过程中酯交换量和酰基位移因素的研究[J].中国油脂,2010,35(10):38-41.
[8]Fischer E.Wanderung von Acyl bei den Glyceriden[J].Berichte der deutschen chemischen Gesellschaft(A and B Series),1920,53(9):1621-1633.
[9]曾俊,杨国龙,毕艳兰,等.乙醇溶液体系中Span 修饰猪胰脂酶的研究[J].食品工业科技,2011,32(9):187-189.
[10]张洁,杨国龙,毕艳兰,等.乙醇溶液中Tweens 对猪胰脂酶的修饰作用[J].食品与发酵工业,2012,38(4):44-47.
[11]孙江彦,杨国龙,毕艳兰,等.醇溶体系中蔗糖酯修饰猪胰脂酶的研究[J].河南工业大学学报:自然科学版,2013,34(2):4-7.
[12]Marcato B,Cecchin G.Analysis of mixtures containing free fatty acids and mono-,di-and triglycerides by high -performance liquid chromatography coupled with evaporative lightscattering detection[J].J Chromatography A,1996,730(1):83-90.
[13]Wendy M.Willis and Alejandroc G.Marangoni,Assessment of lipase and chemically catalyzed lipid modification strategies for the production of structured lipids[J].J Am Oil Chem Soc,1999,76(4):443-450.
[14]Basheer S,Mogi K,Nakajima M.Interesterification kinetics of triglycerides and fatty acids with modified lipase inn -hexane[J].J Am Oil Chem Soc,1995,72(5):511-518.
[15]Kodali D R,Tercyak A,Fahey D A,et al.Acyl migration in 1,2-dipalmitoyl-sn-glycerol[J].Chem Physics Lipids,1990,52(3):163-170.

