蛋白质结晶研究进展
王岸娜,苏子豪,吴立根,张 曼,孙敬捧
(河南工业大学 粮油食品学院,河南 郑州 450001)
0 引言
到目前为止蛋白质结晶问题仍是蛋白质研究的一个瓶颈[1].由于生物大分子的物理、化学及生物性质复杂,使蛋白质的晶体培养工作变得相当复杂[2].蛋白质晶体内部有40%~60%的空间被溶剂分子填充,在晶体内形成孔隙和通道,使晶体的韧度、硬度降低,可能加剧晶体排列的不规则性.蛋白质分子间的作用力导致晶格排列上的不规则情形的增加[3],这也增加了蛋白质结晶的难度.
尽管高通量结构基因组学简化了目标蛋白质的表达纯化结晶及数据的收集过程,但仍只有少量蛋白质能形成满足衍射要求的单晶[4].研究生物大分子结晶的一般原理和条件,获得晶体衍射数据,对食品安全、药物研发与设计等领域有重要推动作用.目前蛋白质结晶学发展还不成熟,蛋白质结晶在很大程度上是基于经验性的.作者主要讨论了影响蛋白质结晶的因素,介绍了常用的蛋白质结晶方法,并对提高结晶筛选率的新策略和新技术作了详细介绍.
1 蛋白质的结晶过程
蛋白质结晶是溶液中的蛋白质分子经一定规则排列堆积形成有序聚集体的过程,其结构特征是有序的结构框架及溶剂分子共同形成的空间网状结构[5].蛋白质结晶可分为形核和晶核生长两个阶段.形核包括均相成核和非均相成核.晶核生长是处于亚稳区或不稳定区的蛋白质分子与晶核接触有序结合到晶格结构上的过程[6].蛋白质结晶只有在蛋白质溶液过饱和时才会发生.根据过饱和程度的不同,蛋白质溶解相图分为溶解区、亚稳区、不稳定区及沉淀区[7].在不稳定区形成少量晶核,使晶核在亚稳区缓慢生长,这是目前比较理想的晶体生长条件[8].
获得过饱和蛋白质溶液的原理一般有4 种:改变蛋白质性质、改变水的化学活性、调整蛋白质分子间作用、调整蛋白质分子与溶剂的相互作用.常用的获得过饱和溶液的方法大部分依据这4 种原理(表1).
2 影响蛋白质结晶的因素
影响蛋白质结晶的因素大致可分为物理因素、化学因素以及生物化学因素等.物理因素包括温度、电磁场和压力等外界条件;化学因素包括溶液浓度、pH 值、过饱和度以及离子强度等溶液环境[9];生物化学因素包括蛋白质结构、对称性、均一性以及等电点等(表2).
2.1 温度
温度能够通过改变蛋白质的溶解度影响结晶过程[10].蛋白质在高温下的溶解度随结晶过程是由焓驱动或熵驱动决定.比如溶菌酶随着温度的升高而溶解度升高,糜蛋白酶原A 则随温度的升高溶解度降低.温度能够影响蛋白质侧链的酸碱平衡常数,氨基酸残基侧链电离基团的pKa 与介质的离子强度关系非常密切.蛋白质在低离子强度介质中溶解度随温度升高而升高,在高离子强度时则降低.温度因素一般用于筛选优化结晶条件和生长高质量晶体.目前的温度筛选策略有最佳温度筛选策略、即时控制温度策略、衡量过饱和度法及循环温度策略.最佳温度筛选系统在结晶板上可同时监测12 个恒温点下16 个不同的结晶条件的温度梯度;即时控制温度装置可在一个结晶板上设置多个温度形成温度梯度,以达到批量、快速筛选结晶温度条件的目的;衡量过饱和度法通过控制结晶液稳定在相图的某一区域以生长出高质量的晶体[11];循环温度策略通过维持温度循环变化以筛选适合结晶的条件.

表1 获得过饱和结晶液的方法

表2 蛋白质结晶的影响因素
热历史效应也是影响蛋白质结晶性质的因素之一.热历史效应即结晶前蛋白质溶液的保存温度和保存时间的不同会导致蛋白质溶液最终的结晶性质不同.此外,沉淀剂还可以改变蛋白质溶解度对温度的依赖性.高沉淀剂浓度下,蛋白质溶解度受温度影响较小;较低沉淀剂浓度下,蛋白质溶解度强烈依赖温度.
2.2 样品纯度和均一性
蛋白质样品的纯度和均一性是蛋白质结晶非常重要的两个因素.纯度可通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳和质谱测定.蛋白质的二级结构可以使用傅里叶变换红外分光法和红外圆二色谱法测定.样品均一性可通过动态或静态光散射(SLS)测定.SLS 测定均一性时,通过分析透射光强度可获得蛋白质分子的摩尔质量[12].SLS 可检测蛋白质样品的质量及溶液聚合状态.
2.3 光照
光照的作用主要是通过光化学反应和光的空穴效应影响蛋白质结晶.光化学反应即物质在可见光和紫外光的照射下分子吸收光子所引起的化学反应;光的空穴效应即激光照射到蛋白质溶液上,蛋白质分子和溶剂分子吸收光子产生热压,热压产生的冲击波产生空化气泡[13].蛋白质分子能迅速吸附在空化气泡表面导致蛋白质局部浓度快速升高,从而提高了形核的概率.Murai 等[14]在气泡萎缩的过程中观察到一个荧光强度为正常情况下3 倍的亮点,可能是蛋白质的高浓度区.
2.4 沉淀剂
能够降低蛋白质溶解度的化合物被称为沉淀剂.沉淀剂通过3 种机理发挥作用:改变水分活度、改变溶剂的介电常数和增强空间排阻.不同作用机制的沉淀剂之间互换性很小.不同的沉淀剂在结晶过程中可能会产生协同作用,最终促进蛋白质晶体生长.
大分子沉淀剂可以分为4 类:盐、有机溶剂、长链多聚体、低分子量聚合体和不挥发有机物,沉淀剂的种类如表3 所示.

表3 沉淀剂种类
2.5 添加剂
除了结晶复合物、缓冲液和沉淀剂以外,添加后有利于产生晶体的任何物质被称为添加剂(表4).普遍认为添加剂的作用机理是与蛋白质分子的某一位点形成了特殊的相互作用.对大多数蛋白质来说,阳离子对其溶解度影响较小,阴离子影响较大.金属离子能够稳定晶格中蛋白质分子间的相互作用.有机小分子物质可降低溶剂的介电常数,并影响疏水相互作用.向结晶液中添加配基能够提高结晶筛选率.添加配基有两种方式:直接添加到结晶母液中;与蛋白质形成复合物后加入到结晶液中.

表4 添加剂种类
2.6 pH 值
蛋白质中的氨基酸残基侧链含有大量的可电离基团,因此体系pH 值的微小改变可导致蛋白质溶解度的变化.pH 值可改变蛋白质大分子间盐桥和氢键的数目和作用力,这两种键对形核和晶体生长起着至关重要的作用[15].静电相互作用在蛋白质分子的特异性结合,蛋白质水合作用及与小分子、离子相互作用方面起着重要作用.一般地,能够保持蛋白质天然折叠状态的pH 值更有利于促进蛋白质晶体的形成.
2.7 耐热性
一直以来蛋白质的耐热性与蛋白质结晶之间的关系颇具争议[16].基于耐热性的预结晶筛选可大大提高结晶成功率.基于荧光的热迁移分析是一种快速、经济的检测蛋白质稳定性的方法,可通过监测与疏水核心残基相互作用的外部荧光探针信号来检测蛋白质的稳定性.
2.8 重力场
晶体周围溶液浓度随着晶体的生长逐渐低于整体浓度,形成一系列浓度梯度.浓度梯度与重力作用在晶体周围引起对流,晶体界面与高浓度的结晶液接触不利于形成高质量晶体.而在失重条件下不会产生对流,溶液中的溶质仅仅受自由扩散作用的影响,而且与晶体表面接触的结晶液的浓度稍微过饱和,这很有利于生长高质量的蛋白质晶体.重力的另一个负面影响是沉降作用,这会导致生长的晶体降落并附着在另一晶体上然后继续生长.
2.9 强迫流动
合理控制强迫流动可以生长数量少、尺寸大、质量高的蛋白质晶体.目前的强迫对流研究有泵蠕动驱动、利用电场驱动、搅拌、摇动及振动等方式[17].搅拌能够破坏晶体周围的浓度梯度和抑制过量的自发形核并增加蛋白质分子间触磁机会[18],从而促进高衍射质量晶体的形成.
2.10 电场
使用高压电场可以控制晶核的形成和结晶热力学过程[19].通过控制电流、电压、频率及电极材料等可以控制晶体形核数量以有利于产生高衍射质量晶体.溶液pH 可导致蛋白质带电性质的不同,因此形核可发生在阴极或者阳极.电场对形核速率的影响与液相、固相之间的介电常数差异有关[12].离子强度越大电场的影响也就越大[20].Koizumi 等[21]在结晶溶菌酶时发现,对结晶液施加不同频率的交流电场能够控制晶体的形核速率.
施加在溶液中的电场分为直流电场和交流电场、内置电场和外置电场[22].Hou 等[23]采用标准平板印刷技术,将阳极与阴极交叉排列的电极组对印刷在玻片上形成内置电场.电场通过浓度梯度作用、电聚焦效应、氧化还原反应、pH 值改变、偶极离子反应等影响蛋白质结晶过程.
2.11 磁场
均匀磁场和梯度磁场都可用在蛋白质结晶试验中.不均匀磁场能够通过磁力和抑制对流作用弱化重力影响[24].通过使磁化率不同引起的磁力对流与浓度梯度引起的对流方向相反来抑制结晶溶液中的对流作用.此外,在高场强磁场条件下形成的结晶存在定向效应有时会导致蛋白质性质的变化.Gavira 等[25]发现定向效应导致α-螺旋和β-折叠与磁场方向相一致.目前磁场对蛋白质结晶影响的详细机制尚不清楚.
3 蛋白质结晶方法
目前最常用的蛋白质结晶方法有气相扩散法和批量结晶法,还有一些比较新颖的结晶方法,其中包括膜结晶法、自由界面扩散法和微流芯片技术等.
3.1 气相扩散法
气相扩散法主要包括坐滴法和悬滴法(图1).气相扩散法基于水分子从低浓度结晶液自发转移到高浓度结晶液池中,导致溶液中蛋白质浓度缓慢升高的原理.坐滴法的结晶液被放置在带有凹槽的支架上,一般为2~10 μL.悬滴法的结晶液悬挂在结晶室盖板上.坐滴法制备的晶体可能会附着于玻片表面,导致转移晶体不便.悬滴法样品需求量较小,而且准备起来较困难.Lu 等[26]研究发现,降低结晶液中结晶剂浓度而保持蛋白质浓度不变可以加快蒸汽扩散速率并提高结晶的成功率.
3.2 批量结晶法
批量结晶法又称配液结晶法,是最早被应用在结晶试验中的方法之一.它是将蛋白质溶液和结晶剂直接混合在密闭的体系中来实现结晶.与蒸汽扩散结晶法相比,批量结晶法操作简单,但耗样量较大[27].微配液结晶法使用低密度石蜡油密封结晶液池,通过石蜡油预防结晶液溶剂快速、大量蒸发,从而使蛋白质溶液缓慢趋于饱和.Merlino 等[28]提出了一种改良的微配液结晶法,在试验初期,蛋白质和结晶剂混合后的浓度就达到形核的浓度,从而避免了油滴批量结晶法的缺点,即水分子的缓慢蒸发导致盐类沉淀并最终影响产生的晶体质量.
3.3 膜结晶法(Dialysis method)
膜结晶法亦称透析结晶法,是用半透膜隔开蛋白质溶液和结晶剂,通过膜蒸馏逐渐脱去蛋白质溶液中的溶剂分子,使得蛋白结晶溶液浓度缓慢升高达到亚稳区状态,从而产生蛋白质结晶.常用的透析设备有透析管和微量透析纽扣(图2).该法具有结晶速度快、起始浓度低、诱导时间短、过程可控[29]及在寻找结晶的最佳条件过程中透析袋内的蛋白质可以重复使用等优点.另外由于透析结晶法可以为膜蛋白提供疏水环境,从而保持膜蛋白的活性,所以平衡透析法较多地应用于膜蛋白的结晶.2010 年,庞鸿宇等[30]采用动态膜结晶法成功地获得了较大尺寸的木瓜蛋白酶结晶.
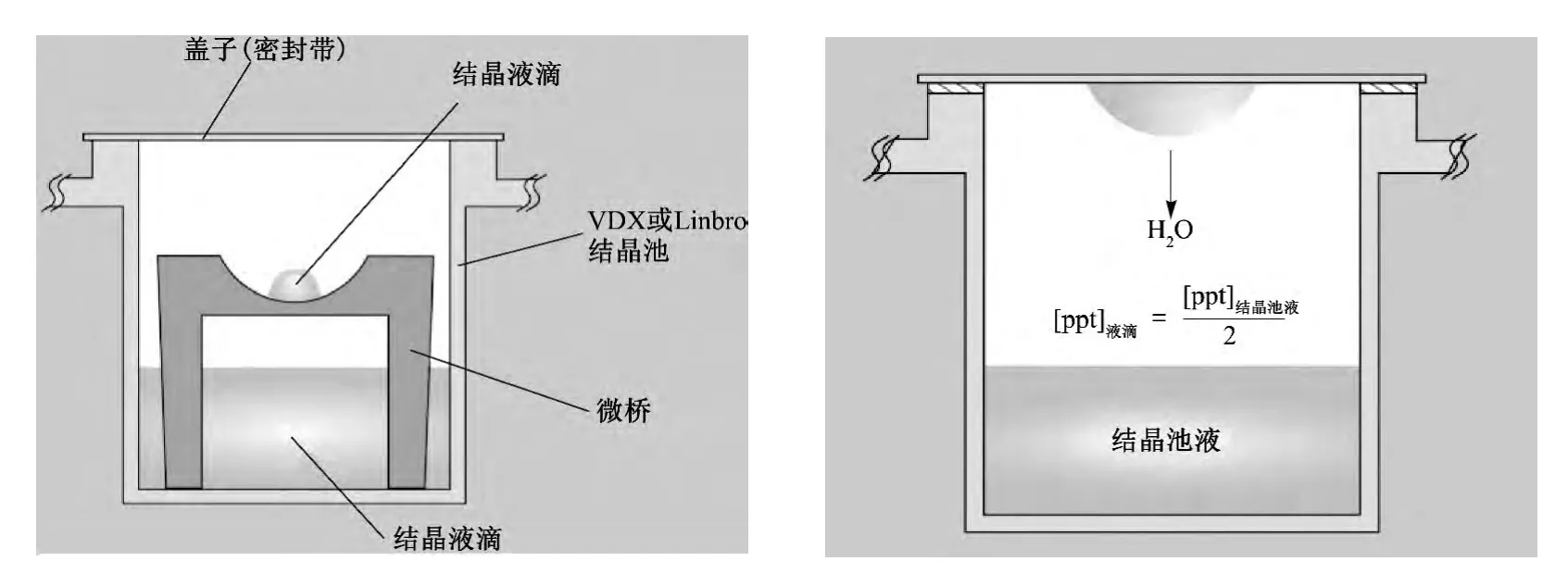
图1 坐滴法和悬滴法
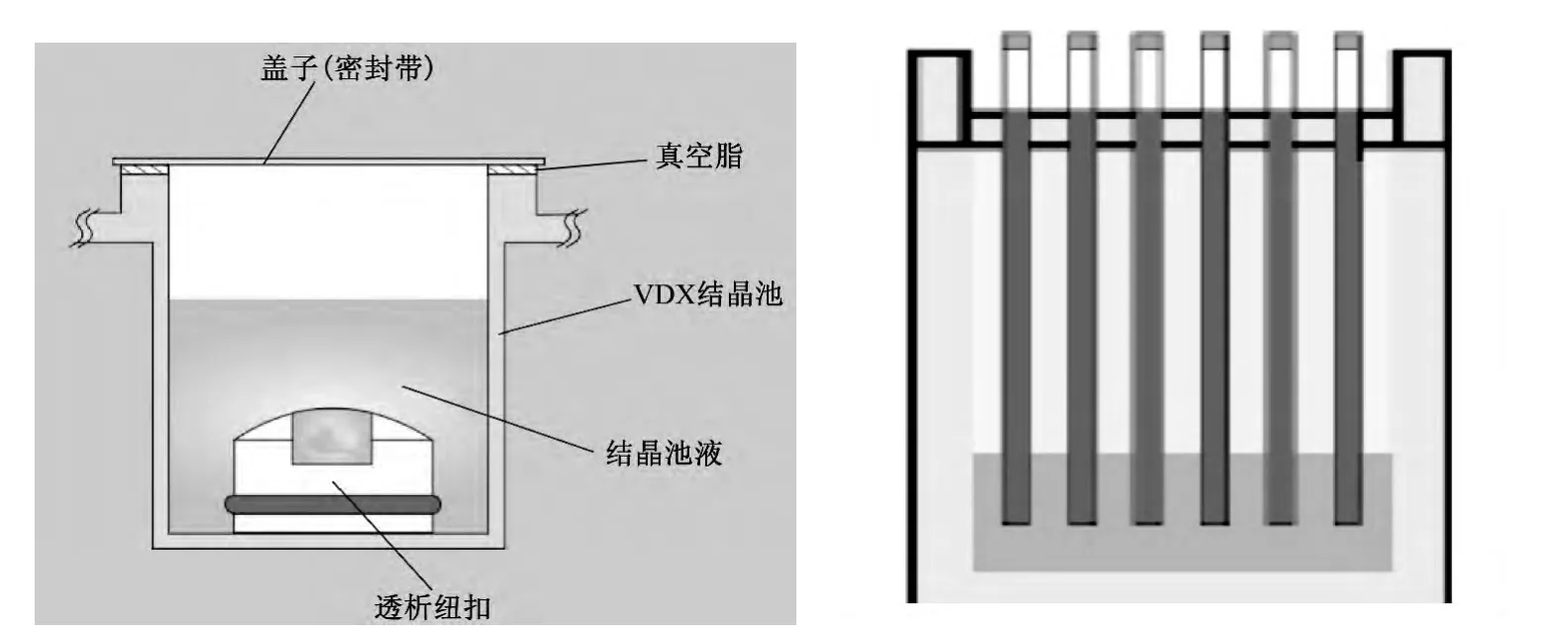
图2 透析纽扣和透析管
3.4 自由界面扩散法
该法是在毛细管中加入待结晶的蛋白质溶液和结晶剂溶液,在液-液界面上由于浓度差发生溶质扩散,蛋白质溶液浓度缓慢升高最终达到过饱和而产生结晶.逆向扩散法是一种较新颖的改良方法,将容纳有蛋白质溶液的毛细管的一段插入凝胶中,再在凝胶中加入沉淀剂溶液,沉淀剂通过毛细管扩散至蛋白质溶液中,形成系列浓度梯度.因为凝胶表面的沉淀剂浓度最大,所以较大的晶体通常产生于毛细管末梢.相比于传统方法,逆向扩散法可以在单个毛细管中形成沉淀区、形核区、亚稳定区和溶解区一系列不同的浓度梯度,因此仅需一次试验即可筛选不同浓度下的蛋白质结晶条件.
3.5 微流芯片技术
微流控技术具有高通量、低能耗、集成化等优势.微流体结晶的主要优点有3 个:样品量在纳升或皮升水平;微体系下的一些特殊物理、化学反应可能对结晶有良好的促进作用;微流体技术具有集成度高、规模化等优点,可显著提高试验效率[31].微流体技术在高通量筛选蛋白质结晶条件、结晶过程的热力学和动力学数据测量、探测和调控晶型等方面均有广泛的应用[32].如Pinker 等[33]根据逆向扩散法(Counter-diffusion)原理研制了模拟其结晶过程的“树形”结晶芯片.从“树根”处加入蛋白质样品,从“树枝”加入各种结晶剂.蛋白质样品和结晶剂在“树干”中扩散并相遇,形成了从溶解区到不稳定区一系列的浓度梯度.Masatoshi 等[34]利用液滴型微流控技术研究奇异果甜蛋白结晶特征时发现,即使在高浓度条件下,只要液滴体积在200 μm 以内就能产生晶体.这证明了通过调整液滴大小也能控制蛋白质结晶.
4 其他提高蛋白结晶条件筛选率的方法
4.1 蛋白质分子改造
常用的蛋白质改造方法有定点突变、赖氨酸甲基化、剪切或删除柔顺环区、融合蛋白、复合物共结晶及原位蛋白水解等[35].这几种方法都是通过降低分子表面熵、提高溶解度、提高分子在溶液中的均一性来促进蛋白质分子的结晶.
4.1.1 定点突变
定点突变是对目标蛋白质基因进行突变、表达、纯化后得到目标蛋白质的技术.定点突变也被称为表面熵降低策略(Surface-entropy reduction,SER),即通过定点突变将较高构象熵的氨基酸替换为表面熵较低的氨基酸以促进结晶.常用的突变有赖氨酸到丙胺酸或色氨酸、谷氨酸到丙氨酸或天冬氨酸等[36].通过表面熵降低策略获得的晶体结构已经有160 多种[37].
4.1.2 赖氨酸甲基化
赖氨酸甲基化是将一定量的甲基化试剂与蛋白质溶液混合反应,之后提取、纯化进而提高结晶条件筛选率的方法,具有简单、快速等优点.Sledz等[38]猜测甲基化促进蛋白质结晶的原因是:甲基化基团影响了蛋白质分子的电子密度,促进了有序化堆积;甲基化后更有利于形成非共价键.
4.1.3 剪切或删除柔顺环区
柔顺环区包括多肽链N 末端和C 末端的柔顺区域、内部Ω 环形柔顺区域及连接结构域的柔顺区域.删除蛋白质分子内柔顺环区可以提高蛋白质溶液均一性.此外影响蛋白质溶液均一性的因素还有蛋白质糖基化,消除蛋白质糖基化的主要措施是将易被糖基化的氨基酸如Asn 替换为Glu或Asp[39].
4.1.4 融合蛋白
融合标签技术通过目标蛋白基因与标签蛋白基因重组后植入宿主体内表达来改善目标蛋白溶解性、稳定性及可结晶性.融合标签包括两种:一种是短的寡聚肽,如6-组氨酸;另一种是高度表达的可溶性蛋白,如谷胱甘肽、麦芽糖结合蛋白等.融合标签技术一般应用于溶解度较低或较难结晶的蛋白质,采用融合标签技术后可以提高目标蛋白的溶解度和促进晶格的形成.
4.2 检测蛋白质分子在溶液中的状态
一般来说处于稳定和均一状态的蛋白质溶液更倾向于筛选到晶体.近年来新发展的一些物理化学技术如静态光、动态光散射和荧光各向异性度值分析等可以从溶解曲线和相图的界定等各方面提供晶体生长早期阶段的信息,为选择合适蛋白质溶剂和结晶试剂等提供参考.动态光散射技术可以灵敏地检测到蛋白溶液中颗粒大小的变化,可用于指导蛋白质样品的制备.Pusey 等[40]通过荧光分子的转动速度等来判断晶体生长中聚集体的大小来预测蛋白质的可结晶性.
4.3 异相形核
4.3.1 物理法
物理法包括晶体晶格特征诱导形核和表面微观结构特性诱导形核[41].
晶格特征诱导形核分为外延生长及籽晶法.外延生长通过选择合适的结晶基底来诱导异相形核.根据基底材料的不同可分为:矿物基底外延生长、脂质单层亲水表面外延生长及蛋白质联合矿物基底外延生长.外延生长要求基底材料的晶格与目标蛋白的晶格相匹配.籽晶法通过直接在亚稳区加入已经形核的籽晶(或晶核)以保证有限的晶核生长成大的单晶[42].
表面微观结构特性诱导形核包括多孔表面、粗糙表面诱导形核及添加形核剂诱导异相形核.目前普遍认为多孔表面诱导形核通过提供异相形核位点使蛋白质分子正确排列,从而促进结晶.蛋白质在粗糙表面形核时具有较低的形核势垒且能够聚集在粗糙表面上,因此可以诱导蛋白质形核.异相形核剂主要是各种不溶于水的微粒,比如二乙烯聚苯微球等.
4.3.2 化学法
化学法包括静电作用和疏水作用[41].当结晶基底电荷与蛋白电荷相反时,一般会促进蛋白质的结晶.蛋白质含有大量的非极性氨基酸残基,蛋白质在溶液中的形态及性质必然会受到疏水作用的影响.
4.4 共结晶
蛋白质与底物、核苷酸、协同因子或者小分子等结晶伴侣结合后有利于提高蛋白质结晶的成功率[39].共结晶通过结晶辅助因子与目标蛋白结合形成非共价结合物,增加了目标蛋白的溶解度和均一性,促进了晶格接触.Schartman 等[43]利用数学计算推导证明蛋白质与结晶伴侣结合可以稳定自身的热力学特性,从而促进结晶.
4.5 原位蛋白水解
原位蛋白水解是在待结晶的蛋白质溶液中加入极微量的蛋白酶(如溶菌酶、糜蛋白酶等),通过酶解改变蛋白质的分子性质从而提高结晶的可能性.在原位蛋白水解法已经解析的300 种蛋白质中[44],其中有200 种蛋白质之前从未获得晶体,其余100 种虽然获得晶体但并未达到足够的衍射质量.Bai 等[45]在测定鼠科亚基CstF-77 的结构时发现只有加入极少量的枯草杆菌蛋白酶才能获得衍射质量的晶体.
5 展望
随着基因组学和结构生物学的快速发展,获得蛋白质晶体及衍射信息、了解蛋白质在生命活动中充当生命载体的本质变得越来越迫切.实验室广泛采用的结晶研究方法仍然是基于试错原理的规模化筛选.随着动态光散射技术的应用及蛋白质分子改造技术的快速发展,蛋白质结晶条件的筛选已经越来越具有可控性.近几年出现了一种非常有发展潜力的新颖的诱导结晶方法,被称为高压结晶法[46].该方法利用压力的变化来促进蛋白质结晶并能改善晶体的三维结构.高压结晶法通过控制结晶系统的压力来研究大分子空间构象及动力学特征,且能提供其他结晶方法无法获得的构象子状态信息[47].此外,高通量结晶通道和X 射线结构测定的快速发展使得越来越多的结晶学家开始使用结晶机器人,这使得试验效率和可重现性极大提高,从而大大减小获得蛋白质结晶条件所消耗的时间.
但是,目前蛋白质结晶方法学仍然是一门经验科学,尚没有一套完整的理论和方法能够指导结晶学家成功地获得高衍射质量的晶体.在将来的蛋白质可结晶性的研究过程中应该把主要精力投入在发展一套具有普适意义的理论体系上,使得筛选结晶条件、提高结晶质量更加理性,这应该成为未来结晶学研究者共同努力的方向.
[1]Giegé R.A historical perspective on protein crystallization f rom 1840 to the present day[J].FEBS Journal,2013,280(24):6456-6497.
[2]Li M,Chang W R.Protein crystallization[J].Photosynthesis Research,2009,102(2-3):223-229.
[3]刘晶晶.蛋白质结晶过程的模拟优化和实验研究[D].青岛:中国海洋大学,2010.
[4]Fogg M J,Wilkinson A J.Higher-throughput approaches to crystallization and crystal structure determination[J].Biochemi Soc Trans,2008,36(4):771-775.
[5]解旭卓,曹慧玲,鹿芹芹,等.蛋白质晶体的物理性质及其鉴别方法研究进展[J].生物技术通讯,2013,24(1):134-138.
[6]刘四化,王倩倩,肖良,等.蛋白质结晶方法的研究进展[J].中国生化药物杂志,2011,32(5):405-407.
[7]冯炜玮,陈志伟.蛋白质结晶及其影响因素研究进展[J].安徽农业科学,2010,30(18):9412-9414.
[8]Guglizza A,Aceto M,Simone S,et al.Novel functional per-fluorinated membranes:suitable nucleating systems for protein crystallization[J].Desalination,2006,199(1-3):200-203.
[9]McPherson A,Gavira J A.Introduction to protein crystallization[J].Acta Crystalloqr F Struct Biol Commun,2014,70(1):2-20.
[10]鹿芹芹,解思晓,马晓亮,等.温度控制在蛋白质结晶中的应用[J].材料 导报,2010,24(19):13-21.
[11]解思晓,鹿芹芹,吴子庆,等.温度影响蛋白质结晶的研究现状[J].生物技术通讯,2012,23(3):461-464.
[12]Russo Krauss I,Merlino A,Vergara A,et al.An overview of biological macromolecule crystallization[J].International Journal of Molecular Sciences,2013,14(6):11643-11691.
[13]Yoshikawa H Y,Murai R,Maki S,et al.Laser energy dependence on femtosecond laser -induced nucleation of protein[J].Appl Phys A,2008,93(4):911-915.
[14]Murai R,Yoshikawa H Y,Takahashi Y,et al.Enhancement of femtosecond laser -induced nucleation of protein in a gel solution[J].Appl Phys Lett,2010,96(4):3-5.
[15]Dumetz A C,Chockla A M,Kaler E W,et al.Effects of pH on protein-protein interactions and implications for protein phase behavior[J].Biochim Biophys Acta,2008,1784(4):600 -610.
[16]Dupeux F,Rower M,Seroul G,et al.A thermal stability assay can help to estimate the crystallization likelihood of biological samples[J].Acta Crystallogr Section D,2011,67(11):915-919.
[17]鹿芹芹,陈瑞卿,解旭卓,等.强迫流动环境对蛋白质结晶的影响[J].材料导报,2012,26(21):70-74.
[18]Roberts M M,Heng J Y Y,Williams D R.Protein crystallization by forced flow through glass capillaries:enhanced lysozyme crystal growth[J].Crystal Growth &Design,2010,10(3):1074-1083.
[19]Penkova A,Pan W,Hodjaoglu F,et al.Nucleation of protein crystals under the influence of solution shear flow[J].Ann N Y Acad Sci,2006,1077(1):214-231.
[20]Koizumi H,Uda S,Fujiwara K,et al.Control of effect on the nucleation rate for hen egg white lysozyme crystals under application of an external ac electric field[J].Langmuir,2011,27(13):8333-8338.
[21]Koizumi H,Fujiwara K,Uda S.Control of nucleation rate for tetragonal hen -egg white lysozyme crystals by application of an electric field with variable frequencies[J].Cryst Growth Des,2009,9(5):2420-2424.
[22]马晓亮,尹大川,曹慧玲.电场中的蛋白质结晶[J].生物技术通讯,2010,21(6):897-902.
[23]Diana H,Hsueh-Chia C.Ac field enhanced protein crystallization[J].Appl Phys Lett,2008,92(22):223902.
[24]Sazaki G.Crystal quality enhancement by magnetic fields[J].Prog Biophys Mol Biol,2009,101:45-55.
[25]Gavira J A,Garcia-Ruiz J M.Effects of a magnetic field on lysozyme crystal nucleation and growth in a diffusive environment[J].Cryst Growth Design,2009,9(6):2610-2615.
[26]Lu Q Q,Yin D C,Xie S X,et al.The effect of diluting crystallization droplets on protein crystallization in vapor diffusion method[J].Cryst Res Technol,2011,46(9):917-925.
[27]Chayen N E.Protein crystallization strategies for structural genomics[J].Crystallogr Rev,2009,15(2):135-139.
[28]Merlino A,Krsuss F R,Albino A,et al.Improving protein crystal quality by the without-oil microbatch method:Crystallization and preliminary X-ray diffraction analysis of glutathione synthetase from Pseudoalteromonas haloplanktis[J].Int J Mol Sci,2011,12(9):6312-6319.
[29]陈维敬,仲维清.蛋白质结晶的新进展与药物设计[J].药学实践杂志,2012,30(2):81-136.
[30]庞鸿宇,刘丽英,宋恒凯,等.木瓜蛋白酶动态膜结晶的实验研究[J].膜科学与技术,2010,30(1):30.
[31]朱丽娜,祝莹,方群.基于微流控技术的蛋白质结晶及其筛选方法的研究进展[J].高等学校化学学报,2014,35(1):1-11.
[32]徐丹,张金利,李韡,等.微流体结晶应用的最新进展[J].现代化工,2013,33(10):47-51.
[33]Pinker F,Brun M,Morin P,et al.ChipX:a novel microfluidic chip for counter -diffusion crystallization of biomolecules and in situ crystal analysis at room temperature[J].Crystal Growth&Design,2013,13(8):3333-3340.
[34]Maeki M,Teshima Y,Yoshizuka S,et al.Controlling protein crystal nucleation by droplet -based microfluidics[J].Chemistry-A European Journal,2014,20(4):1049-1056.
[35]陈瑞卿,尹大川,鹿芹芹,等.用于蛋白质结晶的分子改造技术[J].材料导报,2011,25(23):73-79.
[36]Wine Y,Cohen-Hadar N,Lamed R,et al.Modification of protein crystal packing by systematic mutations of surface residues:Implications on biotemplating and crysta l porosity[J].Biotech Bioeng,2009,104(3):444-457.
[37]Derewenda Z S.It's all in the crystals[J].Acta Crystallogr Section D -Biol Crystallogr,2011,67:243-248.
[38]Sledz P,Zheng H,Murzyn K,et al.New surface contact formed upon reductive lysine methylation:improving the probability of protein crystallization[J].Protein Sci,2010,19(7):1395-1404.
[39]张辰艳,尹大川,鹿芹芹,等.蛋白质结晶条件的筛选策略研究进展[J].材料导报,2010,24(5):22-28.
[40]Marc L,Pusey.Screening-just the facts[Z].12 th International Conference on the Crystall -ization of Biological Macromolecular,Mexico,2008.
[41]郭云珠,刘君,王燕,等.材料界面诱导蛋白质晶体异相形核的研究进展[J].材料导报,2010,24(23):13-17.
[42]鹿芹芹,尹大川,刘永明,等.提高蛋白质晶体质量的研究进展[J].材料导报,2010,24(1):104-110.
[43]Schartman R R.On the thermodynamics of cocrystal formation[J].Int J Pharm,2009,365(1-2):77-80.
[44]Wernimont A,Edwards A.In situ proteolysis to generate crystals for structure determination:an update[J].Plos One,2009,4(4):e5094.
[45]Bai Y,Auperin T C,Tong L.The use of in situ proteolysis in the crystallization of murine CstF-77[J].Acta Crystallographica Section F,2007,63(2):135-138.
[46]Collins M D,Kim C U,Gruner S M.Highpressure protein crystallography and NMR to explore protein conformations[J].Ann Rev Biophys,2011,40:81-98.
[47]Yoshihisa S Y.Modern aspects of bulk crystal and thin film preparation[M].Croatia:InTech,2012:439-462.

