细菌纤维素产生菌的筛选、鉴定及其产物分析
邓毛程,王 瑶,李 静,吴永辉,张远平
(1.广东轻工职业技术学院 食品与生物工程系,广东 广州 510300;2.广州倚德生物科技有限公司,广东 广州 510300;3.广州甘蔗糖业研究所,广东 广州 510316)
0 引言
细菌纤维素(Bacterial cellulose,简称BC)是由微生物(主要是细菌)合成的细胞外纤维素,在结晶度、化学纯度、抗张强度、弹性模量、吸水性和生物相容性等方面均优于植物纤维素,被认为是一种性能优异的新型天然生物纳米材料[1-2].近年来,细菌纤维素的研究成为当今微生物合成材料领域的热点之一,并在生物医药、组织工程支架材料、声学器材、食品、化妆品、造纸等领域展现出巨大的应用潜力[3-4].但是,自从1886 年英国科学家Brown[5]发现细菌纤维素以来,由于细菌纤维素生产一直处于发酵产率低、生产成本高的状况,使其应用受到很大的局限[6].为了提高细菌纤维素的发酵产率,笔者从自然发酵的椰子水中筛选、鉴定细菌纤维素高产菌株,并对其发酵产物进行分析,期望能够为细菌纤维素的研究和生产提供优良菌种.
1 材料与方法
1.1 材料与试剂
筛选材料:经自然发酵产膜的椰子水,采样于海南省;新鲜椰子水:成熟椰子破壳取水;DNA 提取试剂盒、16S rDNA 的扩增引物以及PCR 扩增试剂等:深圳华大基因科技服务公司;其他试剂均为市售.
1.2 仪器与设备
SPX-100B-Z 型生化培养箱:上海博讯实业有限公司医疗设备厂;TS-211C 型振荡培养箱:上海天呈实验仪器制造有限公司;SHZ-82A 型恒温水浴振荡器:江苏省太仓医疗器械厂;KDC-210HR 高速冷冻离心机:安徽中科中佳科学仪器有限公司;S-3000N 扫描电镜:日本日立公司;VERTEX70 傅立叶红外光谱仪:德国布鲁克公司.
1.3 平板分离
固体培养基:葡萄糖20 g/L,酵母膏10 g/L,KH2PO41 g/L,MgSO4·7H2O 0.2 g/L,琼脂20 g/L,新鲜椰子水50%(V/V),调节pH 至5.5,121 ℃灭菌20 min.按固体培养基配方制备平板,备用.在无菌条件下,将表面的菌膜从自然发酵椰子水中取出,剪取2 g 放入无菌试管中,加入10 mL 无菌水,置于涡旋振荡器上振荡5 min,再将悬液进行梯度稀释,涂布于平板培养基上,于30 ℃恒温培养72 h,观察菌落形态,然后挑取颗粒饱满的单个菌落,接入斜面培养基进行培养和保藏.
1.4 发酵筛选
液体培养基:葡萄糖50 g/L,酵母膏10 g/L,KH2PO41 g/L,MgSO4·7H2O 0.2 g/L,新鲜椰子水50%(V/V),调节pH 至5.5,121 ℃灭菌20 min.将液体培养基分装至250 mL 三角瓶中,每瓶装液100 mL,121 ℃灭菌20 min,冷却后,将挑取菌落的斜面菌种接入液体培养基,每瓶接入1 环,恒温30℃静置培养240 h,观察各菌株的产膜情况,并测定各瓶的细菌纤维素产量,根据测定结果优选出目标菌株.
1.5 菌种鉴定
采用革兰氏染色显微镜观察法和扫描电镜观察法[7]鉴定菌种形态特征;按照《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册》(第八版)的方法[8-9],鉴定菌种的生理生化特征;参照文献[10]的方法,对菌种的16S rDNA 进行鉴定.在16S rDNA鉴定过程中,采用1 对通用引物(5′-AGA GTT TGA TCC TGG CTC AG-3′和5′-AGA AAG GAG GTG ATC CAG CC-3′)对菌种的16S rDNA 进行扩增,PCR 产物送至深圳华大基因科技服务公司测序,然后在NCBI(http://blast.ncbi.nlm.nih.gov)中进行同源性检索,并采用MEGA5.1 软件以Neighborjoining 法构建系统发育树.
1.6 产物定性分析
用清水将目标菌株的凝胶膜状产物洗净,浸泡于0.1 mol/L 的NaOH 溶液中煮沸30 min,用蒸馏水漂洗至中性,再置于105 ℃下进行干燥.产物的初步定性分析采用蒽酮显色法[11],即称取干燥后的产物0.1 g,加入2~4 ℃60%硫酸溶液100 mL,于冰浴中消化2 h,然后在比色管中分别加入消化液4 mL 和2%蒽酮1 mL,观察显色结果.另外,产物特征官能团的分析采用傅里叶红外光谱(FTIR)法[12-13],即将干燥后的产物与KBr 混合,研磨成粉末,经压片,通过傅里叶红外光谱仪在4 000~400 cm-1区间内进行扫描,测定产物的红外吸收光谱,分析产物的官能团特征.
1.7 产物结构分析
参照文献[14]的扫描电镜法,利用扫描电镜观察产物的微结构.
1.8 细菌纤维素产量的测定
采用称重法[15]测定细菌纤维素的产量,即用清水将凝胶膜状产物洗干净,放入0.1 mol/L NaOH溶液中煮沸30 min,用蒸馏水漂洗至中性,于105℃的条件下干燥至恒重,然后准确称量干燥物的质量.
2 结果与讨论
2.1 菌种的筛选
从分离平板上挑取颗粒饱满的菌落52 个,经过发酵复筛试验,其中凝胶膜产量居于前9 位菌株的发酵结果如图1 所示.可以看出,这9 种菌株的细菌纤维素产量分布在4.52~10.80 g/L 的范围内,产量排序为:BC13>BC07>BC19>BC26>BC10>BC28>BC02>BC37>BC41.菌种BC13 的细菌纤维素产量最大,故被确定为进一步研究的优选菌种.

图1 9 种菌株的细菌纤维素产量
2.2 菌种形态与生理生化特性的鉴定
经革兰氏染色和显微镜观察,菌种BC13 呈阴性.如图2 和图3 所示,在透射电镜(×7 000)和扫描电镜(×10 000)下观察,菌体呈椭圆的杆状,大小为(0.4~0.6)μm ×(1.3~2.8)μm,周生鞭毛.菌种BC13 的生理生化特征试验结果见表1,根据《伯杰细菌鉴定手册》(第八版)和《常见细菌系统鉴定手册》的描述,初步鉴定菌种BC13 为醋杆菌属.

图2 菌种BC13 在透射电镜下的菌体形态(×7 000)

图3 菌种BC13 在扫描电镜下的菌体形态(×10 000)
2.3 菌种16S rDNA 的鉴定
菌种BC13 的16S rDNA 的PCR 扩增产物大小为1 453 bp,将此序列在NCBI 中进行Blast 比较后,发现菌种 BC13 与葡糖酸醋杆菌属(Gluconacetobacter)许多菌种的同源性达99%以上,与其同源性达到100%的葡糖酸醋杆菌有Gluconacetobacter xylinus 1-18(登录号:KF030731.1)和 Gluconacetobacter xylinus G7 -3(登录号:KF030791.1).如图4 所示,采用Neighbor-joining法构建系统发育树,也可以发现菌种BC13 与Gluconacetobacter xylinus 1-18 的亲缘关系最接近.将菌种BC13 的形态、生理生化等特征与16S rDNA鉴定结果结合起来,可最终确定菌种BC13 为木葡糖酸醋杆菌(Gluconacetobacter xylinus).

表1 生理生化试验结果

图4 菌种BC13 序列系统发育分析
2.4 产物的定性分析
菌种BC13 的凝胶膜状产物在0.1 mol/L 的NaOH 溶液中煮沸30 min,没有发生溶解;其干燥物经60%硫酸消化和蒽酮试剂显色,呈绿色,这与蒽酮显色法鉴定纤维素的原理吻合,可以初步判断凝胶膜状产物的主要成分为纤维素.发酵产物的红外光谱见图5.由图5 可见,3 584 cm-1处的吸收峰是由O—H 伸缩振动所致,2 896 cm-1处的吸收峰是大分子中C—H 伸缩振动所致,1 664 cm-1处的吸收峰是由纤维素4′端的半缩醛基的伸缩振动所致,1 555 cm-1、1 427 cm-1和1 336 cm-1处的吸收谱带是C—H 的弯曲振动所产生,1 205 cm-1和1 061 cm-1处的吸收谱带是由C—O 的伸缩振动所产生.图5 表明,发酵产物可能含有与纤维素结构相符合的基团,其红外光谱的特征与相关文献中细菌纤维素的红外光谱基本一致[1,6,16],因而可进一步推断发酵产物是细菌纤维素.
2.5 产物的结构分析
在扫描电镜(×8 000)下观察产物的超微结构如图6 所示.由于经过碱水煮沸处理,几乎没有发现菌体残留在产物中.产物呈现出由微纤维相互缠绕形成的致密网状结构,纤维丝直径不足100 nm.图6 的超微结构与相关文献中细菌纤维素的扫描电镜照片[6,17]十分相似.
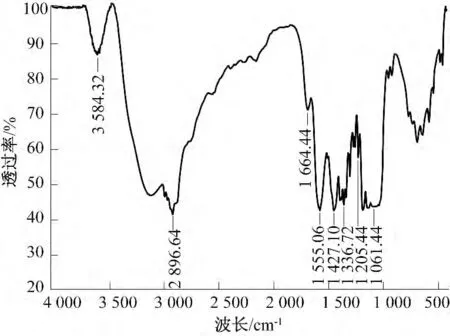
图5 菌种BC13 产物的傅里叶红外光谱
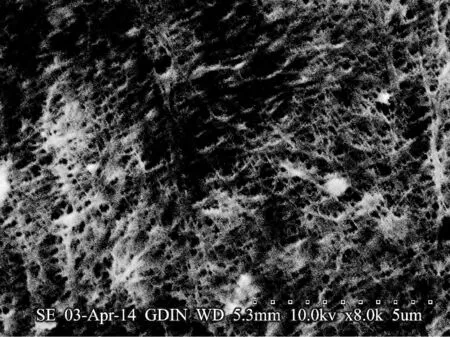
图6 菌种BC13 产物的超微结构
3 结论
以自然发酵的椰子水为筛选材料,采用平板分离、静态发酵等方法筛选获得细菌纤维素产量为10.8 g/L 的菌株BC13.经过形态特征、生理生化特征以及16S rDNA 等方面的分析,鉴定菌株BC13为木醋杆菌.采用蒽酮显色法、红外光谱法对菌株BC13 的发酵产物进行定性分析,同时采用扫描电镜对其超微结构进行观察,可推断菌株BC13 的发酵产物为细菌纤维素.菌株BC13 产纤维素能力较高,是一株具有应用潜力的菌株,为了使其更好地应用于细菌纤维素的研究和生产,其发酵工艺仍需进一步优化.
[1]谭玉静,洪枫.细菌纤维素的静态发酵及物理性质研究[J].纤维素科学与技术,2007,15(4):1-8.
[2]Wang Yan,Luo Qingping,Peng Bihui,et al.A novel thermotropic liquid crystalline:Benzoylated bacterial cellulo se [J].Carbohydrate Polymers,2008,74(4):875-879.
[3]陆胜民,贾静静,杨颖.细菌纤维素发酵工艺与应用研究进展[J].食品与发酵科技,2011,47(1):27-31.
[4]Jae Yong Jung,Taous Khan,Joong Kon Park,et al.Production of bacterial cellulose by Gluconacetobacter hansenii using a novel bioreactor equipped with a spin filter[J].Korean Journal of Chemical Engineering,2007,24(2):265-271.
[5]Brown A J.XLIII.-On an acetic ferment which forms cellulose[J].Journal of the Chemical Society,Transactions,1886,49:432-439.
[6]施庆珊,冯静,冯劲,等.产细菌纤维素Axy-I 菌株的鉴定及产物分析[J].生物技术,2010,20(4):55-58.
[7]诸葛健.工业微生物实验与研究技术[M].北京:科学出版社,2007.
[8]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[9]R.E 布坎南,N.E.吉本斯.伯杰细菌鉴定手册[M].中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组,译.8 版.北京:科学出版社,1984.
[10]魏长庆,王海庆,张凌,等.葡萄果醋发酵用醋酸菌的分离及鉴定[J].中国酿造,2010,29(4):42-44.
[11]吴瑛,刘天志,袁守亮.和田玫瑰残渣纤维素及蛋白质含量分析[J].江苏农业科学,2011,39(5):430-431.
[12]Mazhar Ul-Islam,Jung Hwan Ha,Taous Khan,et al.Effects of glucuronic acid oligomers on the production,structure and properties of bacterial cellulose [J].Carbohydrate Polymers,2013,92:360-366.
[13]Bhavna V Mohite,Satish V Patil.Physical,structural,mechanical and thermal characterization of bacterial cellulose by G.hansenii NCIM 2529[J].Carbohydrate Polymers,2014,106:132-141.
[14]Yang Ying,Jia Jingjing,Xing Jianrong,et al.Isolation and characteristics analysis of a novel high bacterial cellulose producing strain Gluconacetobacter intermedius CIs26[J].Carbohydrate Polymers,2013,92:2012-2017.
[15]邓毛程,吴亚丽,梁世中.超声波促进高纤椰果发酵的研究[J].食品与发酵工业,2008,34(3):62-64.
[16]关晓辉,尹宗杰,鲁敏,等.细菌纤维素发酵条件的优化及结构分析[J].中国酿造,2010,223(10):68-71.
[17]李静,朱平.木醋杆菌发酵生产细菌纤维素的研究[J].合成纤维,2008(6):28-31.

