N-[1-(1-金刚烷基)-乙基]-2-苯氧基乙酰胺化合物的合成
黄丽丽, 刘 丹, 张凤军, 孙 卓, 辛建创, 王洪媛
(1.沈阳化工大学 制药与生物工程学院, 辽宁 沈阳 100142; 2.鞍山腾鳌污水处理有限公司, 辽宁 鞍山 114225)
病毒性流行性感冒位于传染性疾病之首,据世界卫生组织统计,全球每年约有50万人死于流感[1].金刚烷胺是最早上市的M2离子通道蛋白抑制剂,通过干扰M2离子通道活性,抑制流感病毒脱壳而抑制病毒复制.金刚乙胺为金刚烷胺的结构类似物,该药由美国Bristol-Myers Squibb公司研发,同属M2离子通道蛋白抑制剂.与金刚烷胺比较,金刚乙胺具有副作用小[2]、抗流感病毒疗效强的优势[3].同时,该药的使用成本远低于神经氨酸酶抑制剂,是目前较经济的抗流感病毒药物.对广谱的RNA病毒,如圣路易脑炎病毒、呼吸道合胞病毒、副流感病毒、HIV病毒、冠状病毒等均具有明显的抗病毒活性[4-6].但金刚烷胺和金刚乙胺均对B型流感病毒无效,长期服用易产生耐药性[7-8].
文献报道金刚烷胺和金刚乙胺的某些类似生物也具有一定的抗流感病毒活性,如George Stamatiou等[9]以金刚烷醇和2-吡咯烷酮为原料合成了化合物1a、1b、1c(图1),抗H2N2流感病毒活性比金刚烷胺高2~7倍(1a、1b、1c及金刚烷胺对H2N2病毒的MIC50分别为0.60 μmol/L,0.38 μmol/L、1.7 μmol/L和2.6 μmol/L);George Stamatiou等[10]合成2-(1-金刚烷基)吡咯烷化合物2a、2b,抗H2N2病毒活性(EC50分别为2.1 μmol/L、3.3 μmol/L)分别是金刚烷胺(EC50为45 μmol/L)的21倍和14倍,是金刚乙胺(EC50为13.9 μmol/L)的6倍和4倍.以金刚烷胺为先导化合物合成的曲金刚胺也具有抗病毒活性[11].
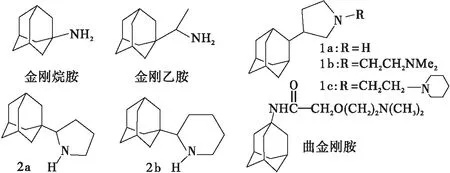
图1 金刚烷胺、金刚乙胺及其结构类似物
基于以上研究成果,对金刚乙胺的结构做进一步修饰,在其氨基上引入α-氯代乙酰基,再与取代苯酚反应,合成4个新的金刚乙胺衍生物,以期发现一类高效、低毒的抗流感病毒药物.目标化合物合成方法如下:

1 实验部分
1.1 仪器与试剂
化合物熔点在Buchi-450熔点仪上测定;红外光谱在Thereto Nicolet 470FT红外光谱仪上测定(KBr压片);质谱在Thermo-Finnigan LCQ 质谱仪上测定;核磁共振氢谱在Bruker ARX-500型核磁共振分析仪上测定.薄层色谱采用硅胶GF254,柱色谱用200~300目硅胶(硅胶由青岛海洋化工厂生产);所有试剂均为分析纯或化学纯.
1.2 中间体的合成
1.2.1α-氯乙酰氯的制备
在安置干燥管的三颈瓶中加入氯乙酸(4.989 g,52.79 mmol)、40 mL二氯甲烷,搅拌,室温下滴加5 mL草酰氯,安装尾气吸收装置.待无气泡产生,停止反应,常压蒸除二氯甲烷和过量的草酰氯,得到淡黄色α-氯乙酰氯,备用.
1.2.2 N-[1-(1-金刚烷基)-乙基]-2-氯乙酰胺的制备
将金刚乙胺(1.809 g,10.98 mmol)、10 %NaOH溶液(13 mL),加入安置温度计的三颈瓶中,搅拌.将制备的α-氯乙酰氯用20 mL二氯甲烷稀释,于5 ℃缓慢滴入上述体系,待反应液澄清,停止反应.分出有机相,水洗3次,每次用10 mL水,有机相无水硫酸镁干燥,滤去干燥剂,蒸除二氯甲烷,得乳白色固体2.148 1 g,硅胶柱提纯,洗脱剂为V(石油醚)∶V(乙酸乙酯)=10∶1,得白色针状晶体N-[1-(1-金刚烷基)-乙基]-2-氯乙酰胺(1.820 3 g,收率65.21 %).1H NMR(500 MHz,CDCl3):δ7.26(s,1H,CH2CONH),δ4.07(m,2H,ClCH2CO),δ3.74(m,1H,CH3CHNH).
1.3 目标化合物的合成
1.3.1 N-[1-(1-金刚烷基)-乙基]-2-苯氧乙酰胺(Ⅰ)的制备
将苯酚(0.111 2 g,1.18 mmol)、无水K2CO3(0.113 g,0.82 mmol)、DMF(7 mL)加入安置温度计的三颈瓶中,安装冷凝装置,逐渐升温至75 ℃,将溶于3 mL DMF的N-[1-(1-金刚烷基)-乙基]-2-氯乙酰胺(0.150 3 g,0.59 mmol)缓慢滴入反应体系,逐渐升温到80 ℃,保温搅拌,反应约4 h;减压蒸除DMF,加入质量分数为2 %的NaOH(20 mL)搅拌,抽滤,得白色固体0.165 1 g,硅胶柱提纯,洗脱剂为V(石油醚)∶V(乙酸乙酯)=4∶1,得白色固体Ⅰ(0.147 8 g,收率80 %).mp:95~98 ℃,1H NMR(500 MHz,CDCl3):δ6.38(s,1H,CH2CONH),δ7.29(dd,J=12 Hz,2H,Ph-3,5-H),δ7.01(t,J=3 Hz,1H,Ph-4-H),δ6.93(d,J=6 Hz,2H,Ph-2,6-H),δ4.50(s,2H,OCH2CO),δ3.74(m,1H,CH3CHNH).
1.3.2 N-[1-(1-金刚烷基)-乙基]-2-(4-氯苯氧)乙酰胺(Ⅱ)的制备
将对氯苯酚(0.152 g,1.18 mmol)、无水K2CO3(0.113 g,0.82 mmol)、DMF(7 mL),加入安置温度计的三颈瓶中,安装冷凝装置,逐渐升温至70 ℃;将溶于3 mL DMF的N-[1-(1-金刚烷基)-乙基]-2-氯乙酰胺(0.15 g,0.59 mmol)滴入反应体系,升高温度到80 ℃,保温搅拌,反应约4.5 h;减压蒸除DMF,得黄色油状物,加入质量分数为2 %的NaOH(20 mL)搅拌,抽滤,得乳白色固体0.124 g,硅胶柱提纯,洗脱剂为V(石油醚)∶V(乙酸乙酯)=5∶1,得白色固体Ⅱ(0.113 6 g,收率55.49 %).mp:131~135 ℃,1H NMR(500 MHz,CDCl3):δ6.30(s,1H,CH2CONH),δ7.35(d,J=6 Hz,2H,Ph-3,5-H),δ6.86(d,J=6 Hz,2H,Ph-2,6-H),δ4.46(s,2H,OCH2CO),δ3.74(m,1H,CH3CHNH).
1.3.3 N-[1-(1-金刚烷基)-乙基]-2-(4-硝基苯氧)乙酰胺(Ⅲ)的制备
将对硝基苯酚(0.165 g,1.18 mmol)、无水K2CO3(0.113 g,0.82 mmol)、DMF(7 mL),加入安置温度计的三颈瓶中,安装冷凝装置,逐渐升温至75 ℃,将溶于3 mL DMF的N-[1-(1-金刚烷基)-乙基]-2-氯乙酰胺(0.15 g,0.59 mmol)滴入反应体系,升高温度到85 ℃,保温搅拌,反应约4 h;减压蒸除DMF,加入质量分数为2 %的NaOH(20 mL)搅拌,抽滤,得黄色固体0.131 7 g,硅胶柱提纯,洗脱剂为V(石油醚)∶V(乙酸乙酯)=2.5∶1,得淡黄色固体Ⅲ(0.123 6 g,收率58.48 %).mp:178~182 ℃,1H NMR(500 MHz,CDCl3):δ6.24(s,1H,CH2CONH),δ8.23(d,J=9 Hz,2H,Ph-3,5-H),δ7.24(d,J=6 Hz,2H,Ph-2,6-H),δ4.58(s,2H,OCH2CO),δ3.77(m,1H,CH3CHNH).
1.3.4 N-[1-(1-金刚烷基)-乙基]-2-(4-乙酰氨基苯氧)乙酰胺(Ⅳ)的制备
将对乙酰氨基酚(0.179 g,1.18 mmol)、无水K2CO3(0.113 g,0.82 mmol)、DMF(7 mL),加入安置温度计的三颈瓶中,安装冷凝装置,逐渐升温至80 ℃,将溶于3 mLDMF的N-[1-(1-金刚烷基)-乙基]-2-氯乙酰胺(0.15 g,0.59 mmol)滴入反应体系,升高温度到85 ℃,保温搅拌,反应约2 h;减压蒸除DMF,得淡黄色固体,加入质量分数为2 %的NaOH(20 mL)搅拌,抽滤,得乳白色固体0.141 6 g,硅胶柱提纯,洗脱剂为V(氯仿)∶V(甲醇)=16∶1,得白色固体Ⅳ(0.132 2 g,收率60.53 %).mp:198~202 ℃.1H NMR(500 MHz,CDCl3):δ6.38(s,1H,CH2CONH),δ7.24(s,1H,CH3CONHAr),δ7.43(d,J=6 Hz,2H,Ph-3,5-H),δ6.88(d,J=9 Hz,2H,Ph-2,6-H),δ4.45(s,2H,ArOCH2CO),δ3.74(m,1H,CH3CHNH),δ2.14(s,3H,CH3CONHAr).
2 结果与讨论
苯酚类与N-金刚烷基-2-氯乙酰胺的反应,以无水碳酸钾为缚酸剂,酚羟基上的氢被脱去后,酚氧负离子再对N-金刚烷基-2-氯乙酰胺进行亲核进攻,其中对乙酰氨基酚反应时间最短,只需2 h,对氯苯酚和对硝基酚反应时间最长,为4~4.5 h.这是由于乙酰氨基为供电子基,使氧原子上电子云密度增加,亲核反应活性增强;氯和硝基为吸电子基,使氧原子上电子云密度减小,亲核反应活性降低.亲核反应活性顺序:对乙酰氨基酚>苯酚>对氯苯酚≈对硝基酚.
3 结 论
以金刚乙胺、氯乙酸和苯酚类化合物为起始原料,经过3步反应合成了4个N-[1-(1-金刚烷基)-乙基]-2-(4-取代苯氧)乙酰胺类化合物,且均未见文献报道.反应容易进行,条件温和,收率较高.
参考文献:
[1] 门玉环,王立伟.流行性感冒的防治与护理[J].临床肺科杂志,2003,8(3):285.
[2] Keyser L A,Karl M,Nafziger A N,et al.Comparison of Central Nervous System Adverse Events of Amantadine and Rimantadine Used as Sequential Prophylaxis of Infl-uenza a in Elderly Nursing Home Patients[J].Arch In-tern Med,2000,160:1485.
[3] Woods J M,Bethell R C,Coates J A,et al .4-guanidi-no-2,4-dideoxy-2,3-dehydro-N-acetylneu-raminic Acid is a Highly Effective Inhibitor both of the Sialidase and of Growth of a Wide Range of Influenza A and B Viruses in Vitro[J].Anti Agents and Chem,1993,37(7):1473.
[4] Burstein M E,Serbin A V,Khakhulina T V,et al.Inhibition of HIV-1 Replication by Newly Developed Adamantine-containing Polyanionic Agents[J].Antiviral Research,1999,41:135-144.
[5] Chen F.In Vitro Susceptibility of 10 Clinical Isolates of SARS Coronavirus to Selected Antiviral Compounds[J].J Clin Virol,2004,31(1):69.
[6] Zlydnikov D M.Study of Rimantadine in the USSR:A Review of the Literature[J].Reviews of Infections Diseases,1981,3(3):408.
[7] 殷璐,蒋建东.抗流感病毒药物研究进展[J].中国新药杂志,2004,13(8):685-687.
[8] 张强,赵庆杰,熊瑞生,等.抗流感病毒药物研究进展[J].药学学报,2010,45(3):289-299.
[9] Setaki D,Tataridis D,Stamatiou G,et al.Synthesis,Conformational Characteristics and Anti-influenza Virus A Activity of Some 2-adamantylsubstituted Azacycles[J].Bioorganic Chemistry,2006,34(5):248-273.
[10] Stamatiou G,Foscolos G B,Fytas G,et al.Heterocyclic Rimantadine Analogues with Antiviral Activity[J].Bioorganic & Medicinal Chemistry,2003,11(24):5485-5492.
[11] 谢勇,翁玲玲.抗病毒药曲金刚胺及其类似物的合成[J].华西药学杂志,2005,20(4):310-311.

