盐酸二氧丙嗪与牛血清白蛋白结合性质研究
吴晓侠,王永霞,何玲玲
(沈阳化工大学 应用化学学院, 辽宁 沈阳 110142)
血清白蛋白是血浆中主要蛋白之一,具有结合和运输内源及外源性物质的作用[1].药物进入人体后,以游离态存在的药物分子可透过生物膜转运、奏效或消除;与血清白蛋白结合的部分则形成大分子物质不能透过生物膜达到治疗病痛目的,因而变成无效的药物分子,但这种结合是可逆的,可重新释放出有活性的药物分子使其成为游离态.所以研究药物分子与血清白蛋白的相互作用对于阐明药物在体内的运输和代谢过程、药物动力学以及药物所具有的毒性具有非常重要的意义[2].牛血清白蛋白(Bovine serum albumin ,BSA),是牛血清中的一种球蛋白,与人血清白蛋白在结构上有高度的相似性,且BSA更廉价易得,因而它成为研究高分子蛋白质理化性质、生物学功能的理想蛋白质.盐酸二氧丙嗪(Dioxopromethaine Hydrochloride,DPZ),化学名称为10-(2-二甲氨基-异丙基) 吩噻嗪-5,5-二氧化物盐酸盐.它具有镇咳平喘、祛痰、抗胆胺和局麻作用,也适用于治疗荨麻疹及皮肤瘙痒等[3].本文通过荧光光谱、紫外吸收光谱及圆二色光谱法研究了DPZ与BSA之间的相互作用.
1 实验部分
1.1 仪器与试剂
F-7000荧光光谱仪:日本Hitachi公司;UV-2500紫外-可见分光光度计:日本Shimadzu公司;MOS-450圆二色光谱仪:法国Bio-logic公司;SC-15超级恒温槽:上海比朗仪器有限公司;AL204分析天平:上海梅特勒-托利多仪器有限公司;pHS-25酸度计:上海雷磁仪器厂.
BSA:美国Amresco公司;Trish-HCl缓冲溶液:pH=7.4,含0.05 mol/L NaCl 维持溶液的离子浓度;DPZ:辽宁省东港市宏达制药有限公司;布洛芬:萨恩化学技术(上海)有限公司;酮基布洛芬:萨恩化学技术(上海)有限公司.
1.2 实验方法
1.2.1 溶液的配制
BSA用Trish-HCl缓冲溶液配制成0.1 μm/L的储备液,放入冰箱4 ℃下保存.DPZ用Tris-HCl缓冲溶液配制成1.255×10-3mol/L的储备液.布洛芬和酮基布洛芬溶液配制时,首先用少量乙醇溶解,再用Tris-HCl缓冲溶液均配制成2.51 mmol/L的结合位点标记物溶液.
1.2.2 荧光光谱的测定
准确移取2.5 mL BSA溶液于1 cm×1 cm石英比色皿中,固定激发波长280 nm,激发与发射的狭缝宽度均为5 nm,扫描范围290~500 nm,测其发射光谱,然后再用微量进样器逐次加入不同体积的DPZ溶液,再次进行测定.同样的方法测定位点标记物存在下,DPZ与BSA相互作用的荧光光谱.在这里由于DPZ在280 nm激发波长下有吸收,因此在研究中需考虑内滤光效应.采用公式(1)[4]对内滤光进行校正,计算中所用的荧光强度值均为校正后的荧光值.
Fcor=Fbor×e(Aex+Aem)/2
(1)
其中:Fcor为校正后的荧光强度;Fbor为测量到的荧光强度;Aex为溶液在激发波长处的吸收值;Aem为溶液在发射波长处的吸收值.
1.2.3 同步荧光光谱的测定
准确移取2.5 mL BSA溶液于1 cm×1 cm石英比色皿中,在Δλ=15 nm和Δλ=60 nm处分别扫描其同步荧光光谱,然后用微量进样器逐次加入不同体积DPZ溶液再次进行扫描.
1.2.4 紫外-可见吸收光谱的测定
准确移取2.5 mL BSA溶液于1 cm×1 cm石英比色皿中,扫描范围200~500 nm,光谱带宽1.0 nm,扫描其吸收光谱,然后用微量进样器加入不同体积DPZ溶液,再次进行扫描测定.
1.2.5 圆二色光谱的测定
准确移取2.5 mL BSA溶液于1 cm×0.5 cm的石英比色皿中,扫描范围200~300 nm,光谱带宽1.0 nm,扫描速度100 nm/s,进行扫描.在同样的条件下再次扫描DPZ存在下BSA的圆二色光谱.
2 结果与讨论
2.1 DPZ对BSA的荧光猝灭光谱
BSA分子因含色氨酸和酪氨酸等残基而成为内源性荧光物质.图1为BSA与不同浓度的DPZ相互作用的荧光光谱图.从图1可以看出:随DPZ浓度的增加,BSA的荧光强度有规律地降低,说明DPZ对BSA的荧光有猝灭作用.


c(BSA)=0.10 μmol·L-15 c(DPZ)=0.20 μmol·L-11 c(DPZ)=0.00 μmol·L-16 c(DPZ)=0.25 μmol·L-12 c(DPZ)=0.05 μmol·L-17 c(DPZ)=0.30 μmol·L-13 c(DPZ)=0.10 μmol·L-18 c(DPZ)=0.35 μmol·L-14 c(DPZ)=0.15 μmol·L-19 c(DPZ)=0.40 μmol·L-1
图1 DPZ与BSA相互作用的荧光猝灭光谱
Fig.1 Fluorescence quenching spectra of BSA in the presence of different concentrations of DPZ
2.2 荧光猝灭机理
引起荧光猝灭的原因通常有动态猝灭和静态猝灭[5].动态猝灭是猝灭体和荧光物质间的能量转移或电子转移过程;静态猝灭是由于猝灭体和荧光物质相互作用,形成不发光的配合物.一般情况下,荧光猝灭机理可根据不同温度下的猝灭特征加以区分,动态猝灭的猝灭常数会随温度的升高而升高,对于静态猝灭则恰好与其相反.动态猝灭过程符合Stern-Volmer方程[6]:
F0/F=1+Kqτ0cQ=1+KSVcQ
(2)
其中:F0为猝灭剂不存在时的荧光强度;F为加入猝灭剂后的荧光强度;KSV为Stern-Volmer猝灭常数;cQ为猝灭剂的物质的量浓度;Kq为双分子猝灭过程的速率常数;τ0为猝灭剂不存在时荧光体分子的平均寿命,BSA的τ0为6.2 ns.
实验分别绘制289、296、303和310 K温度下BSA-DPZ体系的Stern-Volmer曲线(见图2).对曲线进行直线拟合,由直线斜率可以得到不同温度下的猝灭常数(见表1).随温度的升高猝灭常数KSV降低,说明引起BSA荧光猝灭的原因不是动态猝灭而是静态猝灭,并且从表1中还可以看出双分子猝灭速率常数Kq远大于最大动态猝灭速率常数2.0×1010L·mol-1·s-1[7],进一步说明DPZ对BSA的荧光猝灭是静态猝灭.

表1 不同温度下DPZ对BSA荧光猝灭的Stern-Volmer猝灭常数和猝灭速率常数

图2 不同温度下DPZ-BSA的Stern-Volmer曲线
2.3 DPZ与BSA的表观结合常数Ka、结合位点数n
DPZ对BSA的荧光猝灭为静态猝灭,即DPZ与BSA相互作用形成基态复合物.假设BSA与DPZ有n个相同且独立的结合位点,可用公式(3)来求算结合常数Ka和n.
log[(F0-F)/F]=logKa+nlogcQ
(3)
其中:Ka为结合常数;n为结合位点数;cQ为猝灭剂DPZ的浓度.
以log[(F0-F)/F]对logcQ作图(见图3)可得一条直线,由直线的斜率和截距可求得不同温度下DPZ对BSA的结合常数Ka和结合位点数n(见表2).由表2数据可知:不同温度下的n值均接近于1,表明DPZ与BSA有1个结合位点,即形成摩尔比为1∶1的配合物;Ka随温度的升高而降低,则说明两者的结合过程为静态猝灭过程,且形成的基态复合物的稳定性随温度的升高而降低.
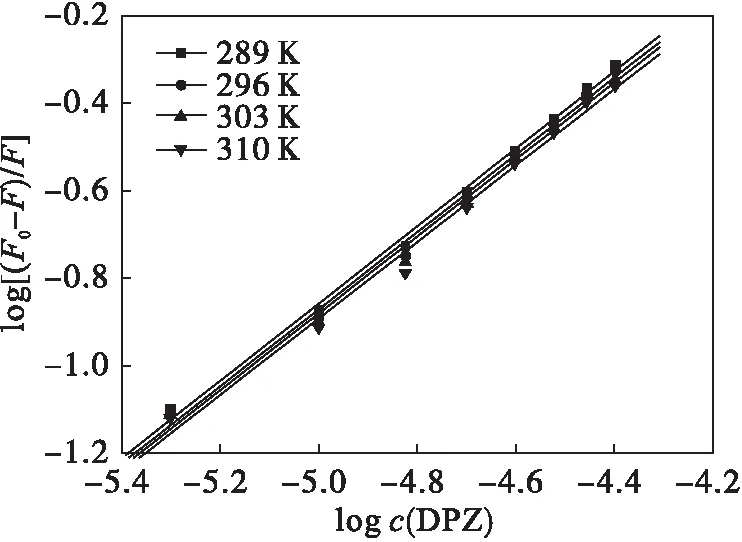
图3 不同温度下DPZ与BSA相互作用的双对数曲线
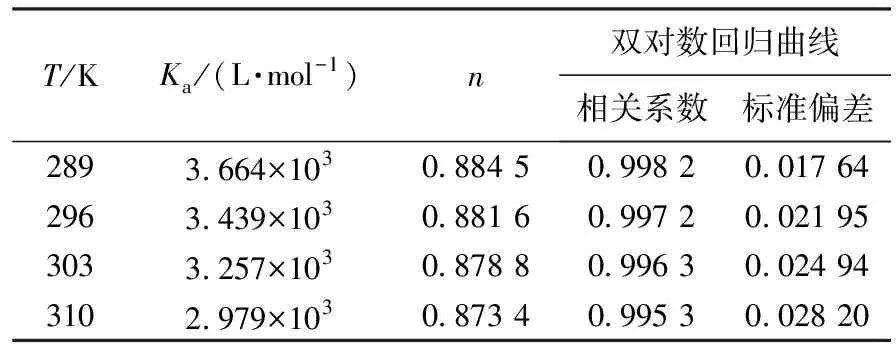
T/KKa/(L·mol-1)n双对数回归曲线相关系数标准偏差2893.664×1030.884 50.998 20.017 642963.439×1030.881 60.997 20.021 953033.257×1030.878 80.996 30.024 943102.979×1030.873 40.995 30.028 20
2.4 DPZ与BSA之间作用力类型的确定
氢键、范德华力、静电引力和疏水作用力是分子间相互作用的主要作用力类型.Ross[8]等根据大量实验结果总结出判断小分子猝灭体与蛋白质等生物大分子之间的结合性质的热力学规律(见表3).当温度变化范围不大时,可把焓变ΔH看成是一个不随温度变化的常数,由不同温度下的结合常数Ka,根据下列方程可求得焓变ΔH、熵变ΔS和吉布斯自由能ΔG.
(4)
ΔG=-RTlnKa=ΔH-TΔS
(5)
其中:R为气体常数;T为实验温度;Ka为相应温度时的结合常数.

表3 热力学函数与作用力类型的关系
DPZ与BSA相互作用的热力学参数可以根据方程(4)和(5)并以lnKa对1/T作图(见图4)求得(见表4).从表4可以看出ΔG<0,表明DPZ与BSA相互作用的过程为自发进行;ΔS>0,ΔH<0表明使DPZ与BSA结合的相互作用力为疏水作用力和静电引力.
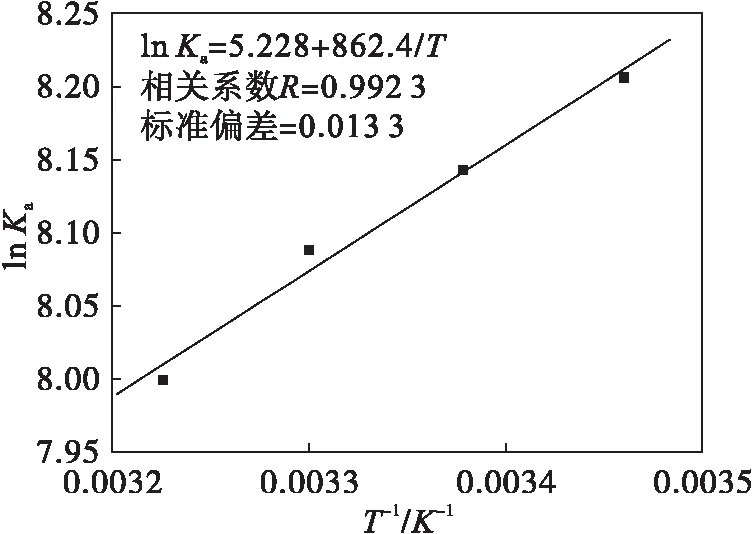
图4 DPZ与BSA相互作用的van’t Hoff 曲线

T/KΔH/(kJ·mol-1)ΔS/(J·mol-1·K-1)ΔG/(kJ·mol-1)289-19.72296-7.17043.47-20.04303-20.38310-20.62
2.5 DPZ与BSA之间的结合距离
根据Förster的偶极-偶极无辐射能量转移理论[4],要使两种化合物间发生非辐射能量转移,则必须满足3个条件:(1)能量给体发荧光;(2)能量给体的荧光发射与能量受体的吸收光谱有足够的重叠;(3)能量给体与能量受体足够接近,最大距离不超过7 nm.实验测出了DPZ的吸收光谱与BSA的荧光光谱,发现两光谱之间有一定的重叠,如图5所示.
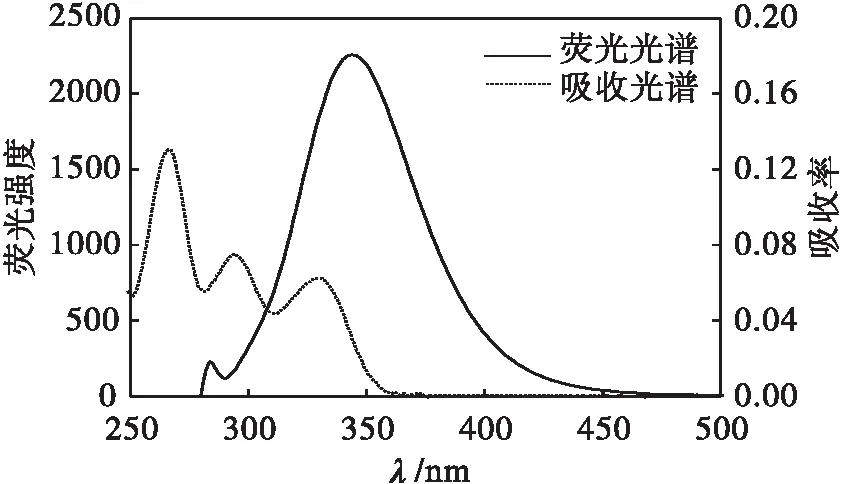
c(BSA)=c(DPZ)=0.1 μmol·L-1
根据能量转移理论,能量转移效率E与能量给体和受体间的结合距离r及转移效率为50 %时的临界能量转移距离R0有如下关系:
(6)
(7)
(8)
其中:K2为偶极空间取向因子;N为介质的折射指数;ΦD为能量给体的荧光量子产率;J为能量给体的荧光发射光谱与能量受体的吸收光谱间的光谱重叠积分;F(λ)为能量给体在波长λ处的荧光强度;ε(λ)为能量受体在波长λ处的摩尔吸光系数.
将图5的重叠光谱分割成小矩形,并利用公式(8)可求出重叠积分J=5.094×10-15cm3·L·mol-1,再由公式(6)和(7)可求得临界距离R0=2.254 nm,能量转移效率E=0.1160,进而求得结合距离r=3.161 nm.r<7 nm,表明BSA与DPZ之间能发生非辐射能量转移,但r大于转移效率为50 %时的临界距离R0,说明非辐射能量转移引起荧光猝灭的概率比静态猝灭要小[9].
2.6 DPZ与BSA相互作用的结合位点的确定
结合位点可以利用小分子猝灭体与位点标记物进行竞争结合的实验来确定.以酮基布洛芬和布洛芬作为siteⅠ和siteⅡ的位点标记物,固定BSA的浓度,分别作3组对比实验,并利用公式(2)对3组荧光数据进行处理(见图6),通过计算得到酮基布洛芬和布洛芬存在下DPZ与BSA的结合常数Ka和结合位点数n(见表5).由表5可知:布洛芬的存在对DPZ与BSA的Ka和n几乎没有影响,而在酮基布洛芬存在下Ka和n显著降低,表明酮基布洛芬占据了DPZ与BSA的结合位点,说明siteⅠ为DPZ在BSA上的结合位点.
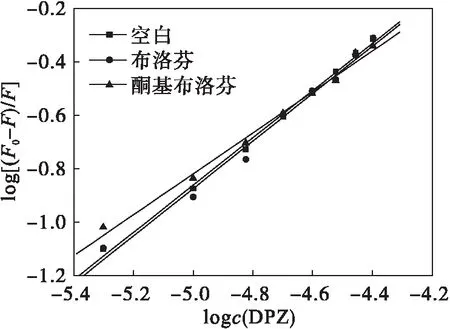
图6 结合位点标记物存在条件下DPZ与BSA相互作用的Lineweaver-Burk曲线
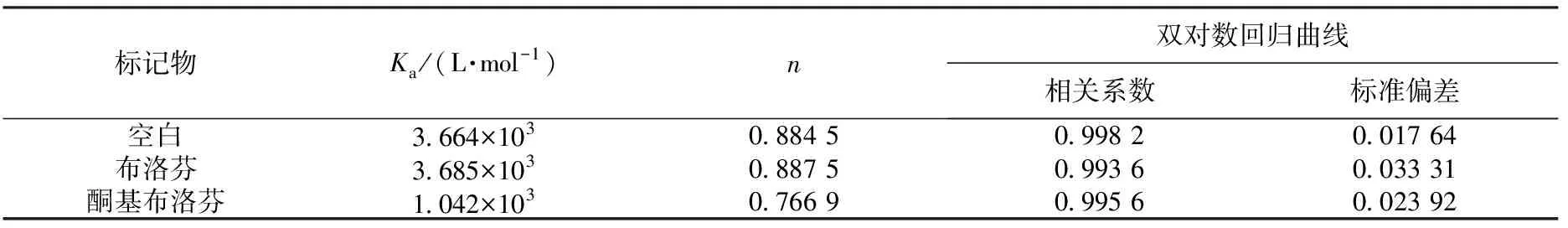
标记物Ka/(L·mol-1)n双对数回归曲线相关系数标准偏差空白3.664×1030.884 50.998 20.017 64布洛芬3.685×1030.887 50.993 60.033 31酮基布洛芬1.042×1030.766 90.995 60.023 92
2.7 DPZ对BSA构象的影响
2.7.1 同步荧光光谱
利用蛋白质的同步荧光光谱可以了解小分子猝灭体对蛋白质构象的影响,红移表明蛋白质所处环境的疏水结构有所瓦解,极性在增强,而蓝移则恰恰相反[10].固定激发波长和发射波长的间距Δλ,Δλ=15 nm为蛋白质中酪氨酸残基的荧光,Δλ=60 nm则是色氨酸残基的荧光.图7为DPZ存在下BSA的同步荧光光谱.



c(BSA)=0.10 μmol·L-15 c(DPZ)=0.20 μmol·L-11 c(DPZ)=0.00 μmol·L-16 c(DPZ)=0.25 μmol·L-12 c(DPZ)=0.05 μmol·L-17 c(DPZ)=0.30 μmol·L-13 c(DPZ)=0.10 μmol·L-18 c(DPZ)=0.35 μmol·L-14 c(DPZ)=0.15 μmol·L-19 c(DPZ)=0.40 μmol·L-1
图7 含不同浓度DPZ的BSA溶液的同步荧光光谱
Fig.7 Synchronous fluorescence spectra of BSA in the presence of different concentrations of DPZ
由图7可见:随着DPZ浓度的不断增加BSA的荧光强度有规律地降低,Δλ=15 nm时酪氨酸残基的最大发射波长没有改变,而Δλ=60 nm时色氨酸残基的最大发射波长由281 nm红移至284 nm,说明随DPZ的不断加入,色氨酸残基所处环境的极性增强,使色氨酸残基更多的暴露于所处的溶剂中.上述同步荧光表明DPZ的加入使BSA的构象发生了改变.
2.7.2 紫外-可见吸收光谱
紫外-可见吸收光谱也是证实蛋白质构象发生变化的一种简单有效的方法.蛋白质在220和278 nm处有两处紫外吸收峰,当蛋白质生色基团所处的环境发生改变时,紫外吸收光谱也会随之改变.图8为DPZ与BSA相互作用的吸收光谱.
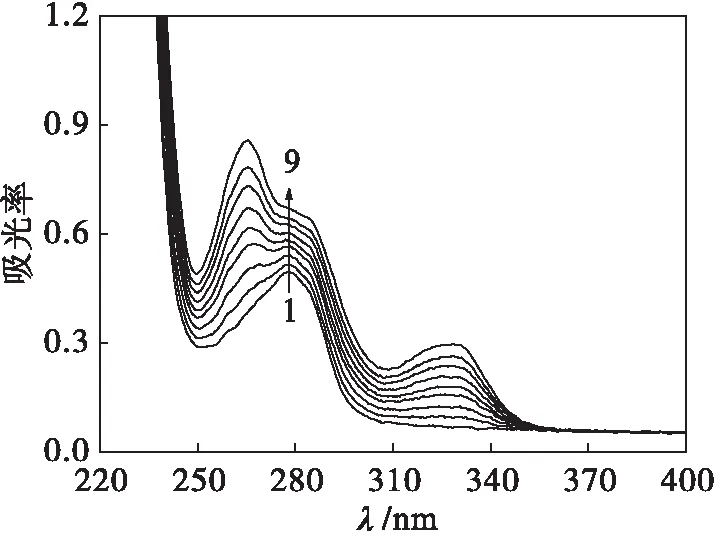

c(BSA)=0.10 μmol·L-15 c(DPZ)=0.20 μmol·L-11 c(DPZ)=0.00 μmol·L-16 c(DPZ)=0.25 μmol·L-12 c(DPZ)=0.05 μmol·L-17 c(DPZ)=0.30 μmol·L-13 c(DPZ)=0.10 μmol·L-18 c(DPZ)=0.35 μmol·L-14 c(DPZ)=0.15 μmol·L-19 c(DPZ)=0.40 μmol·L-1
图8 DPZ与BSA相互作用的吸收光谱
Fig.8 Absorption spectra of BSA in the presence of different concentrations of DPZ
由图8可见:BSA在279 nm处有一特征吸收峰,随DPZ的加入,其吸收峰呈明显的增色效应,且发生红移.该现象说明DPZ与BSA发生了相互作用,使BSA分子的肽链伸展,包围在BSA分子内部氨基酸残基的芳杂环疏水基团裸露出来,从而使279 nm处的吸收峰的吸收增强,同时使疏水作用增强,吸收峰红移.
2.7.3 圆二色光谱
圆二色(Circular dichroism,简称CD)光谱是研究稀溶液条件下蛋白质二级结构的重要工具.由BSA及BSA-DPZ混合溶液的CD光谱图(见图9)可知:BSA在222 nm和208 nm处分别有一特征负峰,这是典型的α-螺旋结构的特征.本实验主要通过对208 nm处的特征峰强度进行计算,分析DPZ对BSA构象的影响.采用公式(9)、(10)[11]可以求得不同条件下BSA分子中α-螺旋结构的含量.
(9)
(10)
其中:MRE为平均残基椭圆率;cP为蛋白质物质的量浓度;n为蛋白质中氨基酸残基的数目(BSA,n=582);l为光路的长度(本实验中l=0.5 cm);MRE208为208 nm处的MRE值;4 000为β-折叠和无归卷曲构象跨过208 nm的MRE值;33 000为纯α-螺旋在208 nm的MRE值.

c(BSA)=1.0 μmol·L-1,c(DPZ)=5.0 μmol·L-1
在本实验条件下,BSA分子中α-螺旋结构的含量为55.64 %,DPZ的加入使得负峰强度减小,即α-螺旋结构的含量在下降,降至50.41 %.BSA中α-螺旋结构的降低是由于DPZ与肽键中氨基酸残基结合,从而在一定程度上破坏了蛋白质的氢键网络结构,导致BSA分子肽链的伸展而引起的.综合以上同步荧光光谱、吸收光谱和圆二色光谱的实验结果可以看出,DPZ与BSA的相互作用使BSA的构象发生了改变.
3 结 论
在模拟生理条件下,用荧光光谱、紫外吸收光谱及圆二色光谱研究DPZ与BSA的相互作用,得到以下结论:
(1) DPZ对BSA的荧光猝灭过程为静态猝灭,形成摩尔比为1∶1的复合物.
(2) 两者之间的主要作用力为疏水作用力和静电引力.
(3) 通过非辐射能量转移理论求得DPZ与BSA残基的结合距离r=3.161 nm,r<7 nm,表明两者之间存在非辐射能量转移,但r大于转移效率为50 % 时的临界距离R0,说明非辐射能量转移引起荧光猝灭的概率比静态猝灭要小.
(4) 利用位点标记物进行竞争结合的实验结果表明,DPZ在BSA上的结合部位为siteⅠ位.
(5) 同步荧光光谱、吸收光谱及圆二色光谱的研究结果表明,DPZ能使BSA的构象发生改变.
参考文献:
[1] 张敏.人血浆白蛋白的生理功能及临床应用[J].四川生理科学杂志,2011,33(1):36-38.
[2] 张国文,陈秀霞.荧光法研究3种黄酮化合物与牛血清白蛋白的结合作用[J].南昌大学学报:工科版,2010,32(24):140-144.
[3] 高瑞,马红燕,孙雪花,等.流动注射时间扫描荧光分析法测定盐酸二氧丙嗪[J].分析科学学报,2011,27(1):81-84.
[4] 何玲玲.吩噻嗪类药物与蛋白质相互作用及其声动力活性的光谱法研究[D].沈阳,东北大学理学院,2012:28-29.
[5] 许金钩,王尊本.荧光分析法[M].3版.北京:科学出版社,2006:124.
[6] 颜乘农,童金强,熊丹,等.荧光光谱法研究培氟沙星与牛血清白蛋白结合反应特征[J].分析化学,2006,34(6):796-800.
[7] Ware W R.Oxygen Quenchixg of Fluorescence in Solution:An Experimental Study of the Diffusion Process[J].The Journal of Physical Chemistry,1962,66(3):445-458.
[8] Ross P D,Subramanian S.Thermodynamics of Protein Association Reactions:Forces Contributing to Stability[J].Biochemistry,1981,20(11):3096-3102.
[9] He W Y,Li Y,Xue C X,et al.Effect of Chinese Medicine Alpinetin on the Structure of Human Serum Albumin[J].Bioorganic & Medicinal Chemistry,2005,13(5):1837-1845.
[10] 何丽芳,林丹丽,李耀群.同步荧光分析法的应用及其新进展[J].化学进展,2004,16(6):879-884.
[11] Zhang J,Wang X J,Yan Y J,et al.Comparative Studies on the Interaction of Genistein,8-Chlorogenistein,and 3’,8-dichlorogenistein with Bovine Serum Albumin[J].Journal of Agricultural and Food Chemistry,2011,59(13):7506-7513.

