超声波辅助酶法制备绿豆ACE抑制肽的工艺研究
刘振春,韩 宇,孙慧娟,耿存花
(吉林农业大学 食品科学与工程学院,吉林 长春 130118)
绿豆又称吉豆、青小豆,为一年生豆科草本植物。我国绿豆栽培历史悠久,各省几乎都有栽培[1-2]。近年来吉林、黑龙江、安徽、内蒙古、陕西、河南、山西、河北等省 (区 )绿豆种植较多,其次是湖北、湖南、四川、重庆、山东、江苏等省[3]。绿豆中含有丰富的营养物质,其中蛋白质的含量高达19%~33%,绿豆蛋白中含有丰富的亮氨酸、蛋氨酸、色氨酸,并含有较丰富的玉米等谷类中所缺少的赖氨酸,是一种优质蛋白。绿豆蛋白经酶解得到的多肽类物质结构与绿豆蛋白基本相同,具有溶解性良好、易于为人体吸收、降血压、降胆固醇等特点。但是目前我国大部分地区对绿豆的开发利用还仅仅停留在副产品的加工上,并未对绿豆蛋白进行合理利用。
ACE抑制肽是一类对ACE活性具有抑制作用的多肽类物质。血压的升高主要是由于体内的血管紧张素Ⅰ向血管紧张素Ⅱ的转化所引起,ACE抑制肽能够有效地阻止此反应的发生,从而起到降血压的效果[4-8]。在传统方法中,ACE抑制肽的制备主要是通过蛋白酶水解的方法来实现,但是这种方法的反应速度慢,制备的ACE抑制肽活性低。利用超声波破坏大分子物质的分子结构或者改变分子空间构型来改变其生物活性,或者使其易于降解,然后再利用传统方法进行酶解,不仅可以加快酶解的进程,而且可以获得活性较高的产物[9-13]。美国、日本等国家对豆类中多肽物质的研究较早,目前已形成一定的规模,甚至已经形成工业化生产,但我国对绿豆ACE抑制肽的制备研究尚处于起步阶段,相关报道还较少[14]。为此,本研究在传统酶法制备绿豆ACE抑制肽的基础上添加超声波辅助,以所提取多肽类物质的ACE抑制活性为验证指标,利用单因素试验和响应面分析试验优化绿豆ACE抑制肽的制备工艺。
1 材料与方法
1.1 材料与仪器
主要材料:绿豆、Neutrase中性蛋白酶、Alcalase碱性蛋白酶、Protames复合蛋白酶、木瓜蛋白酶、血管紧张素转化酶、马尿酰组氨酰亮氨酸(HHL)
主要仪器:JY99-2D超声波电源,宁波新芝生物科技股份有限公司;T6 新世纪紫外可见分光光度计,北京普析通用仪器有限公司;SHA-B水浴恒温振荡器,金坛市医疗仪器厂;LXJ-ⅡB离心机,上海安亭科学仪器厂。
1.2 测定项目及方法
1.2.1 蛋白质含量 采用凯氏定氮法测定。
1.2.2 蛋白水解度 采用茚三酮法测定[15]。
1.2.3 多肽含量 采用folin-酚法测定。
1.2.4 ACE抑制活性测定 利用Cushman等[17]的方法进行检测。取80 μL的HHL溶液,分别加入100 μL的去离子水和10 μL的水解液,混合后置于37 ℃恒温水浴中水浴3 min,然后再加入10 μL的ACE酶液,恒温条件下保持30 min,加入0.2 mL 1 mol/L的HCl停止反应,再加入1.2 mL乙酸乙酯混合15 s,在 3 500 r/min下离心5 min后取出脂层溶液0.8 mL,在120 ℃条件下烘干,最后重新溶于3 mL的去离子水中,在波长为228 nm处测定吸光度。利用下式计算ACE抑制率:
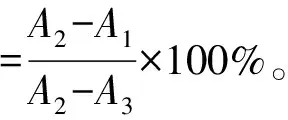
式中:A1为ACE抑制肽和ACE都存在时溶液在228 nm处的吸光度;A2为只有ACE存在时溶液在228 nm处的吸光度;A3为只有ACE抑制肽存在时溶液在228 nm处的吸光度。
1.3 绿豆ACE抑制肽制备最适酶的选择
采用普通酶解法,分别测定木瓜蛋白酶、Neutrase中性蛋白酶、Alcalase碱性蛋白酶、Protames复合蛋白酶对绿豆蛋白的酶解作用,以ACE抑制率和蛋白水解度为评价指标,确定最佳的反应酶。
1.4 酶法制备绿豆ACE抑制肽
将绿豆干燥、粉碎,按照料水比1∶10(质量体积比,下同)加入蒸馏水,置于恒温振荡器中,酶解过程中溶液pH的变化用0.5 mol/L的HCl或NaOH溶液进行调控,在加酶量5%(酶体积与底物质量比,下同)、55 ℃水浴条件下连续酶解2 h,然后在85 ℃的水浴下连续灭酶15 min,灭酶结束后迅速冷却至40 ℃,10 000 r/min离心20 min,对上清液进行抽滤,测定酶解液水解度,对上清液进行冷冻干燥,所得绿豆多肽粉末按照蛋白质量浓度为10 mg/mL 配制成溶液,测定ACE抑制活性。
1.5 超声波辅助酶法制备绿豆ACE抑制肽
将绿豆粉用蒸馏水按照料水比1∶10进行配制,在超声波功率165 W、水浴温度55 ℃条件下酶解20 min,之后试验方法同1.4节。
1.6 超声波辅助酶法与传统酶法制备绿豆ACE抑制肽的比较
将绿豆干燥、粉碎,按照一定的料水比进行配制,参照1.4和1.5节的制备工艺制备绿豆ACE抑制肽,比较2种方法制备绿豆ACE抑制肽的蛋白水解度和ACE抑制活性。
1.7 超声波辅助酶法制备绿豆ACE抑制肽的单因素试验
以ACE抑制率和蛋白水解度为指标,比较超声波处理时间、超声波功率、水浴温度、酶解时间和加酶量对绿豆ACE抑制肽制备的影响。
(1)超声波处理时间。在超声波功率为165 W、水浴温度为55 ℃、加酶量5%条件下,分别超声辅助处理0,10,20,30,40,50 min后酶解2 h,比较超声波处理时间对绿豆ACE抑制肽制备的影响。
(2)超声波功率。在超声波处理时间为20 min、水浴温度为55 ℃、加酶量为5%的条件下,分别在55,110,165,220 W超声波功率下酶解2 h,比较超声波功率对绿豆ACE抑制肽制备的影响。
(3)水浴温度。在超声波处理时间为20 min、超声波功率为165 W、加酶量为5%的条件下,分别在50,55,60,65,70 ℃水浴温度下酶解2 h,比较不同水浴温度对绿豆ACE抑制肽制备的影响。
(4)酶解时间。在超声波处理20 min、超声波功率165 W、水浴温度55 ℃、加酶量5%的条件下,分别酶解1,2,3,4 h,比较酶解时间对绿豆ACE抑制肽制备的影响。
(5)加酶量。在超声波处理时间为20 min、超声波功率为165 W、水浴温度55 ℃,以及加酶量分别为1%,3%,5%,7%条件下酶解2 h,比较加酶量对绿豆ACE抑制肽制备的影响。
1.8 超声波辅助酶法制备绿豆ACE抑制肽的响应面法优化
根据Box-Benhnken试验设计原理,以ACE抑制率为响应变量,从单因素试验结果中选取3个对绿豆ACE抑制肽的抑制率影响较大的因素,即加酶量(X1)、超声波功率(X2)和酶解时间(X3)进行3因素3水平的响应面试验(表1),利用响应面分析法对抑制肽的制备条件进行优化。

表 1 超声波辅助酶法制备绿豆ACE抑制肽的响应面分析因素及水平
2 结果与分析
2.1 绿豆ACE抑制肽制备最佳酶的选择
以ACE抑制率和蛋白水解度为评价指标,分别测定Neutrase中性蛋白酶、Alcalase碱性蛋白酶、Protames复合蛋白酶、木瓜蛋白酶对绿豆蛋白的酶解效果,结果见表2。由表2可知,用Alcalase碱性蛋白酶进行酶解时,ACE抑制率与蛋白水解度均最大,故选择Alcalase碱性蛋白酶为水解酶。

表 2 4种蛋白酶对绿豆蛋白酶解效果的比较
2.2 超声波辅助酶法与传统酶法制备绿豆ACE抑制肽效果的比较
由表3可以看出,在传统方法酶解制备ACE抑制肽的方法上利用超声波进行预处理,不仅能够增加所提取多肽物质的活性,而且对ACE具有更好的抑制作用,并且蛋白水解度也有所增加,说明超声波辅助能够对抑制肽的制备起到一定的优化作用。

表 3 超声波辅助酶法与传统酶法制备绿豆ACE抑制态效果的比较
2.3 超声波辅助酶法制备绿豆ACE抑制肽的单因素试验结果
2.3.1 超声波处理时间 由图1可知,随着超声波处理时间的变化,蛋白水解度和ACE抑制率均呈现相应改变,当超声波处理时间为30 min时,蛋白水解度达到最大值16.5%,而此时ACE抑制率并非最高;当超声波处理时间为20 min时,ACE抑制率达到最高值 82.5%,故将超声波处理时间定为20 min。
2.3.2 超声波功率 从图2可以看出,随着超声波功率的变化,蛋白水解度和ACE抑制率均呈现先上升后下降的趋势,当超声波功率为110 W时,蛋白水解度达到最大值,而当超声波功率达到165 W时,ACE抑制率最高,这可能是由于随着超声波功率的增加,处理液中的物质成分发生了某些变化,使抑制率降低。考虑到超声波功率对抑制率的影响,选择超声波功率为165 W。

图 1 超声波处理时间对蛋白水解度和ACE抑制率的影响
2.3.3 水浴温度 水浴温度对蛋白水解度和ACE抑制率的影响见图3。从图3可以看出,当水浴温度为55 ℃时,蛋白水解度为16.5%,而此时ACE抑制率恰巧也达到最大值,当水浴温度继续升高,蛋白水解度和ACE抑制率迅速下降,这可能是由于随着水浴温度的升高,超出了酶的最适温度时酶解作用发生阻碍,当水浴温度升高到一定值时,水解酶失活,丧失酶解能力。故选取水浴温度55 ℃。

图 3 水浴温度对蛋白水解度和ACE抑制率的影响
2.3.4 酶解时间 由图4可见,当酶解时间为2 h时,ACE抑制率达到最大值,而蛋白水解度随着酶解时间的变化趋于平缓,这可能是由于随着酶解时间的延长,其中的某些成分发生变化所致,故选取酶解时间2 h。
2.3.5 加酶量 加酶量对蛋白水解度和ACE抑制率的影响见图5。由图5可知,随着加酶量的增加,蛋白水解度增加趋势变小,而ACE抑制率先增加后减小,当加酶量达到5%时,ACE抑制率达到最大。考虑到生产成本,将加酶量定为5%。

图 5 加酶量对蛋白水解度和ACE抑制率的影响
2.4 响应面法优化超声波辅助酶解制备绿豆ACE抑制肽的工艺
2.4.1 响应面试验结果 用ACE抑制率作为试验的响应值,根据单因素试验结果,选取对ACE抑制肽的抑制率影响较大的3个因素,即加酶量(X1)、超声波功率(X2)和酶解时间(X3),利用Box-Benhnken响应面分析法设计3因素3水平试验,结果见表4,方差分析结果见表5。
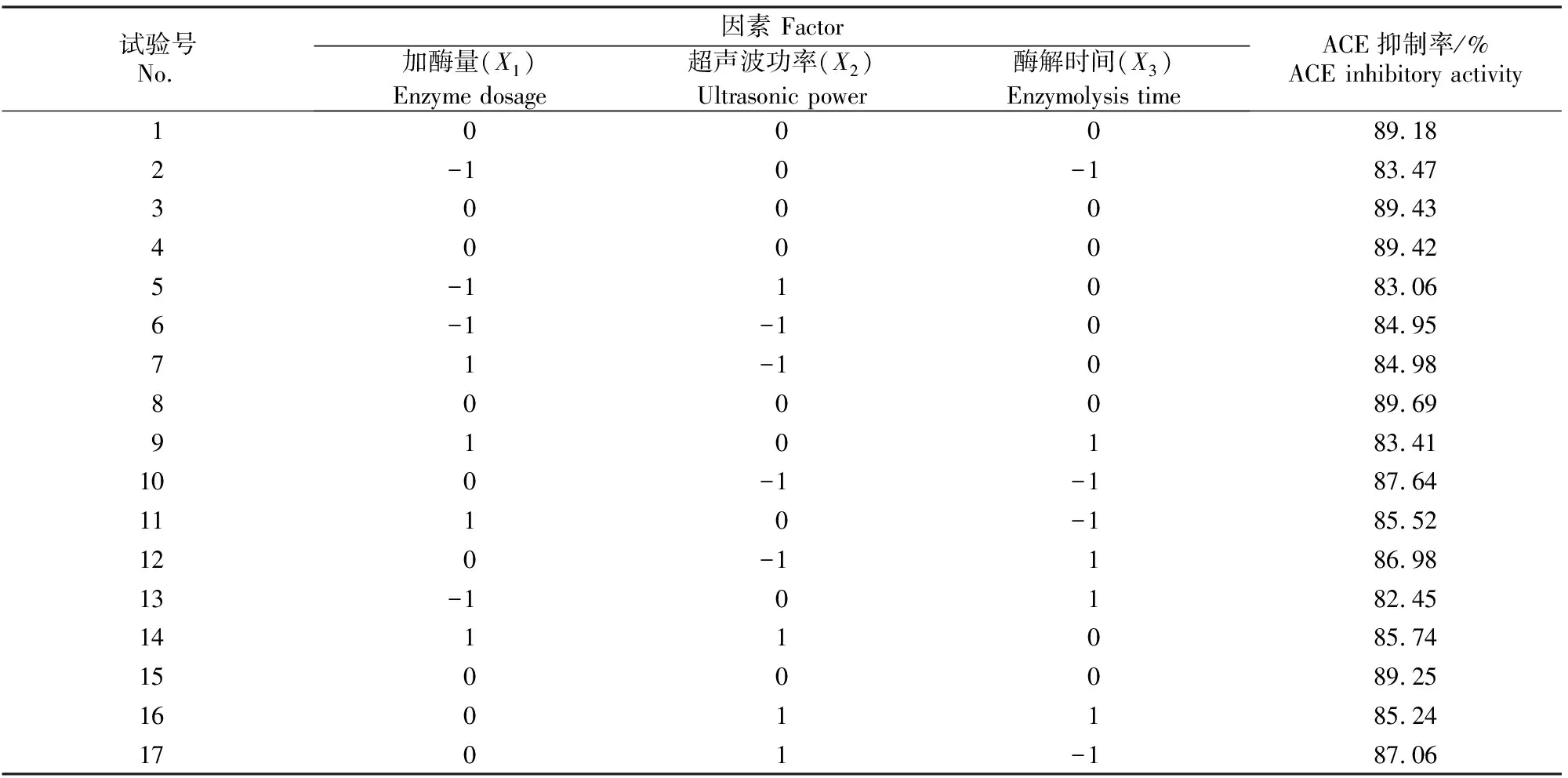
表 4 超声波辅助酶法制备绿豆ACE抑制肽的响应面设计及试验结果
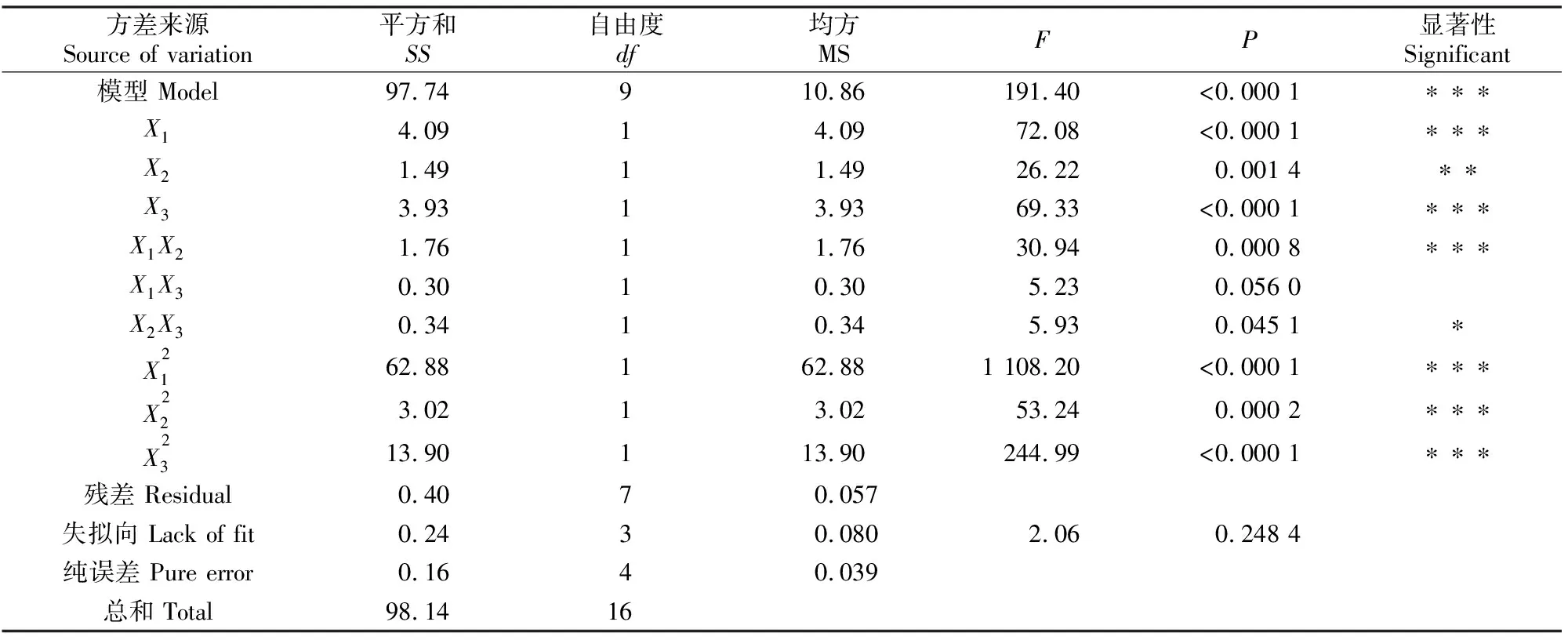
表 5 超声波辅助酶法制备绿豆ACE抑制肽回归方程的方差分析
2.4.2 回归方程的建立与检验 利用Design Expert 7.0.0软件对试验数据进行回归分析,得到以绿豆为初始原料提取ACE抑制肽的抑制率(Y)对加酶量(X1)、超声波功率(X2)和酶解时间(X3)的二次多项回归方程为:

2.4.3 双因素交互作用 由表5可知,各因素对ACE抑制率影响显著,其中X1、X3对试验的影响极显著,X2的影响较X1、X3弱,说明加酶量和酶解时间对ACE抑制率影响很大,而超声波功率影响相对较小;交互项中除X1X3外均影响显著,即加酶量与超声波功率、超声波功率与酶解时间都存在交互作用,表明各因素对ACE抑制率的影响不是简单的线性关系。
2.4.4 加酶量与超声波功率的交互作用 在酶解时间为2 h时,加酶量与超声波功率的等高线图和响应曲面见图6。从图6可以看出,随加酶量的增加ACE抑制率变化很大,而超声波功率对ACE抑制率的影响较小,等高线图明显呈椭圆形,由此可知超声波功率和加酶量具有明显的交互作用。
2.4.5 加酶量与酶解时间的交互作用 在超声波功率为165 W时,加酶量与酶解时间的等高线图和响应曲面见图7。从图7可以看出,当酶解时间为1和3 h时,ACE抑制率很低,当酶解时间在2 h左右时ACE抑制率较高,加酶量对ACE抑制率的影响比酶解时间大,从等高线图可知加酶量和酶解时间的交互作用不明显。
2.4.6 超声波功率与酶解时间的交互作用 在加酶量为5%时,超声波功率和酶解时间的等高线图和响应曲面见图8。从图8可以看出,虽然酶解时间对ACE抑制率的影响较为明显,但超声波功率对ACE抑制率的影响曲线相对平缓,从等高线图可以看出超声波功率与酶解时间交互作用明显。
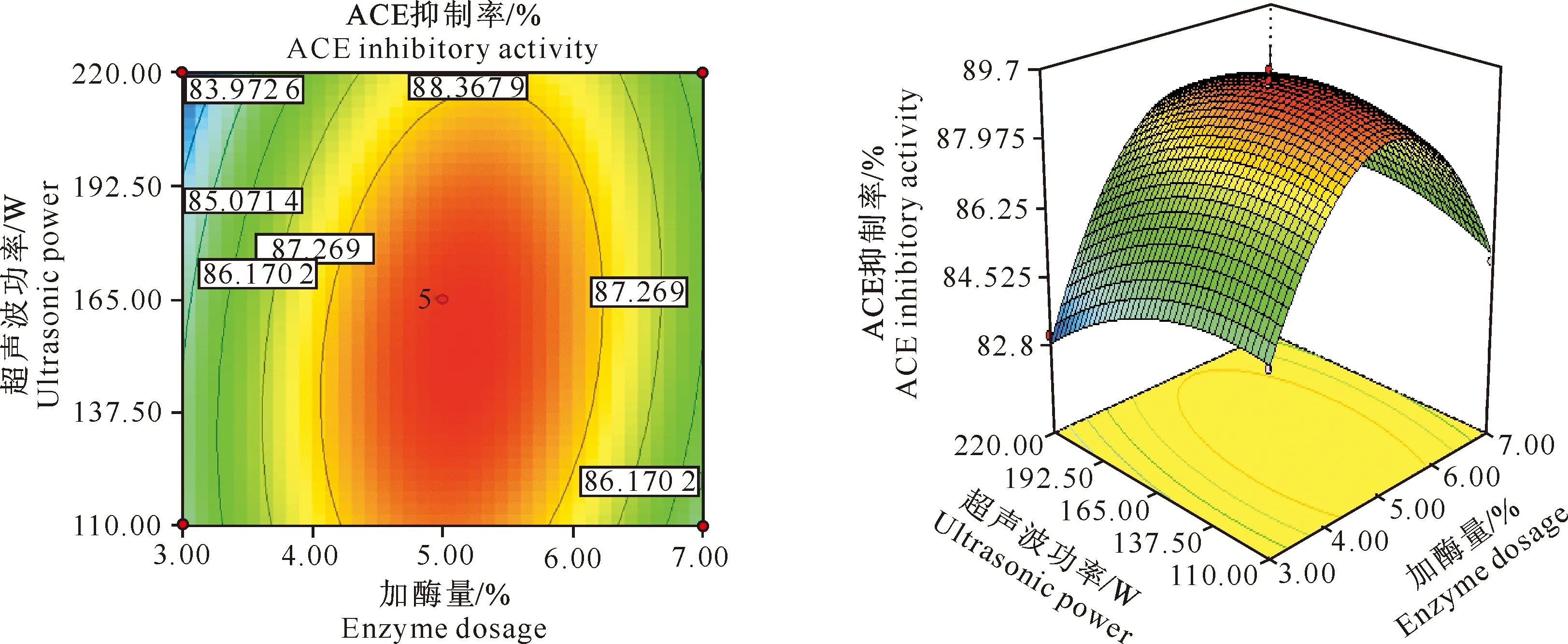
图 6 加酶量与超声波功率对ACE抑制率影响的交互作用

图 7 加酶量与酶解时间对ACE抑制率影响的交互作用

图 8 超声波功率与酶解时间对ACE抑制率影响的交互作用
2.4.7 最佳制备条件的确定及验证 通过Design Expert 7.0.0软件对回归方程的优化计算,并结合实际操作,得到以绿豆为初始原料制备绿豆ACE抑制肽的最佳条件为:超声波处理时间20 min、水浴温度55 ℃、加酶量5%、超声波功率155 W、酶解时间2 h。按照上述最佳条件进行3次验证试验,得到ACE抑制率的平均值为 89.27%,这与预测的ACE抑制率89.53%十分接近,说明回归模型可以很好地反映绿豆ACE抑制肽制备的最佳条件。
3 讨论与结论
本试验将超声波应用到绿豆ACE抑制肽的制备,利用超声波产生的脉冲作用对制备工艺进行优化,得到ACE抑制率平均值为89.27%,该结果高于龚琴等[17]的响应面法优化酶解制备绿豆ACE抑制肽的研究结果(84.83%),说明超声波的应用对试验起到了一定的优化效果。但还需进一步从分子结构以及绿豆氨基酸组成上,研究超声波辅助酶法提高绿豆ACE抑制率的机理,进而从微观上对绿豆ACE抑制肽展开研究,进一步改善ACE抑制肽的抑制功效。
通过单因素试验确定超声波辅助酶解制备绿豆ACE抑制肽中各因素对ACE抑制率的影响,并根据Box-Benhnken试验设计原理,应用响应面法对制备条件进行优化,确定了ACE抑制肽制备最佳条件,即超声波处理时间20 min、水浴温度55 ℃、超声波功率155 W、加酶量5%、酶解时间2 h,在此条件下绿豆ACE抑制肽的抑制率可达到89.27%。
[参考文献]
[1] 刘长友,程须珍,王素华,等.中国绿豆种质资源遗传多样性研究 [J].植物遗传资源学报,2006,7(4):459-463.
Liu C Y,Cheng X Z,Wang S H,et al.The genetic diversity of mungbean germplasm in China [J].Journal of Plant Genetic Resources,2006,7(4):459-463.(in Chinese)
[2] 李 敏.绿豆化学成分及药理作用的研究概况 [J].上海中医药杂志,2001(5):47-49.
Li M.Research advance in chemical composion and pharmacological action of mung bean [J].Shanghai Journal of Traditional Chinese Medicine,2001(5):47-49.(in Chinese)
[3] 庄 艳,陈 剑.绿豆的营养价值及综合利用 [J].杂粮作物,2009,29(6):418-419.
Zhuang Y,Chen J.Nutritional value and comprehensive utilization of mung beam [J].Rain Fed Crops,2009,29(6):418-419.(in Chinese)
[4] Byun H G,Kim S K.Structure and activity of angiotensin-I-converting enzyme inhibitory peptides derived from Alaskan pollack skin [J].Journal of Biochemistry and Molecular Biology,2002,35(2):239-243.
[5] Mullally M M,Hans M,Fitzgerald R J.Angiotensin-I-converting enzyme inhibitory activities of gastric and pancreatic protein-ase digests of whey proteins [J].Nternational Dairy Journal,1997,7(5):299-303.
[6] Sturrock E D,Natesh R,Van R J M,et al.Structuer of angiotensin-I-eonverting enzyme [J].Cellularand Molecular Life Sciences,2004,61(21):2677-2686.
[7] Cushman D W,Cheung H S.Spectrophotometric assay and pr-operties of the angiotensin-converting enzyme of rabbit lung [J].Biochemical Pharmacology,1971,20:1637-1648.
[8] Morigiwa A,Kitabatake A,Fujimoto Y,et al.Angiotensin converting enzyme-inhibitory triterpenes fromG.lucidum[J].Chemical & Pharmaceutical Bulletin,1986,34:3025-3028.
[9] Leclerc P L,Gauthier S F,Bachelard H,et al.Antihyper-tensive activity of casein-enriched milk fermented byLactobacillushelveticus[J].Rticle International Dairy Journal,2002,12(12):995-1004.
[10] 马海乐,杨巧绒,邝利兵,等.超声波对螺旋藻蛋白质酶解促进作用的试验研究 [J].食品科学,2003,24(10):35-37.
Ma H L,Yang Q R,Kuang L B,et al.Experimental study on promotion effected of ultrasonic treatment on enzymatic hydrolysis of apirulina plantansis protein [J].Food Science,2003,24(10):35-37.(in Chinese)
[11] 何荣海,马海乐.超声波在酶法生产紫菜降血压肽过程中的应用 [J].江苏大学学报:自然科学版,2007,28(1):4-7.
He R H,Ma H L.Application of ultrasound technology to enzyme hydrolysis processs in producing antihypertensive peptides from porphyra yezoensis [J].Journal of Jiangsu University:Natural Science Edition,2007,28(1):4-7.(in Chinese)
[12] 韩 扬.超声辅助酶法制备燕麦ACE抑制肽的研究 [D].北京:北京工商大学,2010.
Han Y.Ultrasonic-assisted enzymatic method preparing oat ACE inhibitory peptides [D].Beijing:Beijing Technology and Business University,2010.(in Chinese)
[13] 韩 扬,何聪芬,董银卯,等.响应面法优化超声波辅助酶法制备燕麦ACE抑制肽的工艺研究 [J].食品科学,2009,30(22):44-49.
Han Y,He C F,Dong Y M,et al.Response surface optimization of ultrasonic-assisted enzymatic preparation of ACE inhibitory peptides from oat [J].Food Science,2009,30(22):44-49.(in Chinese)
[14] 龚 琴.绿豆粉丝废水生物法制备降血压肽的研究 [D].武汉:湖北工业大学,2011.
Gong Q.The study on preparing antihypertensive peptides with green bean fan wastewater [D].Wuhan:Hubei Industry University,2011.(in Chinese)
[15] 赵新淮,冯志彪.蛋白质水解物水解度的测定 [J].食品科学,1994,1(11):65-67.
Zhao X H,Feng Z B.The methods for determination of hydrolyzed degree of protein [J].Food Science,1994,1(11):65-67.(in Chinese)
[16] 余冰宾.生物化学实验指导 [M].北京:清华大学出版社,2004:54-62,133-136.
Yu B B.Instruction on biochemistry experiment [M].Beijing:Tsinghua University Press,2004:54-62,133-136.(in Chinese)
[17] 龚 琴,吴 莎,罗栋源,等.响应面法优化酶解制备绿豆ACE抑制肽的研究 [J].食品工业科技,2011(7):312-315.
Gong Q,Wu S,Luo D Y,et al.Study on optimization of enzymatic hydrolysis to prepare mung bean,protein ACE inhibition peptides by response surface method [J].Science and Technology of Food Industry,2011(7):312-315.(in Chinese)

