脂氧合酶介导的氧化代谢与氧化应激
彭敏兰,胡建安
(中南大学公共卫生学院劳动卫生与环境卫生学系,湖南长沙 410078)
脂氧合酶介导的氧化代谢与氧化应激
彭敏兰,胡建安
(中南大学公共卫生学院劳动卫生与环境卫生学系,湖南长沙 410078)
氧化应激及其所致的组织损伤与许多疾病的发生发展过程关系密切。脂氧合酶是一种多功能氧化酶,能参与多种内源性化学物和药物、环境污染物等外源化学物的氧化代谢,并在氧化反应过程中通过多种方式产生活性氧。脂氧合酶能催化内源性化学物如花生四烯酸的反应并伴有活性氧的产生,脂氧合酶还能通过影响细胞间的信号转导而激活其他活性氧产生途径;此外,脂氧合酶还能催化外源化学物代谢为高活性的自由基中间体而诱发活性氧的产生。这些过程中产生的活性氧超过抗氧化系统的清除能力时可导致机体氧化抗氧化系统的失衡而诱发氧化应激,这可能是这些化学物发挥毒性作用的重要机制之一。
脂氧合酶;氧化应激;活性氧;氧化损伤
DO l:10.3867/j.issn.1000-3002.2014.03.024
氧化应激是机体在内外因素的刺激下,体内高活性分子活性氧(reactive oxygen species,ROS)产生和抗氧化系统失衡,从而可以导致组织损伤的过程。氧化应激与动脉粥样硬化、癌症、糖尿病、慢性阻塞性肺疾病、类风湿性关节炎和阿尔茨海默症等多种疾病的发生发展有密切关系。此外,氧化应激也被认为是衰老的主要原因。机体产生ROS的途径多种多样,脂氧合酶(lipoxygenase,LOX)作为一种能代谢内源和外源化学物的多功能酶,能在催化化学物代谢过程中产生ROS,导致细胞内氧化-抗氧化系统的平衡紊乱而诱发氧化应激。阐明LOX在代谢内源性和外源性化学物的过程中对细胞内氧化应激的影响,对有关疾病的发病机制和治疗研究,以及外源化学物所致机体损伤的机制和防治的研究都具有重要的意义。
1 脂氧合酶及其氧化代谢作用
LOX是一类非血红素铁蛋白的多功能酶,广泛存在于耗氧生物体内。藻类、植物、水生无脊椎动物和脊椎动物体内均发现脂氧合酶。LOX广泛分布于哺乳动物体内,目前已在血细胞和胎盘、宫内受孕组织、卵巢、睾丸、肺、心、肝、肾、脑和皮肤等组织中发现LOX活性。在动物组织中LOX主要以花生四烯酸(arachidonic acid,AA)为作用底物。在植物体内LOX多以十八碳酸如亚油酸、亚麻酸等为底物。根据底物加氧点的位置不同,人和动物体内的LOX主要分为5-LOX,8-LOX,12-LOX,15-LOX。
LOX主要表现2种酶活性,即双加氧酶活性和协同氧化活性。LOX对含1,4-顺-顺-戊二烯基团的多不饱和脂肪酸具有双加氧作用。在双加氧反应中以多不饱和脂肪酸作为反应底物,首先经过氢抽取形成脂肪酸根,基团重排后插入一分子氧进而转化为脂质过氧化自由基中间产物(LOO-)或稳定终产物脂质氢过氧化物(LOOH)。LOX以LOO-或LOOH为氧化剂进一步氧化外源化学物的能力被称为协同氧化活性。LOX对不同化学物的协同氧化酶活力有两种作用模式:一种是与脂质过氧化自由基中间产物(LOO-)结合,另一种是与双加氧反应的稳定终产物脂质氢过氧化物(LOOH)结合。LOX能介导多种药物、致癌物、致畸物、致突变物发生环氧化、羟基化、磺化氧化作用、脱硫作用、N-去甲基等形式的氧化代谢反应,LOX还可能是某些化学物如联苯胺、丙烯腈等的唯一代谢途径[1]。研究表明,LOX能催化某些内源性化学物以及环境污染物、工业化学物、药物等100多种外源化学物的氧化反应[2]。
一般认为外源化学物的氧化代谢主要由肝微粒体混合功能氧化酶系统中的细胞色素P450酶催化。P450对药物和化学物的代谢活化起着重要作用。但是在P450表达很低的肝外组织中前列腺素H合酶(prostaglandin H synthase,PHS)、LOX、髓过氧化物酶等能够作为代谢活化外源化学物的主要酶类。P450和PHS是微粒体酶,而LOX主要分布在胞浆,由于酶的这一分布差异LOX在某些亲水性化学物的代谢中起着至关重要的作用。肝外组织中LOX很可能是一些化学物代谢的有效替代性途径或补充途径。
2 LOX介导的内源性物质代谢对氧化应激的影响
正常生理条件下,细胞内的ROS具有杀灭微生物、调节免疫功能等独特作用,少量的ROS还能作为细胞内第二信使发挥作用[3]。当机体在内外因素作用下ROS过量累积,氧化系统和抗氧化系统失衡时,引发氧化应激而造成组织细胞的损伤。细胞内产生ROS的途径很多,如线粒体呼吸链,环氧化酶(cyclooxygenase,COX)、LOX、黄嘌呤氧化酶、NADPH氧化酶(NADPH oxidase,NOX)等酶类的作用过程[4]。
2.1 LOX对花生四烯酸的代谢与氧化损伤
AA是人体中含量最高、分布最广的一种多不饱和脂肪酸。在生理、病理或药物作用下活化的磷脂酶A2可以使AA从细胞膜磷脂中游离出来,游离的AA能被LOX所代谢产生自由基和过氧化物[5],这些不稳定的过氧化物也能作为ROS发挥氧化作用[6]。有研究表明,AA引起的细胞凋亡与氧化应激有关[7-8]。
LOX能通过代谢AA的过程中产生ROS而破坏细胞内氧化还原平衡诱发氧化应激。LOX催化AA形成的不稳定过氧化物能与氧结合产生ROS[9],细胞内ROS水平超过抗氧化防御能力时将诱发细胞内氧化应激反应。5-LOX是AA代谢的关键酶,它催化AA产生白三烯和ROS是细胞内ROS来源之一[10-11]。12-LOX是脑组织中最主要LOX的亚型,其m RNA表达于大鼠皮质神经元、少突胶质细胞和神经胶质细胞。Chinnici等[12]利用基因敲除小鼠首次提出12/15-LOX在体内影响大脑氧化应激水平的证据。通过12/15-LOX和载脂蛋白E双基因敲除小鼠与单独载脂蛋白E基因敲除小鼠比较发现,12/15-LOX是中枢神经系统氧化应激中的重要影响因素。通过对氧化损伤敏感的HT-22细胞和未成熟的少突胶质细胞为模型的体外实验发现,AA的12-LOX代谢途径产生的过量ROS是缺血再灌注损伤的主要原因之一,基因敲除或药物抑制12-LOX活性均可改善缺血再灌注损伤的愈后[13]。Haworth等[14]用离体心肌细胞研究缺血再灌注后心率失常,发现LOX代谢AA导致的线粒体去极化及产生的ROS过量累积造成氧化应激,很可能是心肌缺血再灌注损伤后心率失常的原因。
2.2 LOX影响细胞间的信号转导而激活其他途径产生ROS
哺乳动物细胞内的酶和非酶过程都可以产生ROS,其中NOX途径是细胞内ROS的重要来源。近年的许多研究发现,AA的LOX和COX途径的代谢产物可通过信号转导途径激活NOX系统产生ROS,从而破坏细胞内氧化-抗氧化系统平衡诱发氧化应激。LOX的代谢产物及其受体与NOX存在信号联系,可以在多种细胞内激活NOX介导ROS的产生[15]。5-LOX,12-LOX,15-LOX的代谢产物白三烯、12(S)-HETE、15(S)-HETE能够诱导NOX刺激ROS的产生[16-18],尤其是5-LOX的代谢产物白三烯(如白三烯B4)在非吞噬细胞内能活化NOX。此外,LOX抑制剂和NOX抑制剂均可有效抑制多种细胞因子和生长因子在非吞噬细胞中形成短暂的ROS爆发[19-21],说明5-LOX和NOX之间存在这信号联系。活化癌基因ras引起的ROS产生是细胞生长停滞中5-LOX起着关键作用[22]。5-LOX的代谢产物尤其是白三烯B4还能通过信号途径影响肿瘤坏死因子α介导ROS形成[20]。
2.3 其他内源性LOX途径ROS的产生
在以往的很多研究中,12/15-LOX介导的损伤作用常归因于LOX对AA的催化作用。但也有报道表明,12/15-LOX可以直接损伤线粒体,引发细胞色素c的释放和ROS的产生[23]。骨细胞中维生素D的代谢产物及其结构类似物能刺激成骨细胞分泌LOX的代谢产物HETE,产生ROS,引发氧化应激而调节骨细胞的分化[24-25]。
3 LOX介导外源化学物氧化过程所致氧化应激
LOX催化多不饱和脂肪酸的过氧化过程中能够产生多种ROS,如超氧阴离子、羟自由基、单线态氧、脂质自由基等。这些ROS可作为氧化剂进一步氧化多种外源化学物。外源化学物被作为还原辅助因子代谢成为高活性或亲电性的自由基中间体,这类自由基中间体具有直接或间接与细胞内氧分子反应产生过量ROS而诱发氧化应激或共价结合细胞内生物大分子的能力。LOX代谢活化外源化学物产生ROS和由此引发的氧化应激很可能是外源化学物引起细胞毒作用的重要机制之一。
3.1 LOX对相关药物的代谢活化与氧化应激
许多具有致癌、致畸和细胞毒作用的药物本身相对无毒并不对机体产生损伤,经代谢活化后才具有毒作用。这类前致癌和致畸化学物一般可以被细胞色素P450酶、PHS、LOX代谢为亲电子剂和(或)活性自由基中间体。如果未能及时代谢解毒,亲电子剂和活性自由基中间体将不可逆地与细胞内生物大分子(DNA、蛋白质、脂质)共价结合,同时外源化学物的活性自由基中间体还能直接或间接的与细胞内氧分子反应引发ROS如超氧阴离子、过氧化氢、羟自由基等的形成而诱发细胞内氧化应激反应导致一系列不良后果(图1)。
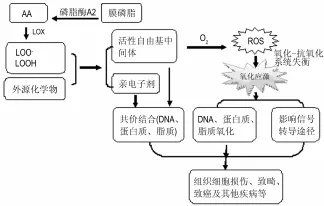
图1 脂氧合酶(LOX)介导外源化学物的氧化活化与氧化应激和氧化损伤.AA:花生四烯酸;ROS:活性氧.
人类和动物的体内和体外实验模型均证实PHS和LOX能够代谢活化苯妥英为高活性的自由基中间体。胚胎组织中LOX能将苯妥英代谢为高活性的自由基中间体,这些自由基中间体与细胞内氧分子结合能产生大量ROS[26]。Lu等[27]在研究苯妥英和卡马西平的特异性药物不良反应中发现,过氧化酶代谢药物产生的自由基在药物不良反应中发挥作用,并用荧光探针技术检测到ROS。但是药物不良反应的常见作用部位皮肤和骨髓中P450酶系表达量很低,LOX作为PHS的竞争性代谢活化酶系很可能在药物的代谢活化和自由基的产生中起着重要作用。苯妥英的结构类似物三甲双酮、二甲双酮、沙利度胺等致畸性药物也可能被AA依赖的LOX酶系氧化产生ROS,影响氧化-抗氧化系统平衡而引起细胞内氧化应激[28]。亚油酸存在的条件下,人胎盘LOX和大豆LOX均能在体外模拟反应中催化氯丙嗪和吩噻嗪的N-位脱甲基而产生活性自由基[29]。氯丙嗪阳离子自由基还能作为“穿梭氧化剂”增强联苯胺等外源化学物的氧化。
氧化应激能够导致胚胎发育畸形[30]。胚胎和胎儿的发育过程中,过量ROS能通过氧化损伤细胞内DNA、蛋白质、脂质或改变信号转导途径而影响生长发育,造成致畸、永久性功能缺陷或疾病的发生。绝大部分的ROS是不稳定的,不能穿过细胞,因此,在致畸中作用的ROS只能是由胚胎组织的氧化代谢过程产生。在细胞色素P450酶含量很低的胚胎组织中,PHS和LOX是主要的过氧化酶,能够催化苯妥英、甲基安非他命、苯并(a)芘等致畸物形成高活性的自由基中间体而引发ROS的产生[31-32]。胚胎发育过程中LOX代谢活化外源化学物的过程中产生ROS诱发氧化应激也是外源化学物致畸的机制之一。
还原型谷胱甘肽可以作为大豆LOX协同氧化的良好底物,同时伴有超氧阴离子的形成[33]。M itra等[34]研究发现一种新的依他尼酸谷胱甘肽共轭物(glutathione conjugate of ethacrynic acid,EA-GS)形成机制:以谷胱甘肽为底物,LOX也能催化EA-GS的形成,在代谢过程中谷胱甘肽被代谢成为GS-。协同氧化还原型谷胱甘肽的过程伴有超氧阴离子的形成,因此LOX可能影响EA代谢过程中细胞内氧化应激的产生。在血小板中12-LOX协同氧化天然黄酮类化合物能产生羟自由基而引起氧化-抗氧化系统失衡[35]。Chou等[36]在研究黄芩苷对B16F10黑色素瘤细胞增殖影响中也发现,黄芩苷能通过12-LOX途径产生ROS而抑制黑色素瘤细胞的增殖。
3.2 LOX对环境化学物的代谢活化与氧化应激
多环芳烃类(polycyclic aromatic hydrocarbons,PAH)和其结构相关的衍生物由含碳有机物热解或不完全燃烧产生,是一类分布广泛的环境污染物。长期接触或吸入这些化学物能导致炎症、过敏、癌症等许多慢性疾病。有些PAH化学物能被过氧化酶代谢为醌类化合物同时产生ROS,此外醌类代谢产物还可通过形成无效的氧化还原循环产生大量的ROS[37]。这种醌类和半醌自由基之间的氧化还原循环是暴露于PAH产生ROS的主要来源。细胞内ROS的过量积累将会破坏细胞内氧化-抗氧化系统平衡引发强烈的氧化应激反应。
二氢苊醌(AcQ)是大气污染物中PAH醌类的一种,代谢活化后能产生活性自由基损伤人类肺上皮A549细胞[38]。Chung等[39]发现,5-LOX的特异性抑制剂AA861可以有效抑制A549细胞中AcQ导致的活性自由基的形成和NF-κB的活化,而其他酶系统的抑制剂的作用并不明显。此外,也有研究证实5-LOX和ROS的形成之间的关系,如5-LOX途径产生的ROS通过激活p53而抑制成纤维细胞的生长[40]。PAH中菲醌、蒽醌等其他多种化合物也可以明显增加A549细胞内活性自由基的产生[38]。
苯并(a)芘(BaP)是PAH中具有代表性的强致癌物质,在体内需要经过酶的代谢活化形成高活性的亲电性中间体才能发挥毒性作用。研究证明LOX能够代谢活化B(a)P。Byczkowski等[41]用14C标记苯并(a)芘和7,8-二氢苯并芘研究LOX在大鼠肺部细胞液中的氧化作用,发现LOX能将苯并(a)芘氧化代谢为它的醌类代谢产物。醌类代谢产物可以形成氧化还原循环激发ROS的大量形成,此外苯并(a)芘的终致癌物苯并芘-7,8-二醇-9,10-环氧化物也是高活性的亲电性自由基团,在细胞内除与DNA等生物大分子形成加合物外还能与细胞内O2作用产生ROS。LOX对苯并(a)芘的氧化活化过程中能产生大量ROS诱发氧化应激反应。
体外实验观察到LOX能介导2-氨基芴、联苯胺等氧化活化形成活性自由基中间体并与DNA结合形成加合物[42],LOX也被认为很可能是其他芳香胺类代谢活化的有效途径之一。LOX还能够代谢活化黄曲霉毒素B1为细胞毒作用的高活性自由基中间体[43]。此外,LOX还能催化多种杀虫剂的N-位脱甲基,这一过程伴有自由基的生成[44]。LOX代谢活化外源化学物生成的高活性亲电性自由基可与细胞内氧分子作用形成ROS而破坏氧化-抗氧化系统平衡,诱发氧化应激氧化损伤DNA等造成细胞损伤,可能是外源化学物引起致畸、致癌等毒作用的原因之一。
综上所述,LOX介导内源性物质和外源化学物代谢过程中会产生ROS,可以引起氧化应激和氧化损伤。但目前这方面的研究尚不完善,有待进一步的深入探讨。以往的研究方法上多使用体外酶系统实验,有少量研究在活体组织细胞中使用酶抑制剂,由于酶的抑制剂的特异性不够以及细胞内干扰因素等使研究结果不利于LOX作用的确认。因而,采用基因沉默特异性抑制LOX的表达等现代实验技术,同时利用体外实验与整体动物实验结合的方法,研究LOX介导内源性物质和外源化学物产生的ROS、氧化应激和氧化损伤与致癌、致畸等毒作用的关系,将更好的阐明LOX介导的氧化应激与有关疾病和化学物毒作用的关系。
[1] Kulkarni AP.Lipoxygenase-a versatile biocatalyst fo r biotransform ation of endobio tics and xenobio tics[J].Cell Mo l Life Sci,2001,58(12-13):1805-1825.
[2] Ku lkarniAP.Ro le of biotransformation in conceptal toxicity of drugs and other chem icals[J].Curr Pharm Des,2001,7(9):833-857.
[3] Shin MH,Moon YJ,Seo JE,Lee Y,Kim KH,Chung JH.Reactive oxygen species produced by NADPH oxidase,xanthine oxidase,and m itochondrial electron transport system mediate heat shockinduced MMP-1 and MMP-9 expression[J].Free Radic Biol Med,2008,44(4):635-645.
[4] Leopold JA,Loscalzo J.Oxidative enzymopathies and vascu lar d isease[J].Arte rioscler Throm b Vasc Bio l,2005,25(7):1332-1340.
[5] Phillis JW,Horrocks LA,FarooquiAA.Cyclooxygenases,lipoxygenases,and epoxygenases in CNS:their role and involvement in neurological disorders[J].Brain Res Rev,2006,52(2):201-243.
[6] Schweiger D,Fürstenbe rger G,Krieg P.Inducible expression of 15-lipoxygenase-2 and 8-lipoxygenase inhibits cellgrow th via common signaling pathways[J].J Lipid Res,2007,48(3):553-564.
[7] Pérez MJ,Cederbaum AI.Spin trapping agents(Tempol and POBN)protect HepG2 cells overexpressing CYP2E1 against arachidonic acid toxicity[J].Free Radic Biol Med,2001,30(7):734-746.
[8] Vento R,D′Alessandro N,Giuliano M,Lauricella M,CarabillòM,Tesoriere G.Induction of apoptosis by arachidonic acid in hum an retinoblastom a Y79 cells:involvement o f oxidative stress[J].Exp Eye Res,2000,70(4):503-517.
[9] Speed N,Blair IA.Cyclooxygenase-and lipoxygenase-mediated DNA damage[J].Cancer Metastasis Rev,2011,30(3-4):437-447.
[10] Soberman RJ,Christmas P.The organization and consequences of eicosanoid signaling[J].J Clin Invest,2003,111(8):1107-1113.
[11] Lewis RA,Austen KF,Soberman RJ.Leukotrienes and other products of the 5-lipoxygenase pathway.Biochem istry and re lation to pathobiology in human diseases[J].N Engl J Med,1990,323(10):645-655.
[12] Chinnici CM,Yao Y,Ding T,Funk CD,Pra ticò D.Absence of 12/15 lipoxygenase reduces brain oxidative stress in apolipoprotein E-deficient m ice[J].Am JPathol,2005,167(5):1371-1377.
[13] van Leyen K,Kim HY,Lee SR,Jin G,AraiK,Lo EH.Baicalein and 12/15-lipoxygenase in the ischem ic brain[J].Stroke,2006,37(12):3014-3018.
[14] Haworth RA,Potter KT,Russell DC.Role of arachidonic acid,lipoxygenase,and m itochondrial depolarization in reperfusion arrhythm ias[J].Am J Physiol Heart Circ Physiol,2010,299(1):H165-H174.
[15] Cho KJ,Seo JM,Kim JH.Bioactive lipoxygenase metabolites stimulation of NADPH oxidases and reactive oxygen species[J].Mol Cells,2011,32(1):1-5.
[16] de Carvalho DD,Sadok A,Bourgarel-Rey V,Gattacceca F,Penel C,Lehmann M,et a.Nox1 downstream of 12-lipoxygenase controls cell proliferation but not cell spreading o f colon cancer cells[J].Int J Cancer,2008,122(8):1757-1764.
[17] Luchtefeld M,Drexler H,Schieffe r B.5-Lipoxygenase is involved in the angiotensinⅡ-induced NAD(P)H-oxidase activation[J].Biochem Biophys Res Commun,2003,308(3):668-672.
[18] O thman A,Ahm ad S,MegyerdiS,Mussell R,Choksi K,Maddipati KR,et al.12/15-Lipoxygenase-de rived lipid metabolites induce retina l endothelial cell barrier dysfunction:contribu tion of NADPH oxidase[J].PLoS One,2013,8(2):e57254.
[19] NardiM,Feinmark SJ,Hu L,Li Z,Karpatkin S.Com p lement-independent Ab-induced pe roxide lysis of p latelets requires 12-lipoxygenase and a p late le t NADPH oxidase pathway[J].J Clin Invest,2004,113(7):973-980.
[20] W oo CH,Eom YW,Yoo MH,You HJ,Han HJ,Song WK,et al.Tumor necrosis factor-alpha generates reactive oxygen species via a cytosolic phospholipase A2-linked cascade[J].J Biol Chem,2000,275(41):32357-32362.
[21] ColavittiR,PaniG,BedogniB,Anzevino R,Borre llo S,W altenberger J,et al.Reactive oxygen species as dow nstream mediato rs o f angiogenic signaling by vascu lar endothelial grow th factor receptor-2/KDR[J].J Biol Chem,2002,277(5):3101-3108.
[22] Catalano A,Rodilossi S,Caprari P,Coppola V,Procopio A.5-Lipoxygenase regulates senescence-like grow th a rrest by promo ting ROS-dependent p53 activation[J].EMBO J,2005,24(1):170-179.
[23] Pa llast S,AraiK,Wang X,Lo EH,van Leyen K.12/15-Lipoxygenase targets neuronalm itochondria under oxida tive stress[J].J Neurochem,2009,111(3):882-889.
[24] Som jen D,Katzburg S,G rafi-Cohen M,Knoll E,Sharon O,Posner GH.Vitam in Dmetabolites and analogs induce lipoxygenase mRNA expression and activity as well as reactive oxygen species(ROS)production in human bone cell line[J].J Steroid Biochem MolBiol,2011,123(1-2):85-89.
[25] Som jen D,Katzburg S,Knoll E,Sharon O,Posner GH,Stern N.Vitam in D analogs induce lipoxygenase mRNA expression and activity as well as reactive oxygen species(ROS)production in human bone cells[J].JSteroid Biochem MolBiol,2010,121(1-2):265-267.
[26] Abramov JP,Wells PG.Em bryoprotective role o f endogenous catalase in acatalasem ic and human ca talase-expressing mouse embryos exposed in cu ltu re to deve lopmental and phenytoin-enhanced oxidative stress[J].Toxicol Sci,2011,120(2):428-438.
[27] Lu W,Uetrecht JP.Peroxidase-mediated bioactivation of hydroxylated me tabolites of carbamazepine and phenytoin[J].Drug Me tab Dispos,2008,36(8):1624-1636.
[28] Yu WK,W ells PG.Evidence for lipoxygenase-catalyzed bioactivation of phenytoin to a teratogenic reactive intermediate:in vitro studies using linoleic acid-dependent soybean lipoxygenase,and in vivo studies using pregnant CD-1 m ice[J].Toxicol App l Pha rmacol,1995,131(1):1-12.
[29] Hover CG,Kulkarni AP.Human te rm p lacental lipoxygenase-mediated N-demethylation of phenothiazines and insecticides in the presence of linoleic acid[J].Placenta,2000,21(7):646-653.
[30] Wells PG,McCallum GP,Chen CS,Henderson JT,Lee CJ,Perstin J,et al.Oxidative stress in developmental origins o f d isease:te ratogenesis,neurodevelopmentalde ficits,and cancer[J].Toxicol Sci,2009,108(1):4-18.
[31] W ells PG,Bhuller Y,Chen CS,Jeng W,Kasapinovic S,Kennedy JC,et al.Molecular and biochem icalmechanisms in teratogenesis involving reactive oxygen species[J].Toxicol App l Pharmacol,2005,207(2 Supp l):354-366.
[32] Jeng W,Ram kissoon A,Parman T,W ells PG.Prostaglandin H synthase-catalyzed bioactivation o f am phetam ines to free rad ical intermed ia tes tha t cause CNS regional DNA oxidation and ne rve term inal degeneration[J].FASEB J,2006,20(6):638-650.
[33] Roy P,Sajan MP,KulkarniAP.Lipoxygenasem ediated glutathione oxidation and superoxidegeneration[J].J Biochem Toxicol,1995,10(2):111-120.
[34] Mitra A,Hilbelink DR,Dw ornik JJ,Kulkarni A.A novelm odel to assess developmental toxicity of diha loalkanes in humans:bioactivation of 1,2-dibromoethane by the isozymes o f human feta l liver glutathione S-transferase[J].Teratog Ca rcinog Mutagen,1992,12(3):113-127.
[35] Chou DS,Lee JJ,Hsiao G,Hsieh CY,Tsai YJ,Chen TF,et al.Baicalein induction of hydroxyl radical formation via 12-lipoxygenase in hum an platelets:an ESR study[J].J Agric Food Chem,2007,55(3):649-655.
[36] Chou DS,Hsiao G,Lai YA,Tsai YJ,Sheu JR.Baicalein induces proliferation inhibition in B16F10 melanoma cells by generating reactive oxygen species via 12-lipoxygenase[J].Free Radic Biol Med,2009,46(8):1197-1203.
[37] Shima H,Koike E,Shinohara R,KobayashiT.Oxidative ability and toxicity of n-hexane insoluble fraction of d ieselexhaust particles[J].ToxicolSci,2006,91(1):218-226.
[38] Chung SW,Chung HY,Toriba A,Kameda T,Tang N,Kizu R,et al.An environmental quinoid polycyclic aromatic hydrocarbon,acenaphthenequinone,modulates cyclooxygenase-2 expression through reactive oxygen species generation and nuclear factor kappa B activation in A549 ce lls[J].Toxicol Sci,2007,95(2):348-355.
[39] Chung SW,Toriba A,Chung HY,Yu BP,Kameda T,Tang N,et al.Activation o f 5-lipoxygenase and NF-kappa B in the action o f acenaphthenequinone by modulation of oxidative stress[J].Toxicol Sci,2008,101(1):152-158.
[40] Catalano A,RodilossiS,Cap rariP,Coppola V,Procopio A.5-Lipoxygenase regulates senescence-like grow th arrest by promoting ROS-dependent p53 activation[J].EMBO J,2005,24(1):170-179.
[41] Byczkowski JZ,Kulkarni AP.Linoleate-dependent co-oxygenation of benzo(a)pyrene and benzo(a)pyrene-7,8-d ihydrodiol by ra t cytosolic lipoxygenase[J].Xenobiotica,1992,22(5):609-618.
[42] Roy SK,KulkarniAP.Lipoxygenase:a new pathway fo r 2-am inofluorene bioactivation[J].Cance r Le tt,1991,60(1):33-39.
[43] Datta K,Kulkarni AP.Oxidative metabolism o f aflatoxin B1 by lipoxygenase purified from human te rm p lacenta and intrauterine conceptal tissues[J].Teratology,1994,50(4):311-317.
[44] Hu J,Kulkarni AP.Lipoxygenase-mediated N-dem ethylation of pesticides in vitro[J].Chin J Ind Hyg Occup Dis(中华劳动卫生职业病杂志),2002,20(6):409-412.
Lipoxygenase-m ediated oxidative m etabo lism and oxidative stress
PENG Min-lan,HU Jian-an
(Departm ent o f Occupationa l and Environm enta l Hea lth,Schoo l of Pub lic Hea lth,Centra l South University,Changsha 410078,China)
There is a c lose re lationship between oxidative stress induced tissue dam age and m any diseases.As a mu lti-function oxidase,lipoxygenase can generate reactive oxygen species(ROS)by oxidative ly m etabo lizing various endogenous and exogenous chem icals such as d rugs and environm enta l pollutants.Lipoxygense can catalyze endogenous chem ical reaction,such as arachidonic acid and produce ROS.Lipoxygenase can be also activated in otherways to generate ROS by activating signal transduction.Moreover,some exogenous chem icals can be metabolized into highly reactive radical intermediates by lipoxygenase,inducing ROS generation.The accumulation of intracellar ROS can damage intracellar redox ba lance and induce oxidative stress.Thatm ay be one of the possible toxic e ffectm echanism s o f chem ica l agents.
lipoxygenase;oxidative stress;reactive oxygen species;oxidative dam age
HU Jian-an,E-mail:jiananhu@xysm.net,Tel:(0731)84805460
R963
A
1000-3002(2014)03-0449-06
Foundation item:The project supported by Na tional Na tural Science Foundation of China(81072331)
2013-09-16 接受日期:2013-12-22)
(本文编辑:乔 虹)
国家自然科学基金(81072331)
彭敏兰(1987-),女,硕士研究生;胡建安(1955-),男,教授,博士,博士生导师,主要从事氧化代谢酶与化学物毒性作用的研究。
胡建安,E-mail:jiananhu@xysm.net,Tel:(0731)84805460

