玉米弯孢叶斑病菌REMI白化突变体的筛选与致病性测定
夏淑春王学武张茹琴鄢洪海
(1. 青岛农业大学农学与植物保护学院,青岛 266109;2. 青岛市植物保护站,青岛 266100)
玉米弯孢叶斑病菌REMI白化突变体的筛选与致病性测定
夏淑春1王学武2张茹琴1鄢洪海1
(1. 青岛农业大学农学与植物保护学院,青岛 266109;2. 青岛市植物保护站,青岛 266100)
旨在探讨玉米弯孢叶斑病菌致病机制及遗传变异特性,利用限制性内切酶介导的基因整合技术(REMI)对Curvularia lunata进行了遗传转化,共获得109个稳定的突变株。PCR检测结果表明,质粒pUC-JS已成功导入突变株中,转化子既有单拷贝也有多拷贝,白化菌株单拷贝插入频率为40%。此外,白化玉米弯孢叶斑病菌REMI突变株菌落颜色与野生菌株差异明显,并且在致病性上也明显弱于野生菌株;质粒拯救、测序与blast分析推测插入可能导致FAD3基因功能丧失。
玉米弯孢菌叶斑病菌 REMI 白化菌株 致病性
我国是玉米生产大国和消费大国,产业链长,年度间的丰产与歉收对国家粮食安全和人民生活都有重要影响。然而,近年来玉米弯孢叶斑病[Curvularia lunata(Wakker)Boed.]危害严重,1996-2001年,连续几年该病害大发生,仅辽宁省1996年发生面积就达16.8万hm2,严重地区减产50%以上,有1.6万hm2玉米绝产[1,2]。虽然近几年该病害发生有所减轻,但个别地区仍造成严重损失[3,4]。据报道,玉米弯孢叶斑病菌自然条件下经常有菌株白化现象,并且白化菌株致病性出现变异[5]。
在植物病原真菌中,Lu(1994)首先用REMI插入突变成功标记了玉米小斑病菌(Cochliobolus heterostrophus)Tox1毒素基因位点,随后,该实验室利用质粒拯救的方法克隆了突变基因,即线性聚乙酮醇(linear polyketide)合成酶的基因——PKS1,该酶是T-毒素合成所必需的。Tanaka等(1999)
从日本香梨黑斑病菌Alternaria alternata的984个REMI转化体中鉴定出了3个不能致病,并丧失产生AK-毒素的突变体,分离出了参与AK-毒素生物合成途径的两个基因AKT1和AKT2[6]。目前REMI技术已经广泛应用于真菌尤其是植物病原真菌的研究,并因其高效性已成为植物病原真菌研究中的一种重要手段。本研究利用限制性内切酶介导整合(REMI)技术对该病菌进行遗传转化,旨在探讨玉米弯孢叶斑病菌致病机制。
1 材料与方法
1.1 材料
玉米弯孢叶斑病菌菌株LZ-1(采自山东莱州)由本实验室提供,玉米自交系黄早四由青岛农业大学遗传研究室惠赠。质粒pUC-JS 由筑波大学植物病理研究室惠赠(包含一个潮霉素磷酸转移酶抗性基因hph),有Hind Ⅲ、BamH I、Xab I、Kpn I等多种限制性酶等单酶切位点。
1.2 方法
1.2.1 REMI突变体的制备
1.2.1.1 玉米弯孢叶斑病菌原生质体的制备 玉米弯孢叶斑病菌原生质体制备参考张建萍等[7]方法,并作适当修改。1 g菌体加入25 mL pH7.0缓冲液,再加入5%的DTT,放置摇床上慢速振荡30 min,然后用DF液离心洗涤两次,吸除上清,加入5 mL高渗缓冲液制成悬浮液(1 mL悬浮液加入4 mL STC液:0.7 mol/L 山 梨 醇、Tris-HCl(pH7.5)10 mL、CaCl21.11 g、ddH2O补平至1 000 mL),然后加入4 g/L细胞壁降解酶于80℃,80 r/min振荡4 h,形成原生质体,用500目尼龙筛过滤,滤液2 000 r/min离心去除酶液,用STC液洗涤两次,最后加入5 mL STC液制成原生质体悬浮液。
1.2.1.2 质粒提取及线性化 质粒pUC-JS转化 E. coli 菌株DH5α,质粒提取和 Hind Ⅲ、BamH I和Kpn I酶切参考Akamatsu等[8]方法,略做改进。
1.2.1.3 菌株基因组DNA提取 采用CTAB法提取玉米弯孢叶斑病菌基因组DNA,具体参照George等[9]的方法进行。
1.2.1.4 REMI转化 REMI转化方法参考李波等[10]和张建萍等[11]方法,略加改动。在50 mL离心管中加入线性质粒40 μg、浓度为10 U/μL限制性内切酶 Hind Ⅲ 10 μL、STC液200 μL,配制成酶-质粒混合液,然后向离心管中加入100-200 μL原生质体悬浮液,并使其与酶-质粒混合液混匀,置冰上15-20 min,缓慢向管中加入2 mL 60% PEG,冰浴20-25 min,然后将离心管取出在28℃下放置10-20 min,加入 5 mL预冷的STC液,4℃下4 000 r/min离心15 min,弃上清液,加入3 mL再生培养液,30℃下放置6 h。将培养液倒入培养皿中,然后加入约15 mL预先熔化好的,并且冷却至50℃左右的固体再生培养基,边摇晃边加入潮霉素至浓度为300 μg/mL,在培养基表面铺满一层为止,每个平板约需10 mL,在28-30℃下,培养4-5 d,将能够抗潮霉素的菌落转移到预先倒好的含有潮霉素250 μg/mL的固体PDA培养基上进行2次筛选,获得玉米弯孢叶斑病菌突变株。
1.2.2 玉米弯孢叶斑病菌REMI突变株鉴定
1.2.2.1 突变株的稳定性测定 将2次筛选后获得的转化体转接至不含潮霉素的PDA上,28℃下培养,待长出菌落后,继续转接到不含潮霉素的PDA上,重复7次,再转接到含有潮霉素的PDA上观察培养。
1.2.2.2 突变株的PCR检测 根据抗潮霉素基因序列设计合成引物(大连宝生物公司):hph1上:5'-ATGAAAAAGCCTGAACTC-3';hph2下:5'-CTATTCCTTTGCCCTCGG-3'。
PCR扩增程序:95℃变性5 min;94℃变性1 min,54℃退火0.5 min,72℃延伸1 min,35个循环;72℃延伸10 min。程序结束后扩增产物用0.8%琼脂糖电泳检测。
1.2.2.3 转化子的Southern blot检测 随机挑选5个转化子,以野生型菌株LN-1作为对照,大量法提取转化子和野生型菌株的基因组DNA,用潮霉素磷酸转移酶基因作为探针,Hind Ⅲ酶切转化子和野生型菌株DNA,用Hind Ⅲ酶切的λDNA作为Marker进行Southern blot验证[12]。
1.2.3 转化子生物学测定 选取白化突变株和野生菌株于PDA培养基(均为培养皿直径9 cm,10 mL基质)上培养7 d,测定菌落直径、比较相对产孢量(刮取培养皿中菌体,加入20 mL蒸馏水计算孢子浓度),并进行培养性状观察和生长发育性状检测;另
外,选取转化子接种生长至13叶期的玉米自交系黄早四植株,孢子悬液浓度为106个/mL(含有0.02% Tween20和2%蔗糖溶液),以相同浓度和相同处理的野生菌株(LN-1)为对照。喷雾接种后保湿培养24 h,然后转入正常管理,接种后7 d进行发病情况调查,评价转化子的致病性。
1.2.4 质粒拯救 参照李铁民等[13]方法。提取突变体LN-1-A的DNA,利用SacⅠ消化5-10 μg的DNA,37℃过夜,第二天观察消化的弥撒程度,加入等体积的酚∶氯仿∶异戊醇(25∶24∶1)抽提纯化DNA,于8 000 r/min、4℃下离心10 min,取上清液于另一干净的离心管中,加入1/10体积的3 mol/L NaAc(pH5.2)和70%的乙醇漂洗。溶解DNA于50-100 μL TE中,加100 μL的连接体系(T4 DNA连接酶),16℃温室过夜。65℃处理10 min,灭活。在连接好的DNA体系中加入1/10 体积的NaAc和2倍体积的无水乙醇冰浴沉淀4 h,14 000 r/min离心20 min,去上清,用70%的乙醇漂洗,抽干后溶解于5 μL水中。将样品稀释5-10倍后,取1-2 μL于20-25 μL已经制备好的感受态细胞(DH5α)中,利用Gene Pulser进行电激转化,参数为电压1.7 kv,时间为5.3 ms。将电激后的细胞混入800 μL的SOC中,37℃下振荡培养1 h(80-100 r/min),取出后在含Amp(100 μg/mL)的LB平板上涂匀后,37℃下培养过夜,从平板上挑出长出的克隆点,在含Amp的LB培养基中摇菌提取质粒,电泳检测后测序(上海捷瑞公司)分析。
2 结果
2.1 原生质体制备及纯化条件的确定
试验表明采用改良Fries培养基最有利于原生质体的制备,在6、12、24和36 h提取原生质体检验中,以24 h原生体的产量最高,为3.52×105个,36 h时检测结果显示原生体的数量下降,为0.52×105个,说明菌龄对原生质体制备有影响。细胞壁降解酶的种类及浓度可采用溶壁酶、崩溃酶、蜗牛酶和纤维素酶1∶1∶1∶1混合液,酶解6 h达到原生体数量高峰,10 h开始下降,超过一定时间原生质体开始萎缩,且数量逐渐减少,采用三层擦镜纸过滤后,用STC液洗涤后获得需要的玉米弯孢叶斑病菌原生质体。
2.2 原生质体的再生
在玉米弯孢叶斑病菌(LN-1)菌丝加入裂解酶破坏细胞壁释放原生质体过程中,原生质体随着释放时间长短体积变化较大,最初开始释放时体积相对较小,随着其在渗透液中时间的延长,体积逐渐变大,原生质体呈多角形,其平均直径约为70 μm。为了确定原生质体活性,将得到的原生质体在0.7 mol/L的山梨醇为稳定剂的再生培养基上进行培养,结果显示玉米弯孢叶斑病菌LZ-1的原生质体再生情况良好,经过重复试验得到其再生率达到 30%,可满足REMI转化要求。
2.3 质粒的提取和检测
通过试剂盒提取质粒 DNA,并用其单一酶切位点 Hind Ⅲ对其进行酶切,通过电泳检测其分子量。酶切后得到的DNA分子量略大于5 000 bp,与 pUCJS 给出的图谱5 080 bp相一致,图上仅出现一条带可以判断质粒DNA 酶切已经完全,仅以线性的形态存在,并没有 RNA 或是染色体 DNA 的污染。质粒纯度检测为 OD260/OD280=1.8-2.0,质粒浓度为47.54 μg/μL,浓度和纯度可满足 REMI 转化的要求。
2.4 REMI遗传转化和转化子的获得
在150 μL原生质体悬浮液中加入5 μg酶切质粒和45 U限制性内切酶在聚乙二醇(PEG)存在的条件下冰浴,即可将线性的质粒插入到原生体的染色体DNA上。将转化子在含200 μg/μL 潮霉素的PDA培养基上连续培养5代,都能持续生长,说明潮霉素基因在转化子中稳定表达,初步确定转化成功。经过多次REMI诱导转化,最终获得109个REMI转化子,其中包含5个白化突变株。白化突变体的菌落与野生黑色菌株差异明显,菌丝细胞壁较为透明,菌丝相对细小,产孢数量变少。
2.5 突变体的检测
2.5.1 突变体稳定性的检测 随机选取10个转化子在不含有潮霉素的PDA培养基上连续培养7代后,再经过第二次用含有200 μg/μL 潮霉素的PDA培养基筛选时,所有转化子都可以正常生长,因此可以初步认为该109个转化子即为 LN-1的REMI 转化突变株。5个白化突变株经过继代培养后也证明是稳
定遗传的REMI转化子。图1显示,在PDA培养基中培养7 d,转化子LN-1-A和LN-1-B菌落颜色呈灰白色至白色,与野生菌株黑色差异显著,并且生长速度也有明显差异,一些菌丝的细胞壁较透明,只有少数色素积累,初步确定为黑色素合成途径被阻断突变体。

图1 野生菌株与部分转化子菌落形态
2.5.2 转化子PCR检测 以野生玉米弯孢叶斑病菌LN-1基因组DNA和5个白化转化子基因组DNA作为模板,利用抗潮霉素基因序列设计引物进行PCR扩增。结果(图2)显示,所有的转化子都扩增出目的条带,以抗潮霉素基因的引物1和2进行 PCR扩增时,与阳性对照pUC-JS(CK)相同,所有转化子的特异带都出现在510 bp,而出发菌株LN-1没有出现特异性条带。

图2 利用hph引物对质粒pUC-JS插入LN-1的PCR 检测
2.5.3 转化子Southern blot检测 选取5个转化子,以潮霉素基因作为探针,进行Southern blot检测,杂交结果显示5个转化子都至少有一条杂交带,并在5.0 kb处,再次证明质粒pUC-JS(CK)已经插入到LN-1染色体中。
Southern杂交的5个转化子中,2个为单拷贝插入。在单拷贝转化子中,1个菌株的杂交带比目的条带小,1个杂交带比目的条带大。在3个多拷贝插入的转化子中,都有2个条带,说明质粒pUC-JS在LN-1染色体上可有2个不同的基因插入位点。
2.6 突变体的生物学性状研究
2.6.1 突变体菌株生长速度的测定 对转化子LN-1-A、LN-1-B和LN-1-C进行生长量测定,结果(图3)发现突变菌株的生长速度(菌落直径)与野生菌株差异不显著,但是菌丝形态和菌落密度与野生菌株有明显差异,转化子菌丝一般都较纤细、透明,菌落中菌丝疏松,无黑色素和其它色素产生,而野生菌株除有黑色素产生外,还可以产生一些棕黄色素。

图3 转化子及野生菌株生长速度曲线
2.6.2 突变体菌株产孢量的测定 对供试玉米弯孢叶斑病菌野生菌株LN-1及部分转化子产孢量测定结果表明,野生菌株和转化子的产孢量存在明显差异。图4显示,转化子LN-1-A和LN-1-B与野生菌株比,产孢量明显减少,而LN-1-C转化子比野生菌株的产孢量还有所增加,说明插入片段影响了玉米弯孢叶斑病菌的发育。

图4 转化子产孢量测定
2.6.3 突变体菌株致病性检测 为检测 REMI 转化子(白色突变株)的致病性,选择 REMI 转化子 LN-
1-A、LN-1-B、LN-1-C和野生菌株LN-1分别接种相对感病的玉米自交系黄早四,致病性测定结果(图5)表明,转化子的致病性比野生菌株LN-1的致病性明显减弱,菌株LN-1-A、LN-1-B、LN-1-C只在玉米叶片上形成几个零星的褐色小斑点。

图5 白色菌株和野生菌株接种黄早四后叶片症状
2.7 突变基因克隆
2.7.1 质粒拯救 利用ScaⅠ酶切突变体LN-1-A、LN-1-B基因组DNA,之后利用T4连接酶连接,进行质粒拯救。由于ScaⅠ在介导酶HindⅢ的对侧,因此拯救出的质粒应该去除了含有抗潮霉素基因(hph)。故在克隆体筛选过程中使用抗氨苄青霉素(Amp)作为抗性选择标记,而所得克隆体质粒3.3 kb(图6),说明载体携带了部分的外源基因。
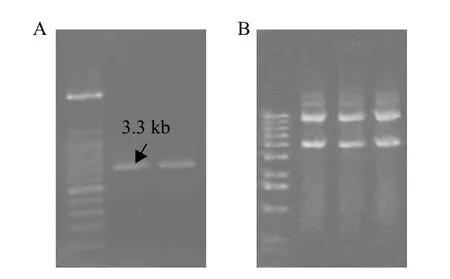
图6 质粒拯救后质粒提取(A)和酶切(B)鉴定
2.7.2 测序与blast分析 拯救的质粒是载体pUCJS连接了一段外源基因的质粒,在利用Amp作为引物对拯救质粒进行基因测序后,经过与pUC-JS的序列比对,测定得到外源序列如图7所示,共427 bp。对该序列进行blast分析显示,其与不饱和脂肪酸脱氢酶(FAD3)具有高度同源性。

图7 外源序列
3 讨论
据报道,在真菌遗传转化中,利用限制性内切酶和线性化质粒方法,可提高其转化效率[14,15]。本研究采用REMI方法,并通过最佳限制性内切酶种类和浓度的选择,获得了玉米弯孢叶斑病菌较适宜转化条件:用3 μg的线性化质粒和40 unit Hind Ⅲ加入到 150 μL原生质体里面,浓度为1×107/mL。采用该方法共获得109个转化子,其中有5个转化子为白色菌株,致病性明显减弱,与传统的微生物诱变技术相比,明显提高了转化效率和转化子单拷贝频率。
本研究在所获得的REMI 转化子中发现致病性减弱与白化现象相关,即菌株白化可能导致病菌致病性减弱,这与鄢洪海等[5]报道相一致。鄢洪海等在辽宁省调查采集玉米弯孢叶斑病样本时,发现了玉米弯孢叶斑病菌白化现象,并在致病性测定时发现了白化菌株致病力较野生黑色菌株弱的特性。通过REMI遗传转化玉米弯孢叶斑病菌获得白化菌株转化子,并通过致病性测定进一步证明了玉米弯孢叶斑病菌这一特性,为以后玉米弯孢叶斑病菌致病机制研究奠定了基础。
通过质粒拯救的方法克隆到了一个与不饱和脂肪酸脱氢酶(FAD3)具有高度同源性的一段基因序列。许多研究表明,不饱和脂肪酸的含量在高等植物抗性中有重要生理功能,它们不仅提供了大
量保守自由能,而且能影响应答各种环境信号的作用[16-18]。ω-3脂肪酸脱饱和酶是不饱和脂肪酸合成途径中催化脂肪酸转化的关键酶,在模式植物拟南芥中人们根据定位差异将该酶进行分类,FAD3基因编码内质网型ω-3脂肪酸脱饱和酶,FAD3在常温下表达[19]。另外,在曲霉菌中,删除一个编码脂肪酸饱和酶基因后,就能阻碍脂肪酸的合成,同时拖延了孢子和菌丝的合成[20]。然而,目前尚不明确不饱和脂肪酸脱氢酶基因(FAD3)与菌株白化及弱致病现象的直接遗传关系,需要今后利用基因敲除或基因沉默等方法进一步研究。
4 结论
本研究采用限制性内切酶介导整合方法(REMI)获得了玉米弯孢叶斑病菌遗传转化子,其中既有单拷贝也有多拷贝转化子。在转化子中有一部分是白色突变体,也有野生色突变体,说明插入位点不只是一个,至少存在2个以上插入位点。而玉米弯孢叶斑病菌白色突变体致病性普遍减弱,说明菌株色素合成与其致病性关系密切。
[1]吕国忠, 刘志恒, 何富刚, 等.辽宁省爆发一种新病害-玉米弯孢菌叶斑病[J]. 沈阳农业大学学报, 1997, 28(1):75-76.
[2]陈捷, 鄢洪海, 高增贵, 等.玉米弯孢菌叶斑病菌生理分化和寄主鉴定结果初报[J]. 植物病理学报, 2003, 4:121-125.
[3]郑战兵.玉米弯孢霉叶斑病发生原因及综合防治[J].河南农业, 2012, 7:32.
[4]李永国, 关占良.东北、华北春玉米生产主栽品种抗玉米弯孢叶斑病、丝黑穗病监测[J].中国植保导刊, 2012, 8:41-44.
[5]鄢洪海, 陈捷, 刘萍, 等.玉米弯孢叶斑病菌白化菌株初报[J].菌物系统, 2002, 21(4):604-606.
[6]Tanaka J, Shiotnai H, Yamamoto M, et al. Insertional mutagenesis and cloning of genes required for biosynthesis of the bots-specific AK-toxin in the Japanese pear Pathotype of Alternaria alternate[J]. Mol Plant-Microbe Interact, 1999, 12:691-702.
[7]张建萍, 朱凯, 杨爽, 等.稗草生防潜力菌 Helminthosporium gramineum Rabehn f. sp. echinochloae的原生质体制备和再生[J].浙江农业学报, 2010, 22(1):14-19.
[8]Akamatsu H, Itoh Y, Kodama M, et al. AAL-toxin-deficient mutants of Alternaria alternata tomato Pathotype by restriction enzymemediated integration[J]. Phytopathology, 1997, 87:967-972.
[9]George MLC, Nelson RJ, Zeigler RS, et al. Rapid population analysis of Magnaporthe grisea by using rep-PCR and endogenous repetitive DNA sequences[J]. Phytopathology, 1998, 88(3):223-229.
[10]李坡, 谷守芹, 刘丽华, 等.玉米大斑病菌REMI体系的建立及突变体分析[J].中国农业科学, 2011, 44(4):716-722.
[11]张建萍, 朱凯, 余柳青.产蛇孢菌素A禾长蠕孢REMI突变体的制备及其筛选[J]. 中国生物防治学报, 2013, 29(3):424-430.
[12]Sambrook J, Fritsch EF, Maniatis T. Molecular cloning a laboratory manual[M]. 2nd. New York(USA):Cold Spring Harbor Laboratory Press, 1989.
[13]李铁民, 孟晋.限制性内切酶介导的整合技术[J].辽宁大学学报:自然科学版, 2005, 32(4):325-327.
[14]Lu S, Lynghholm L, Tagged G, et al. Tagging mutations at the Toxl locus of Cochliobolus heterostrophus by restriction enzyme-mediated integration[J]. Proc Natl Acad Sci, 1994, 91:12649-12653.
[15]Shi Z, Christian D, Leung H. Enhanced transformation in Magnaporthe grisea by restriction enzyme mediated integration of plasmid DNA[J]. Phytopathology, 1995, 85(3):329-333.
[16]Dye JM, Chapital DC, Cary JW, et al. Chilling-Sensitive posttranscriptional regulation of a plant fatty acid desaturase expressed in yeast[J]. Biophys Tes Commun, 2001, 282:1019-1025.
[17]Inoue L, Ohara T, Namiki F, et al. Isolation of pathogenicity mutants of Fusarium oxysporum f. sp. melonis by insertional mutagenesis[J]. Journal of General Plant Pathology, 2001, 67(3):191-199.
[18]代玉华, 刘训言, 孟庆伟, 等.低温胁迫对类囊体膜脂代谢的影响[J].植物学通报, 2004, 21(4):506-511.
[19]Horiguchi G, Fuse T, Kawakami N, et al. Temperature-dependent translational regulation of the ER omega-3 fatty acid desaturase gene in wheat root tips[J]. Plant J, 2000, 24:805-813.
[20]Zhou X, Xu S, Liu L, et al. Degradation of cyanide by Trichoderma mutants constructed by restriction enzyme mediated integration(REMI)[J]. Bioresource Technology, 2007, 98(15):2958-2962.
(责任编辑 马鑫)
Bending Spore of Corn Leaf Spot Fungus REMI Albino Mutant Screening and Determination of Pathogenic Transformation
Xia Shuchun1Wang Xuewu2Zhang Ruqin1Yan Honghai1
(1. College of Agronomy and Plant Protection,Qingdao Agricultural University,Qingdao 266109;2. Qingdao Plant Protection Station,Qingdao 266100)
To investigate bending spore corn leaf spot fungus pathogenic mechanism and genetic variation characteristics, this study using restriction enzymes mediated gene integration technology(REMI)of Curvularia lunata genetic transformation, received 109 stable mutant strains. PCR detection results showed that the plasmid pUC-JS has successfully imported mutant strains, into the son has both single copy and copy, albino strain single copy insert frequency was 40%. In addition, an albino corn bending spore bacteria leaf spot REMI contrast with wild strain of the mutant strains colony color, and also significantly weaker than wild on pathogenic strains. Plasmid save, sequencing and analysis of blast speculated that inserts may result in the loss FAD3 gene function.
Curvularia lunata REMI Albino mutant Pathogenic
10.13560/j.cnki.biotech.bull.1985.2014.12.018
2014-06-05
山东省科技发展项目(2009GG10009022),山东省自然科学基金项目(ZR2011CL005),山东省“泰山学者”建设工程专项经费资助项目(BS2009NY040)
夏淑春,女,副教授,研究方向:植物有害生物综合治理;E-mail:xiashuchun@163.com
鄢洪海,男,博士,教授,研究方向:植物病理生理与分子生物学;E-mail:hhyan@qau.edu.cn

