RNAi技术在抗甲型流感病毒中的研究进展
韩庆功 郑玉姝
(河南科技学院动物科学学院,新乡 453003)
RNAi技术在抗甲型流感病毒中的研究进展
韩庆功 郑玉姝
(河南科技学院动物科学学院,新乡 453003)
RNAi技术广泛应用于防治人类多种疾病病原的药物和疫苗开发中,并取得了巨大的成果。流感病毒极易发生抗原漂移和抗原转变,这给抗流感病毒药物和疫苗的研制提出很大的挑战。RNAi技术的出现给流感的防治提供了新的思路。对近年来国内外利用RNAi技术开发抗流感病毒药物和新型流感疫苗研究现状及前景进行综述,以期为流感的综合防治研究提供参考。
流感病毒 RNA干扰 siRNA miRNA 复制 疫苗
甲型流感病毒是正黏病毒科有囊膜的单股负链RNA病毒,其基因组有8个RNA片段,分别编码病毒复制循环中必需的结构蛋白及非结构蛋白。根据病毒表面糖蛋白的不同,甲型流感病毒可以分为16种HA亚型(H1-H16)以及9种NA亚型(N1-N9),可感染多种宿主,包括禽、猪和人等[1]。从1878年流感发现于意大利至今,全球性的流感大流行已出现多次,给公共卫生安全造成极大的威胁;1918年暴发的西班牙流感(H1N1),造成近4 000万人死亡;1957年的亚洲流感(H2N2)和1968年的香港流感(H3N2),均造成了近百万人死亡;2003年12月,高致病性H5N1禽流感横扫亚洲多国家禽养殖业,造成极大的经济损失;2009年暴发的猪流感(H1N1),共在208个国家得到确诊,累计1.8万人死亡;2013年3月31日中国报道了全球第1例人感染H7N9病例,这是全球首次发现的由新亚型流感病毒引起人的一种急性呼吸道传染病,新型禽流感病毒再次引起人们的关注。截至2014年2月4日共报告286例人感染H7N9禽流感病例,其中60例死亡。张宝等通过序列分析揭示新型H7N9病毒的来源和重组产生模式,推测出此次H7N9病毒流行至少由5个病毒经过4次重组产生,产生两个主要流行株A和B型[2-4]。21世纪以来流感病毒流行爆发的这些新特点引起了世界各国的高度重视,也给流感病毒科研工作者提出了更严峻的挑战。
目前流感病毒防治主要依靠药物及疫苗,药物主要包括离子通道M2阻滞剂和神经氨酸酶抑制剂等化学药,但抗流感病毒药物的长期应用可能产生
耐药性病毒株。而流感疫苗不仅开发周期长,而且不能保护所有亚型的流感病毒感染,在一定程度上也限制了抗流感病毒爆发的效果。RNAi技术的出现为抗病毒研究提供了新思路,为病毒病的治疗提供了一种新的选择。近年来利用RNAi技术研究如何抗流感病毒成为热点。
1 RNA干扰机制
RNAi(RNA interference,RNAi)是高度特异的在mRNA水平上的基因沉默机制,由内源性或外源性dsRNA(Double-stranded RNA,dsRNA)诱发。dsRNA 在细胞内被切割成21-25 nt干扰性小RNA(Small interfering RNA,siRNA),siRNA介导识别并靶向切割同源性靶mRNA分子,从而导致该基因不表达。MicroRNAs(miRNAs)是在真核生物中发现的一类内源性的具有调控功能的非编码RNA,其大小长约20-25个核苷酸。成熟的miRNAs是由较长的初级转录物经过一系列核酸酶的剪切加工而产生的,随后组装进RNA诱导的沉默复合体,通过碱基互补配对的方式识别靶mRNA,并根据互补程度的不同指导沉默复合体降解靶mRNA或者阻遏靶mRNA的翻译。由于RNAi能特异性地抑制基因表达,所以可用于流感病毒感染的治疗及预防[5](图1)。
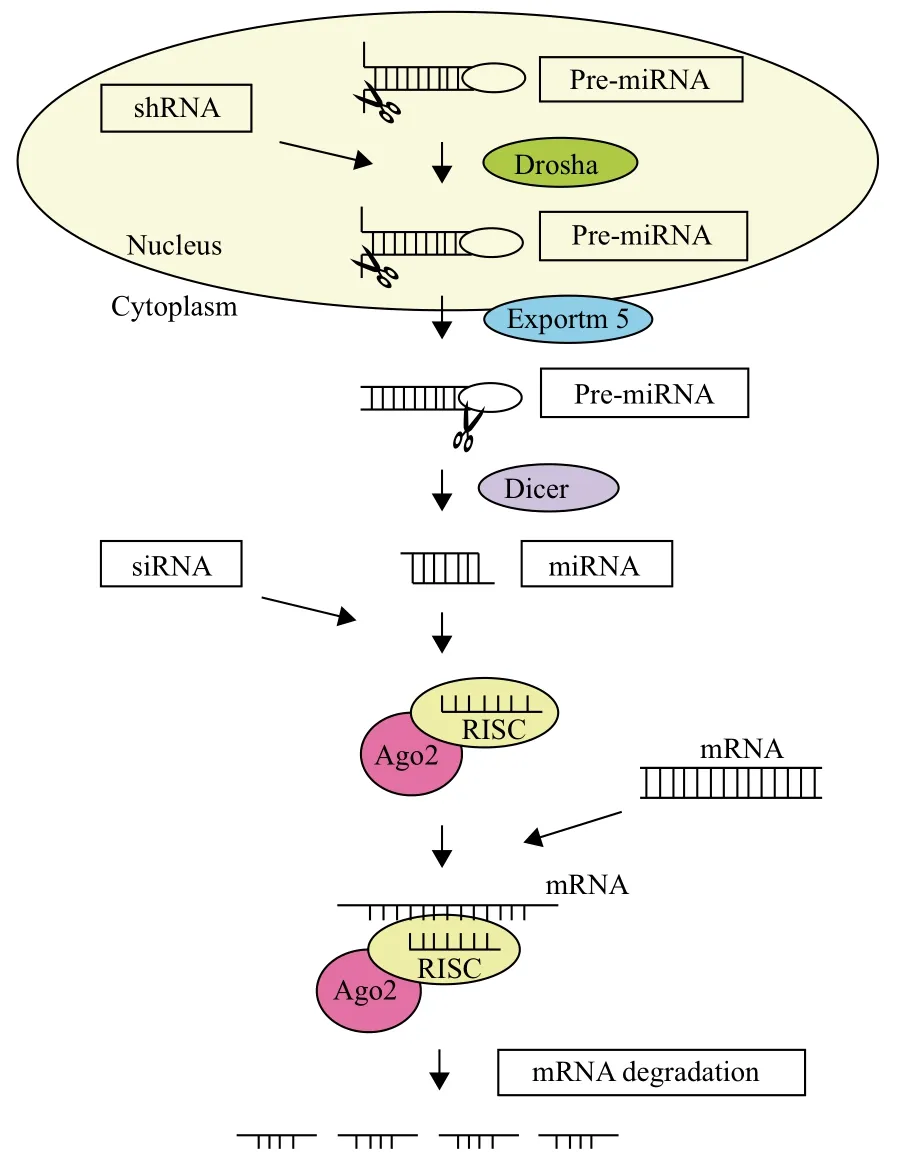
图1 RNAi途径[5]
2 RNAi抗A型流感病毒感染的策略
2.1 siRNA靶向病毒mRNA抗流感病毒感染
因为RNA病毒基因组都比较小,RNA病毒基因几乎都在病毒复制过程中发挥重要作用,理论上沉默病毒中的任何一个基因都可以抑制病毒的繁殖。流感病毒为分节段RNA病毒,其基因组存在高突变和基因重排的特征并因此产生多达15种HA和9种NA亚型,而且每种亚型还拥有众多的病毒株,这给病毒的防治带来巨大的挑战。鉴于上述情况抗流感病毒siRNA的设计一般基于以下几点考虑:(1)由于基因组RNA为NP蛋白所包被,因此siRNA优选靶向病毒mRNA而非基因组RNA;(2)为减少基因漂移和基因重排的影响,siRNA靶向mRNA高度保守区,这样可以同时抑制不同亚型的病毒复制[6]。目前科研人员已经能够设计出靶向流感病毒多个病毒株或多个基因的广谱siRNA药物[7-9]。例如,Sirnaomics公司开发的STP702即同时对H5N1、 H1N1及H3N2型流感病毒有效,虽然该药物仍然没有进入市场获得检验,但其思路值得肯定。
2.2 靶向病毒svRNA抗流感病毒感染
甲型流感病毒包含8个单体RNA片段,每个片段都有两个任务:通过转录过程制造蛋白;通过复制过程制造出新的病毒片段。因为每个单体必须执行两个功能,病毒必须让某一个过程优先完成,先转录然后再开始复制。 最近,西奈山医学院微生物学家 tenOever BR 使用超高通量测序技术首次找到了甲型流感病毒中的一种svRNA,并确定它就是控制病毒从转录过渡到复制的“开关”。在H1N1(Influenza A/PR/34)感染的肺上皮细胞中,90%以上的小RNAs是细胞miRNAs,约0.12%直接来源于流感病毒,而在这些直接来源于流感病毒的小RNA中约有30%为svRNAs(Virus-encoded short vRNAs),由病毒RNA编码,长度为22-27 nt,这些svRNAs可能通过与病毒聚合酶的相互作用调控病毒的转录和复制[10,11]。Umbach等[12]采用同样的方法分析这些病毒RNA编码的svRNAs,也证明了他们的存在。虽然这些svRNA的作用机制和功能仍有待进一步研
究,但是其可能成为抗流感病毒的新靶标,或者本身就是抗流感病毒的候选药物。值得一提的是在流感病毒中,svRNA始终如一地位于病毒RNA片段之间,并且在每种流感病毒中都出现。这个发现意味着或许人们可以通过抑制svRNA影响病毒的复制过程,并最终研制出一种广谱流感病毒RNA药物。
2.3 siRNA靶向细胞mRNA抗流感病毒感染
流感病毒自身只编码11个蛋白,却可以在禽类和哺乳动物众多宿主内复制,这是由于其利用了宿主细胞的众多功能。RNAi技术成为筛选宿主基因组中的病毒复制相关基因的有力工具,研究表明宿主细胞通路中大量蛋白参与流感病毒复制过程[13]。因此,另一种利用RNAi抗流感病毒的方法是下调宿主细胞功能基因,因为宿主基因的突变率非常低,所以用这种方法抗流感病毒可以减少耐药病毒株的出现,而缺点是干扰正常的细胞通路可能带来一些副作用[14]。近几年随着基因组高通量筛选siRNA技术的发展应用,科研人员筛选出一系列流感病毒感染相关基因及其通路[15-17]。这些研究表明诸多宿主细胞基因在流感病毒复制中发挥重要作用。例如,SON、CLK1、ATP6V0D1、COPG、eIF4A3、FGFR,GSK3-β及CAMK2B等。其中包括流感病毒生长的一些基本元件,如nuclear export factors NXF1 和XPO1。靶向这些基因的siRNA在体内试验中均表现出抗病毒特性。因此,利用siRNA下调宿主基因不失为一种抗流感病毒新的候选策略。
2.4 靶向细胞miRNA抗流感病毒
MicroRNA(miRNA)是一类调控基因转录和翻译的小型非编码RNA。作为转录后基因调控因子,miRNA在各种不同的基本生理活动和疾病中发挥作用。2010年,研究发现,miRNA作为关键的效应分子在宿主与病原相互作用中发挥重要功能。细胞miRNA不仅对病毒的复制具有正负调控作用,而且能够通过改变细胞基因表达建立起抗病毒免疫防御反应[18]。显然,研究与流行病和致命性流感病毒有关的特定的microRNA将有助于开发新的抗病毒治疗方法,减少出现病毒耐药的风险。
2.4.1 miRNA调控免疫反应 在动物和其他脊椎动物中,宿主编码的miRNA参与调节了内在的和适应性的免疫应答。美国西北大学的研究团队利用miRNA表达谱芯片分析表明一些内源性的miRNA在两种甲型流感病毒侵染后出现明显的积聚,这些miRNA包括miR-7、miR-132、miR-146a、miR-187、miR-200c和miR-1275[19]。研究表明甲型流感病毒侵染后是通过一个次级应答通路启动初始体miRNA转录。基因表达谱分析发现这些miRNA靶向的26个基因(mRNA),包括IRAK1,MAPK3和其他先天免疫信号系统的组成成员。Lam等[20]的研究也表明禽流感病毒扰乱了宿主miRNA表达,病毒感染 后 miR-21*、miR-100*、miR-141、miR-574-3p、miR-1274a和miR1274b表达改变。其中高表达miR-141能抑制细胞因子-转化生长因子(TGF-β2D)表达,而TGF-β2能够吸引和调控炎症因子,这种改变决定了感染的严重性。国内吉林大学研究团队也发现流感病毒侵染细胞中,miRNA和Bcl-2家族抗凋亡因子蛋白之间存在相互联系。分析发现一些和细胞凋亡有关的miRNA在甲型流感病毒侵染的A549细胞中被激发,其中miR-29c有明显上调并介导了BCL2L2表达抑制和引起细胞凋亡[21]。上述研究都表明任何miRNA都具有潜在的抗病毒作用,从而成为机体防御病毒感染的关键一环。
2.4.2 miRNA影响病毒复制 流感病毒复制依赖宿主基因表达,因此通过miRNA调控宿主基因也会影响病毒的复制能力。Ma等[22]发现宿主microRNA let-7c能抑制人肺表皮细胞感染H1N1病毒的M1蛋白表达,从而抑制病毒复制。Song等[23]也发现miRNA 323((miR-323),miR-491和miR-654靶向PB1基因的同一保守区并抑制H1N1流感病毒的复制。Song等[24]研究感染H1N1流感病毒患者的外周血单核细胞的miRNA变化后发现有多达41种miRNA发现变化。其中miR-31、miR-29a、miR-148a变化显著,并直接影响细胞内多个重要通路和关键基因。此外,Wang等[25]综合分析禽流感病毒感染的鸡肺部miRNA及其靶基因的变化发现,ggamiR-34a、122-1、122-2、146a、155、206、1719、1594、1599和451发生了显著变化。哥伦比亚大学研究者分析了调控猪流感H1N1病毒大流行和高致病性禽流感H7N7的两类不同microRNA发现,有一小类microRNA同时调节这两种病毒感染,靶向
这些miRNA可能开发出潜在的广谱抗流感病毒药物[26]。因此这些miRNA成为潜在的抗病毒治疗靶标。
3 RNAi在流感疫苗开发和生产中应用
3.1 利用miRNA技术提高流感病毒疫苗生产能力
利用传代细胞MDCK和vero细胞生产流感疫苗在近年得到快速发展,但野生型流感病毒和鸡胚疫苗毒株在这些细胞中不能有效繁殖影响了流感疫苗的生产能力,也极大地限制了针对流感病毒的防治。因此,开发新型疫苗毒株和基于细胞生产流感病毒疫苗需提高病毒的生长滴度。RNAi技术为人们提高疫苗的生产能力提供了一条新的可行性途径。
2011 年,RNAi先驱Alnylam制药公司就与葛兰素史克(GSK)公司合作,他们利用RNA干扰(RNAi)技术构建的重组疫苗株同时具有定向沉默某些特意基因的作用,从而抑制或提高流感病毒的繁殖与复制能力。将该重组疫苗株应用于细胞培养技术生产流感疫苗时,可实现增加疫苗生产过程中病毒滴度,从而提高疫苗生产能力[27]。最近日本的科研人员也在此方面取得了令人兴奋的进展,通过筛选与I型干扰素途径密切相关的78个靶基因并设计其shRNA序列,采用RNAi技术敲除相关基因后发现有23个候选基因敲除后能增强流感病毒A/Puerto Rico/8/1934在A549细胞中的繁殖能力。二次筛选后发现,敲除IRF7后能显著抑制IFN-a/b产生,MDCK细胞中病毒滴度显著增加。因此他们认为用RNAi技术敲除IRF7基因后能使疫苗的生产能力得到提高。值得一提的是,该技术还将有益于从临床标本中更容易的分离出疫苗病毒株[28]。
3.2 应用microRNA 靶向性调控能力开发减毒疫苗
MicroRNA转录后小分子调节物还可以用于调节病毒载体的靶向性。因为miRNA主要通过5'端的前2-8 个核苷酸的种子序列(Seed sequence)识别mRNA 3'端非翻译区(3'UTR)来实现在转录后水平上调节基因的表达,所以将含有特定microRNA靶向元件(miRNA target element,miRTE)的靶盒置于目的基因或病毒载体关键元件的3'UTR 区,就能通过内源性的microRNA 来调控目的基因的表达,达到在转录后水平上调节病毒载体的靶向性[29-31]。最近几年,流感活体疫苗因能激活免疫系统的全部元件,成为竞相开发的热点。利用microRNA靶向元件消除病毒副作用为开发具有组织特异性的活体减毒疫苗提供了一条新途径。如果在病毒基因组中插入宿主miRNA的靶序列,在病毒感染宿主细胞的复制增殖过程中,miRNA与病毒RNA 上的靶序列结合,抑制病毒RNA 的翻译和病毒的增殖,从而导致减毒,这就是miRNA 介导的病毒减毒策略。由于其基于机体中固有的miRNA 与人工插入病毒基因组的靶序列互补而介导的翻译抑制,所以此途径适用于各种亚型流感病毒减毒株的构建。miR-93 是哺乳动物机体内普遍存在的一种miRNA,在人和鼠成纤维细胞中的表达是保守的。基于这一特征,Perez等[32]通过点突变的方法在流感病毒核衣壳蛋白保守区引入miR-93 靶序列,分别获得H1N1 和H5N1 亚型流感病毒减毒株。这些减毒株即使高滴度接种小鼠,仍不能使小鼠致病。同时,减毒株免疫原性良好,接种小鼠后可诱导高水平的体液免疫应答,对野毒株的攻击产生完全的免疫保护。更重要的是,由于miR-93 在鸡胚中含量极低,减毒株在鸡胚中的增殖不受抑制,其生长特性与野毒株相同,因此仍能采用鸡胚培养的方式大量制备。这种方法还可以与现有的冷适应流感病毒活疫苗合并使用以进一步增强减毒性疫苗的安性性,减少从实验室逃逸出高传染性流感病毒的几率。
3.3 利用miRNA技术提高流感病毒疫苗效价
人类基因组中有超过30%的基因受miRNA所调控,包括一些重要的免疫相关基因。因此人工利用这些miRNA的RNA干扰效应进行抗病毒是重要的研究领域,而如何在体内有效传输这些RNA小分子到特定细胞群体中是目前的科研瓶颈。澳大利亚的研究人员发现细胞因子信号转导抑制因子(SOCS)作为重要的细胞因子调控子在主动免疫中发挥重要的作用,而miR-155在体内直接靶向SOCS而促进不同的T细胞亚群增值,因此他们利用反向遗传工程使重组流感病毒表达miR-155并侵染细胞调控机体免疫机能,该研究为开发更强免疫效价的流感疫苗奠定了基础。Perez团队也成功将has-miR-142发夹结构插入流感病毒NS基因,重组病毒不仅保持复制能力还能在感染细胞中表达功能性has-miR-142。
流感病毒是RNA病毒,其感染局限于呼吸道,基因整合进宿主的风险也比DNA病毒载体低。鉴于流感病毒减毒疫苗已在临床上证明是安全可靠,Perez认为用流感减毒株来作为载体递送RNA药物治疗呼吸系统疾病不仅高效而且低毒[33]。
4 RNAi技术抗流感病毒的优点及存在挑战
siRNA治疗比常规化学药(如Tamiflu和Relenza)具有某些优势[34]。首先,siRNA药物可以快速合成和规模化制备;其次,当病毒对特定siRNA产生抗性时,可以立即更换靶向病毒的siRNA序列;第三,即便siRNA药物的序列不同,但是其合成方法和工艺完全相同;第四,许多抗流感病毒药物活性有机成分水溶性差,而siRNA极易溶于水,易于药物输送[35]。然而,抗流感病毒siRNA在临床上也面临挑战,其中首要问题即如何有效传输RNA药物至呼吸道。近年来国内外学者利用脂质体传输siRNA治疗流感病毒取得了一些成果,但是这些方法仍存在一定的缺点,不能有效传输到呼吸道表皮细胞[36]。因此国内外学者在脂质体之外又开发出了多种不同的siRNA传输方法。慢病毒介导的RNAi具有转移基因效率高,作用持久稳定等特点,成为基因治疗和基因功能研究的重要工具。田进等[37]利用慢病毒表达靶向禽流感病毒PA、NP和PB2多个基因,成功抑制了病毒的复制。刘文博等[38]利用减毒鼠伤寒沙门氏菌表达禽流感病毒特异性siRNA,体内试验表明其可以产生功能性siRNA,并对机体形成一定的保护力。
5 结语
甲型流感病毒感染是动物病毒性传染病,不仅给养殖畜牧业造成巨大的经济损失,而且严重威胁人类公共卫生安全。虽然目前已开发多种疫苗和抗病毒药物,对流感病毒的防治起到很大促进作用;但是流感病毒变异极快,如何有效控制疾病仍然是摆在流感病毒科研工作人员面前的巨大挑战,这促使人们不断寻求新的防控途径。RNAi的发现改变了人们对细胞基因调控的传统思路,提供了特异性阻断基因表达的新工具为抗流感病毒开辟了新领域。尽管其机制仍未完全弄清,但RNAi技术由于其特异性、稳定性、高效性、靶基因位点的高选择性等突出优势,为流感病毒等流行性疾病提供了新的治疗方案。目前RNAi在各方面的研究日新月异,可以预见随着RNAi技术的逐步应用,其将在人类防控或消灭甲型流感病毒过程中发挥巨大作用。
[1]Knossow M, Skehel JJ. Variation and infectivity neutralization in influenza[J]. Immunology, 2006, 119(1):1-7.
[2]杨帅, 朱闻斐, 舒跃龙. 猪流感病毒概述[J]. 病毒学报. 2013, 29(3):330-336.
[3]张宏伟. H7N9禽流感的病毒特征及其对人类健康的潜在威胁[J]. 第二军医大学学报, 2013, 34(6):591-594.
[4]张宝, 黄克勇, 郭劲松, 等. H7N9病毒的来源和重组模式[J].南方医科大学学报, 2013, 33(7):1017-1021.
[5]Betáková T, Svančarová P. Role and application of RNA interference in replication of influenza viruses[J]. Acta Virol, 2013, 57(2):97-104.
[6]Ge Q, McManus MT, Nguyen T, et al. RNA interference of influenza virus production by directly targeting mRNA for degradation and indirectly inhibiting all viral RNA transcription[J]. Proc Natl Acad Sci USA, 2003, 100(5):2718-2723.
[7]Raza A, Shareef H, Salim H, et al. Selection of predicted siRNA as potential antiviral therapeutic agent against influenza virus[J]. Bioinformation , 2011, 6(9):340-343.
[8]ElHefnawi M, Alaidi O, Mohamed N, et al. Identification of novel conserved functional motifs across most influenza A viral strains[J]. Virol J , 2011, 8:44.
[9]ElHefnawi M, Hassan N, Kamar M, et al. The design of optimal therapeutic small interfering RNA molecules targeting diverse strains of influenza A virus[J]. Bioinformatics, 2011, 27(24):3364-3370.
[10]Perez JT, Varble A, Sachidanandam R, et al. Influenza A virusgenerated small RNAs regulate the switch from transcription to replication[J]. Proc Natl Acad Sci USA, 2010, 107(25):11525-11530.
[11]Perez JT, Zlatev I, Aggarwal S, et al. A small-RNA enhancer of viral polymerase activity[J]. J Virol, 2012, 86(24):13475-13485.
[12]Umbach JL, Yen HL, Poon LL, et al. Influenza A virus expresses high levels of an unusual class of small viral leader RNAs in infected cells[J]. MBio, 2010, 1(4):e00204-e00210.
[13]Meliopoulos VA, Andersen LE, Birrer KF, et al. Host gene targets for novel influenza therapies elucidated by high-throughput RNA interference screens[J]. FASEB J, 2012, 26(4):1372-1386.
[14]DeVincenzo JP. The promise, pitfalls and progress of RNA-interference-based antiviral therapy for respiratory viruses[J]. Antivir Ther, 2012, 17(1 Pt B):213-225.
[15]König R, Stertz S, Zhou Y, et al. Human host factors required for influenza virus replication[J]. Nature, 2010, 463(7282):813-817.
[16]Karlas A, Machuy N, Shin Y, et al. Genome-wide RNAi screen identifies human host factors crucial for influenza virus replication[J]. Nature, 2010, 463(7282):818-822.
[17]Hirsch AJ. The use of RNAi-based screens to identify host proteins involved in viral replication[J]. Future Microbiol, 2010, 5(2):303-311.
[18]张传军, 连海. miRNA调控病毒与宿主细胞相互作用的研究进展[J]. 中国生物制品学杂志, 2010, 23(5):549-553.
[19]Buggele WA, Johnson KE, Horvath CM. Influenza A virus infection of human respiratory cells induces primary microRNA expression[J]. J Biol Chem, 2012, 287(37):31027-31040.
[20]Lam WY, Yeung AC, Ngai KL, et al. Effect of avian influenza A H5-N1 infection on the expression of microRNA-141 in human respiratory epithelial cells[J]. BMC Microbiology, 2013, 13:104.
[21]Guan Z, Shi N, Song Y, et al. Induction of the cellular microRNA-29c by influenza virus contributes to virus-mediated apoptosis through repression of antiapoptotic factors BCL2L2[J]. Biochem Biophys Res Commun, 2012, 425(3):662-667.
[22]Ma YJ, Yang J, Fan XL, et al. Cellular microRNA let-7c inhibits M1 protein expression of the H1N1 influenza A virus in infected human lung epithelial cells[J]. J Cell Mol Med, 2012, 16(10):2539-2546.
[23]Song L, Liu H, Gao S, et al. Cellular microRNAs inhibit replication of the H1N1 influenza A virus in infected cells[J]. J Virol, 2010, 84(17):8849-8860.
[24]Song H, Wang Q, Guo Y, et al. Microarray analysis of microRNA expression in peripheral blood mononuclear cells of critically ill patients with influenza A(H1N1)[J]. BMC Infect Dis, 2013, 13:257.
[25]Wang Y, Brahmakshatriya V, Lupiani B, et al. Integrated analysis of microRNA expression and mRNA transcriptome in lungs of avian influenza virus infected broilers[J]. BMC Genomics, 2012, 13:278.
[26]Loveday EK, Svinti V, Diederich S, et al. Temporal-and strainspecific host microRNA molecular signatures associated with swine-origin H1N1 and avian-origin H7N7 influenza A virus infection[J]. J Virol, 2012, 86(11):6109-6122.
[27]范鸣. Alnylam公司与葛兰素史克公司合作应用VaxiRNA技术提高疫苗生产能力[J]. 药学进展, 2012, 36(5):230.
[28]Hamamoto I, Takaku H, Tashiro M, et al. High yield production of influenza virus in madin darby canine kidney(MDCK)cells with stable knockdown of IRF7[J]. PLoS One, 2013, 8(3):e59892.
[29]Kelly EJ, Russell SJ. MicroRNAs and the regulation of vector tropism[J]. Mol Ther, 2009, 17(3):409-416.
[30]Nilsen TW. Mechanisms of microRNA-mediated gene regulation in animal cells[J]. Trends Genet, 2007, 23(5):243-249.
[31]张国海, 王启钊, 张景红, 等. microRNA 调控的靶向性病毒载体在基因治疗中的应用[J]. 生物工程进展, 2010, 26(6):707-714.
[32]Perez JT, Pham AM, Lorini MH, et al. MicroRNA-mediated speciesspecific attenuation of influenza A virus[J]. Nat Biotechnol, 2009, 27(6):572-576.
[33]Varble A, Chua MA, Perez JT, et al. Engineered RNA viral synthesis of micro RNAs[J]. Proc Natl Acad Sci USA, 2010, 107(25):11519-11524.
[34]Barik S. siRNA for influenza therapy[J]. Viruses, 2010, 2:1448-1457.
[35]Barik S. New treatments for influenza[J]. BMC Medicine, 2012, 10:104.
[36]Thomas M, Ge Q, Lu JJ, et al. Polycation-mediated delivery of siRNAs for prophylaxis and treatment of influenza virus infection[J]. Expert Opin Biol Ther, 2005, 5(4):495-505.
[37]田进, 张在平, 孟庆文, 等. 表达靶向禽流感病毒多靶点miRNA重组慢病毒的制备及病毒感染效率检测[J]. 中国兽医学报, 2010, 30(5):583-587.
[38]刘文博, 张小荣, 曹永忠, 等. 表达禽流感病毒特异性siRNA分子减毒鼠伤寒沙门氏菌的构建[J]. 病毒学报, 2007, 23(2):125-129.
(责任编辑 狄艳红)
Research Advance of RNAi in Anti-influenza Virus
Han Qinggong Zheng Yushu
(College of Animal Science and Veterinary Medicine,Henan Institute of Science and Technology,Xinxiang 453003)
The RNAi technology has been widely used in drug and vaccine development of the prevention and treatment of various kinds of human diseases pathogeny,and has made great achievements.Antigenic drift and antigenic shift extremely easily occurred in influenza virus, which had put forward a bigchallenge for the development of anti-influenza virus drugs and vaccines.The appearance of RNAi technology gived good ideas for the prevention and control of influenza.This paper summarized the research status and prospects of using RNAi technology to develop anti-influenza virus drugs and new influenza vaccine at home and abroad in recent years, in order to provide
for the research for the prevention and control of influenza.
Influenza virus RNA interference siRNA miRNA Replication Vaccine
10.13560/j.cnki.biotech.bull.1985.2014.12.009
2014-04-09
河南省科技厅基础与前沿技术(122300410135)
韩庆功,男,讲师,硕士,研究方向:动物传染病的诊断与防治;E-mail:hanqinggong7606@163.com

