磷脂酶C基因家族研究进展
王法微王骐邓宇,董金晔王南李晓薇李海燕
(1. 吉林农业大学生物反应器与药物开发教育部工程研究中心,长春 130118;2. 吉林农业大学生命科学学院,长春 130118;3. 东北师范大学附属中学,长春 130021)
磷脂酶C基因家族研究进展
王法微1王骐3邓宇1,2董金晔2王南1李晓薇1李海燕1
(1. 吉林农业大学生物反应器与药物开发教育部工程研究中心,长春 130118;2. 吉林农业大学生命科学学院,长春 130118;3. 东北师范大学附属中学,长春 130021)
磷脂酶C(Phospholipase C,PLC)基因是磷脂酶基因家族中的一个成员,它能够水解磷脂酰肌醇4,5-二磷酸生成两个重要的信使分子肌醇三磷酸和二酰甘油。在动物中磷脂酶C基因可以通过调节胞内钙离子的释放以及激活蛋白激酶C来起作用,而植物中磷脂酶C可以参与植物对生物及非生物胁迫的调节,但其作用的具体方式仍不清楚。综述了磷脂酶C基因的研究进展,主要包括基因的分类、结构以及其在不同逆境信号转导中的作用方式。
PLC基因 肌醇三磷酸 二酰甘油 结构 信号转导
磷脂酶是一类能够水解磷脂的酶类,按照其酶解磷脂位置的不同分为磷脂酶D、磷脂酶C、磷脂酶A1和磷脂酶A2,它们均在植物生长发育、生物胁迫及非生物胁迫中起重要的调控作用。磷脂酶C(Phospholipase C,PLC)可以水解磷脂生成一个分子的二酰甘油(diacyl glycerol,DAG)和一个含有磷酸集团的小分子,这两个第二信使分子在很多植物信号转导中具有重要作用[1,2]。1987年,Melin等[3]克隆并鉴定了第一个植物磷脂酶C,并发现该基因受钙离子调控,并且定位于细胞质膜上。随后,Yamamoto等[4]、Shi等[5]、Hirayama等[6]、Zhai等[7]和Vossen等[8]分别克隆了拟南芥、大豆、玉米和番茄的PLC基因,并证实PLC对不同磷脂酰肌醇均具有水解活性。近年来,人们发现PLC在植物对盐、干旱、高温及病害防御反应中具有重要的调节作用,而PLC作用的主要方式为控制底物(PIP2)及其产物IP3、DAG的量来实现的[1,8,9]。但是,PLC通过调节IP3、DAG参与植物各种信号途径的直接证据仍未找到。本文就近十几年来国内外PLC基因的研究进展,阐述其分类以及结构特点,并且综述其参
与不同植物信号转导的方式,为PLC在植物逆境信号转导中的研究进展作一个简要总结。
1 磷脂酶C的分类
磷脂酶C可以水解磷脂生成具有磷酸基团的头部和二酰甘油,其中带有磷酸基团的头部根据底物的不同,又可以是肌醇磷酸、胆碱磷酸和乙醇胺磷酸等。PLC根据作用底物的不同可以分为非特异性PLC(Non-specific PLC,NPC)和磷脂酰肌醇特异性PLC(phosphoinositide-specific PLC,PI-PLC)。NPC可以水解PC、PE、PS、PG和PA[9,10],生成DAG与带有磷酸基团的头部。最初发现NPC时,它与植物中常见的PLC家族基因的关系不大,随着研究的深入,人们发现拟南芥NPC与结核分支杆菌的PLC同源性相近,并且具有3个相似的结构域。虽然NPC没有PLC家族基因的C2、X、Y、EF等结构域,但它仍含有一个磷酸酯酶结构域,能够水解磷脂,所以把它归为PLC家族中的一个亚家族[11];磷脂酶家族的另外一个成员PI-PLC是指信号中的一个重要调控酶。它可以水解磷脂酰肌醇生成DAG与肌醇磷酸,如肌醇二磷酸(Inositol bisphosphate,IP2)和肌醇三磷酸(Inositol triphosphate,IP3)。PI-PLC的功能在动物中已经研究得十分清楚,但是其在植物中的功能人们却知之甚少。
动物中含有的PLC可以分为6类13种,分别为 PLCβ1-4、PLCγ1-2、PLCδ1-5、PLCε、PLCζ和PLCη1-2[12]。在动物中,DAG能够激活蛋白激酶C,IP3可以进入胞液中控制内质网中钙离子的释放。而植物中的PLC分类没有动物中复杂、具体。植物中的PLC分为NPC和PI-PLC。目前,已经发现拟南芥基因组中存在9种PI-PLC、6种NPC和4种普通的PLC[10,13]。水稻基因组中含有9个PLC,其中4个属于PI-PLC,另外5个均为NPC[2]。
2 磷脂酶C的结构
磷脂酶C主要由PH结构域、EF指型结构、X结构域、Y结构域和C2结构域组成。与动物中PLC相比,植物中PLC缺失了PH结构域,结构与动物中的PLCζ类似(图1)[25]。最初PH结构域被形容为一个大小约100个氨基酸残基,在一个蛋白中重复出现两次的结构域。现在已经发现上百种蛋白中含有PH结构域,这些蛋白主要包括丝氨酸/苏氨酸蛋白激酶、酪氨酸蛋白激酶、小G蛋白调节因子、磷脂酰肌醇调控酶类以及细胞骨架相关蛋白等。大多数真核生物PLC中的PH结构域均位于氮端,约130个氨基酸。有报道表明,PLCδ1中的PH结构域可与PIP2结合并促进PLCδ1运动到膜的表面上去[14]。PLCβ2和PLCβ3的PH结构域可以和G蛋白的βγ亚单位特异的结合[15]。PH结构域也可和PIP2相互作用,调控PLCγ1的激活与转运[12,16]。因此可以总结出PH结构域在PLC对底物的结合以及活性的调节起着重要的作用,但植物PLC中并没有PH结构域,植物PLC仍能够水解膜上的磷脂而参与植物不同的生理反应与代谢调控。所以植物PLC的作用方式与动物PLC应该有所不同,其具体作用机制仍需要更多的研究揭示。

图1 PI-PLC的结构域分析[25]
在PLC的PH结构域下游为EF指型结构域,每个PLC基因含有2-4个EF指型结构域,每个EF指型结构域具有1个典型的螺旋-转角-螺旋结构,可以和钙离子相结合。在其他含有EF指型结构域的蛋白中,EF指型结构域也是成对存在的,这种严格成对出现的现象可能与底物结合及钙离子结合相关[17]。如果敲除EF指型结构域可以使钙离子依赖的PLC酶活性降低[18,19]。虽然EF指型结构域对PLC活性的调控起重要作用,但是植物PLC并没有前2个EF指型结构域,只有2个EF指型结构域。另外,相关研究表明,前2个EF指型结构域能够与钙离子及镁离子相结合,而后2个EF指型结构域
却不能[17]。但植物PLC与动物PLC相比,只有后2个EF指型结构域,它们是否能够与钙离子及镁离子结合,以及具体结合机制迄今为止还尚不清楚。
位于EF指型结构和C2结构域之间的X结构域和Y结构域是PLC结构中最保守的两个结构域。这两个结构是由α螺旋和β折叠交互组成,类似于不完整的磷酸丙糖异构酶的α/β barrel结构域,是PLC的催化结构域[20]。在X结构域和Y结构域之间的链接区域非常不保守,它与对PLC的活性调节无关,但这个区域对蛋白水解酶十分敏感,这说明在信号转导中PLC信号的终结可能是从水解这个区域开始的[21]。在所有真核生物中PLC基因的X结构域和Y结构域均十分保守,它对底物的结合及催化具有重要作用。例如,在动物PLCδ1中第438位与第440位的赖氨酸、第522位的丝氨酸以及第549位的精氨酸能与底物中4位与5位的磷酸集团相互作用。第549位的精氨酸直接控制PLC对磷脂酰肌醇(4,5)-二磷酸的水解,而该位点氨基酸突变后PLC将会水解磷脂酰肌醇[22]。虽然PLC中X结构域和Y结构域均十分保守,但也存在特殊情况,这就是拟南芥AtPLC8及AtPLC9。拟南芥AtPLC8及AtPLC9的Y结构域缺失了一部分片段,这将影响PLC的水解活性。但是,在对拟南芥plc9突变体的研究中发现,突变体较野生型植株对热处理尤为敏感[1]。
在所有植物PI-PLC中均包含一个C2结构域,这个区域与磷脂及钙离子的结合相关。在马铃薯水稻的PI-PLC中,C2结构域中的疏水残基与K-(K,R)-T-K多元区域能够控制C2结构域特异的与带负电荷的磷脂相结合[23]。在一些植物中,C2结构域调控PLC附着于细胞膜上,在缺失EF指型结构域时C2结构域仍能完成这项任务[24]。虽然植物中PLC的4种结构域比较保守,但是它们各自的功能还需要进一步的研究才能确定。
3 磷脂酶C信号转导途径
PLC中的NPC和PI-PLC在信号转导中均起着非常重要的作用。NPC可以水解磷脂生成一个分子的DAG和一个含有磷酸基团的头部。DAG作为重要的第二信使分子早已经在动物研究中得非常透彻了,主要功能为激活蛋白激酶C(Protein kinase C,PKC)从而激活一系列信号传递级联途径[26-29]。近期的研究表明,拟南芥中NPC4水解生成的DAG可促使DGDG生成,但并不能产生PA[10,30]。最新研究结果表明NPC4突变后抑制ABA诱导的PA生成,说明在ABA信号系统中一部分PA来源于NPC4水解生成的DAG[9],NPC是否能通过DAG调节PA的量还需要更多的实验证实。另外,NPC水解的另一个产物——具有磷酸基团的头部可以充当磷的供体,当机体内磷元素缺乏的时候会诱导NPC的表达与活化,生成更多的带有磷酸基团的产物,最后转化成磷元素供给机体代谢所需[10]。
PI-PLC是典型的PLC,动植物中多数的PLC均为PI-PLC。PI-PLC可以水解PI(4,5)P2生成两个信使分子IP3和DAG。而最近的研究结果显示,PIPLC也可以水解PI(4)P,生成IP2和DAG[25]。早在1983年就已经证实IP3可以促使内质网中储存的钙离子释放出来,此项结果发表在Nature上[31]。之后的许多对不同组织中的研究证明了这个试验结果[32-34]。IP3也被认为是促使钙离子释放的第二信使[35-37]。IP3/Ca2+信号系统在细胞中可以参与调控细胞的诸多生理过程。它可以直接产生钙离子,也可以通过其他信号系统来产生钙离子[38-41]。IP2和IP3在体内可以转化为IP6,再诱导钙离子的释放[42,43]。
作为PLC的另外一个产物,动物中DAG的主要作用靶蛋白就是蛋白激酶C。有报道显示在鼠卵的精子中PKC的活性高于其他组织[28,44]。此外,小鼠中不仅具有常见的钙离子和DAG可激活的α、β和γ类型的PKC,还具有一个新的DAG可激活的δ类型PKC以及非典型的ζ、λ类PKC,钙离子和DAG也无法激活非典型的ζ、λ类PKC[26,29,30],这些PKC的存在与作用可能与PLC相关。但是在植物中并不存在PKC,那么DAG是通过何种方式来发挥作用,植物中PLC水解生成的DAG可以被二脂酰甘油激酶(Diacyl glycerol kinase,DGK)磷酸化而生成PA,PA作为新兴的第二信使分子已经被证实广泛存在于动植物的各种细胞功能之中[45-47]。植物中的DAG可以通过转化为PA来行使其功能。
4 动植物磷脂酶C信号途径的异同
磷脂酶C参与植物生长发育以及逆境反应的主要方式是通过其酶解产物实现,这个结论是从动物研究中得出的,而其在植物中的具体作用方式仍不清楚。迄今为止,在植物中一直没有发现PLC下游信号中的两个重要调节因子,即IP3的受体和蛋白激酶C。现在众多植物的基因组已经完全测序,包括拟南芥、水稻、大豆、番茄和杨树等植物。还有许多EST文库,在这些庞大的数据库中都未发现编码IP3受体的基因[48]。但是在衣藻中发现了一个IP3受体,其他有纤毛的生物体如草履虫也发现含有IP3受体,这说明高等植物可能在进化过程中丢失了IP3受体。植物中丢失了IP3受体后,IP3通过何种方式起作用,IP3在动物中何以促使胞内钙离子的释放,而Chlieh等[42]的研究结果表明,植物中IP3并不能直接调节胞内钙离子的释放,而IP6是促进钙离子释放的主要因素。植物体内生成的IP3会被迅速磷酸化成IP6,促使钙离子释放[42,43]。这在一定程度上诠释了植物中IP3受体丢失的原因,动物中IP3通过与其受体相互作用而传递信号;而在植物中IP3是通过进一步磷酸化为IP6行使功能的。磷脂酶也参与了G蛋白信号途径,动物中的Gα亚基可以与PLCβ1相结合,并增强PLCβ1的活性[49]。在植物中也发现了PLC与G蛋白互作的例子,如通过酵母双杂交试验证明了豆科植物中的PsPLC可以与PsGα1相互作用,免疫共沉淀试验也证明了这一点,PsPLC与G蛋白相互作用后调节植物对盐及热的耐受能力[50]。
在植物中不仅没有发现IP3受体,而且也没有发现DAG能够激活的蛋白激酶C[25]。在动物中,PKC作为DAG的重要靶点,可以激活转录因子NFKappaB(Nuclear factor-KappaB),NF-KappaB在肿瘤发生的调控过程中起重要作用[51]。在植物中却没有蛋白激酶C,植物中PLC水解产生的DAG是通过何种途径参与信号转导的,Ruelland等[52]发现在盐、低温、微生物病害以及高渗胁迫时植物中的DAG可以被二酰甘油激酶(DAG kinase,DGK)磷酸化生成磷脂酸,磷脂酸可以调节植物对逆境进行应答,并作出抵抗反应(图2)[25]。但是,人们暂时无法确认DGK磷酸化的DAG是来源于PLC还是其他磷脂酶的水解产物,所以仍需要进一步试验证实这个推测。
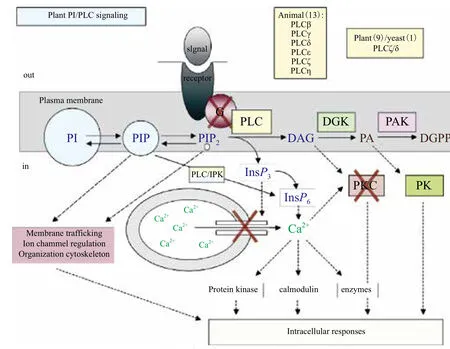
图2 动植物磷脂酶C信号通路之间的异同[25]
5 磷脂酶C与磷脂酰肌醇信号系统
磷脂酰肌醇信号转导中存在诸多酶类,其中主要分为两类:一类为包括PLA、PLC和PLD的水解酶;另一类为包括的磷脂酰肌醇一磷酸4激酶(Phosphoinositide phosphate 4-kinase,PIP4K)、磷 脂 酰 肌 醇 一 磷 酸5激 酶(Phosphoinositide phosphate 5-kinase,PIP5K)和磷脂酰肌醇4激酶(Phosphoinositide 4-kinase,PI4K)等的磷酸酶[53]。在拟南芥中已经证实了12个PI4K[54]、15个PIP5K[53]、12个PLD[55]和9个PLC[13,54]。水稻中也含有10个PIP5K、11个PI4K[53]、17个PLD[56]和4个PLC[13]。这些酶所参与的磷脂信号在诸多生理过程中起着重要作用。
在盐胁迫下拟南芥中的PIP2含量会迅速上升,说明PIP2在植物盐胁迫中起重要作用[57]。PIP2及其被水解生成的IP3在盐、干旱和低温胁迫下均能够迅速积累,而sac9(Suppressor of actin,SAC)突变体却可以明显抑制这种积累[58]。SAC9的缺失严重抑制了植株的正常生长。最新研究结果显示,盐处理诱导披网格蛋白小泡(Clathrin-coated vesicles)中的PIP2的积累和PI3K调控的胞吞作用对植物对盐胁迫的适应是很重要的[59,60],这些也说明了在盐胁迫中细胞内囊泡运输的重要性。磷脂酰肌醇生物合成体系中的各个成分均在不同生理过程中起调控作用,其中又以PIP2的作用较为重要,所以对PI4K和PLC的研究显得尤为重要。
6 展望
近年来,随着植物生理学与植物分子生物学研究的深入,人们发现植物磷脂酶C基因在植物逆境信号转导中起着重要作用。然而,对于其功能的研究主要集中于其水解产生的两个第二信使分子(IP3与DAG),但到目前为止仍没有直接证据表明由PLC水解生成的IP3/DAG与下游信号分子PA/Ca2+之间具有直接联系。Ca2+与PA均是重要的植物第二信使分子,它们能够调节植物生长发育以及植物抗逆性等多种生理过程。植物PLC参与的信号转导网络较为复杂,并且下游靶分子的鉴定仍缺少证据,但是人们越来越重视对PLC的研究工作。目前,PLC基因的结构以及在植物逆境胁迫下的作用已经得到了初步的证实。后续研究将主要针对PLC是否可以通过DAG/PA调节Ca2+与PA,以及在不同逆境胁迫中PLC对生成Ca2+与PA的贡献率问题。对PLC基因功能的深入研究将进一步揭示植物生长发育以及抵抗不同外源胁迫后的生理反应,一方面能够填补PLC基因在这个领域的空白,另外也能够为利用基因工程手段改良植物抗逆性提供优质候选基因。
[1]Zheng SZ, Liu YL, Li B, et al. Phosphoinositide-specific phospholipase C9 is involved in the thermotolerance of Arabidopsis[J]. Plant J, 2012, 69(4):689-700.
[2]Singh A, Kanwar P, Pandey A, et al. Comprehensive genomic analysis and expression profiling of phospholipase C gene family during abiotic stresses and development in Rice[J]. PLoS One, 2013, 8(4):e62494.
[3]Melin PM, Sommarin M, Sandelius AS, et al. Identification of Ca2+-stimulated polyphosphoinositide phospholipase C in isolated plant plasma membranes[J]. FEBS Letters, 1987, 223(1):87-91.
[4]Yamamoto YT, Conkling MA, Sussex IM, et al. An Arabidopsis cDNA related to animol phoshpoinositide-specific phospholipase C genes[J]. Plant Physiol, 1995, 107(3):1029-1030.
[5]Shi JR, Gonzales RA, Bhattacharyya MK. Characterization of a plasma membrane-associated phosphoinositide-specific phospholipase C from soybean[J]. Plant J, 1995, 8(3):381-390.
[6]Hirayama T, Mitsukawa N, Shibata D, et al. AtPLC2, a gene encoding phosphoinositide-specific phospholipase C, is constitutively expressed in vegetative and floral tissues in Arabidopsis thaliana[J]. Plant Mol Biol, 1997, 34(1):175-180.
[7]Zhai SM, Sui ZH, Yang A, et al. Charaterization of a novel phosphoinositide-specific phospholipase C from Zea may sans its expression in Escherichia coli[J]. Biotech Lett, 2005, 27(11):799-804.
[8]Vossen JH, Haliem AA, Fradin EF, et al. Identification of tomato phosphatidylinositol-specific phospholipase-C(PI-PLC)family members and the role of PLC4 and PLC6 in HR and disease resistance[J]. Plant J, 2010, 62(2):224-239.
[9]Peters C, Li M, Narasimhan R, et al. Nonspecific phospholipase C NPC4 promotes responses to abscisic Acid and tolerance to hyperosmotic stress in Arabidopsis[J]. Plant Cell, 2010, 22(8):2642-2659.
[10]Nakamura Y, Awai K, Masuda T, et al. A novel phosphatidycholinehydrolyzing phospholipase C induced by phosphate starvation in Arabidopsis[J]. J Biol Chem, 2005, 280(9):7469-7476.
[11]Pokotylo I, Pejchar P, Potocky M, et al. The plant non-specific phospholipase C gene family. Novel competitors in lipid signaling[J]. Prog Lipid Res, 2013, 52(1):62-79.
[12]Suh P, Park J, Manzoli L, et al. Mutiple roles of phosphoinositidespecific phospholipase C isozymes[J]. BMB Report, 2008, 41(6):415-434.
[13]Tasma I, Brendel V, Whitham SA, et al. Expression and evolution of the phosphoinositide-specific phospholipase C gene family in Arabidopsis thaliana[J]. Plant Physiol Bioch, 2008, 46(7):627-637.
[14]Paterson H, Savopoulos J, Perisic O, et al. Phospholipase C delta 1 requires a pleckstrin homology domain for interaction with the plasma membrane[J]. Biochem J, 1995, 312(3):661-666.
[15]Wang T, Dowal L, EI-Maghrabi MR, et al. The pleckstrin homology domain of phospholipase C beta(2)links the binding of gbetagamma to activation of the catalytic core[J]. J Biol Chem, 2000, 275(11):7466-7469.
[16]Falasca M, Logan S, Lehto VP, et al. Activation of phospholipase C gamma by PI 3-kinase-induced PH domain-mediated membrane targeting[J]. EMBO J, 1998, 17(2):414-422.
[17]Cai J, Guo S, Lomasney JW, et al. Ca2+-independent binding of anionic phospholipids by phospholipase C δ1 EF-hand domain[J]. J Biol Chem, 2013, 288(52):37277-37288.
[18]Nakashima S, Banno Y, Watanabe T, et al. Deletion and sitedirected mutagenesis of EF-hand domain of phospholipase C-delta 1:effects on its activity[J]. Biochem Biophys Res Commun, 1995, 211(2):365-369.
[19]Otterhag L, Sommarin M, Pical C. N-terminal EF-hand-like domain is required for phosphoinositide-specific phospholipase C activity in Arabidopsis thaliana[J]. FEBS Lett, 2001, 497:165-170.
[20]Essen L, Perisic O, Cheung R, et al. Crystal structure of a mammalian phosphoinositide-specific phospholipase C delta[J]. Nature, 1996, 380(6575):595-602.
[21]Kuroda K, Ito M, Shikano T, et al. The role of X/Y linker region and N-terminal EF-hand domain in nuclear translocation and Ca2+oscillation-inducing activities of phospholipase Cζ, a mammalian egg-activating factor[J]. J Biol Chem, 2006, 281:27794-27805.
[22]Wang LP, Lim C, Kuan Y, et al. Positive charge at position 549 is essential for phosphatidylinositol 4, 5-bisphosphate-hydrolyzing but not phosphatidylinositol-hydrolyzing activities of human phospholipase Cδ1[J]. J Biol Chem, 1996, 271:24505-24516.
[23]Rupwate SD, Rajasekharan R. C2 domain is responsible for targeting rice phosphoinositide specific phospholipase C[J]. Plant Mol Biol, 2012, 78(3):247-258.
[24]Helling D, Possart A, Cottier S. Pollen tube tip growth depends on plasma membrane polarization mediated by tobacco PLC3 activity and endocytic membrane recycling[J]. Plant Cell, 2006, 18(12):3519-3534.
[25]Munnik T, Testerink C. Plant phospholipid signaling:“in a nutshell”[J]. Journal of Lipid Research, 2009, 50 Suppl:S260-265.
[26]Baluch P, Koeneman B, Hatch K, et al. PKC isotypes in postactivated and fertilized mouse eggs:association with the meiotic spindle[J]. Dev Biol, 2004, 274(1):45-55.
[27]Yu Y, Halet G, Lai FA, et al. Regulation of diacylglycerol production and protein kinase C stimulation during sperm-and PLCζ-mediated mouse egg activation[J]. Biol Cell, 2008, 100(11):633-643.
[28]Tatone C, Dell M, Francione A, et al. Ca2+-independent protein kinase C signaling in mouse eggs during the early phase of fertilization[J]. Int J Dev Biol, 2003, 47(5):327-333.
[29]Halet G. PKC signalling at fertilization in mammalian eggs[J]. Biochim Biophys Acta, 2004, 1742(1-3):185-189.
[30]Gaude N, Nakamura Y, Scheible WR, et al. Phospholipase C5(NPC5)is involved in galactolipid accumulation during phosphate limitation in leaves of Arabidopsis[J]. Plant J, 2008, 56:28-39.
[31]Prentki M, Biden T, Janjic D, et al. Rapid mobilization of Ca2+from rat insulinoma microsomes by inositol 1, 4, 5-triphosphate[J]. Nature, 1984, 309(5968):562-564.
[32]Streb H, Irvine R, Berridge MJ, et al. Release of Ca2+from a nonmitochondrial intracellular store in pancreatic acinar cells by inositol 1, 4, 5-triphosphate[J]. Nature, 1983, 306:67-69.
[33]Biden T, Prentki M, Irvine R, et al. Inositol 1, 4, 5-triphosphate mobilizes intracellular Ca2+from permeabilized insulin-secreting cells[J]. Biochem, 1984, J 223(2):467-473.
[34]Fein A, Payne R, Corson D, et al. Photoreceptor excitation and adaption by inositol 1, 4, 5-triphosphate[J]. Nature, 1984, 311:157-160.
[35]Berridge M. Inositol triphosphate and diacyglycerol as second messengers[J]. Biochem J, 1984, 220:345-360.
[36]Berridge M, Irvine R. Inositol triphosphate, a novel second messenger in cellular signal transducion[J]. Nature, 1984, 312:315-321.
[37]Berridge M. Inositol triphosphate and calcium signalling[J]. Nature, 1993, 361:315-325.
[38]Miyazaki S, Hashimoto N, Yoshimoto Y, et al. Temporal and spatial dynamics of the periodic increase in intracellular free calcium at fertilization of golden hamster eggs[J]. Dev Biol, 1986, 118(1):259-267.
[39]Berridge M. Smooth muscle cell calcium activation mechanisms[J]. J Physiol, 2008, 586(21):5047-5061.
[40]Sanders K, Koy S, Ward S. Interstitial cells of Cajal as pacemakers in the gastrointestinal tract[J]. Annu Rev Physiol, 2006, 68:307-343.
[41]Park M, Petersen O, Tepikin A. The endoplasmic reticulum as one continuous Ca2+pool:visualization of rapid Ca2+movements and equilibration[J]. EMBO J, 2000, 19(21):5729-5739.
[42]Chlieh F, MacRobbie E, Webb A, et al. Inositol hexakisphosphate mobilizes an endomembrane store of calcium in guard cells[J]. Proc Natl Acad Sci USA, 2003, 100(17):10091-10095.
[43]Michell R. Inositol derivatives:evolution and functions[J]. Nat Rev Mol Cell Biol, 2008, 9(2):151-161.
[44]Gallicano G, McGaughey, Capco D. Activation of protein kinase C after fertilization is required for remodeling the mouse egg into the zygote[J]. Mol Report Dev, 1997, 46(4):587-601.
[45]Wang X, Devaiah S, Zhang W, et al. Signaling functions of phosphatidic acid[J]. Prog Lipid Res, 2006, 45(3):250-278.
[46]Zhang Y, Zhu H, Zhang Q, et al. Phospholipase Dα1 and phosphatidic acid regulate NADPH oxidase activity and production of reactive oxygen species in ABA-mediated stomatal closure in Arabidopsis[J]. Plant Cell, 2009, 21(8):2357-2377.
[47]Yu L, Nie J, Cao C, et al. Phosphatidic acid mediates salt stress response by regulation of MPK6 in Arabidopsis thaliana[J]. New Phytol, 2010, 188(3):762-773.
[48]Wheeler G, Brownlee C. Ca2+signalling in plants and green algaechanging channels[J]. Trends Plant Sci, 2008, 13:506-514.
[49]Cocco L, Faenza I, Fiume R, et al. Phosphoinositide-speicifc phospholipase C(PI-PLC)β1 and nuclear lipid-dependent signaling[J]. Biochim Biophy Acta, 2006, 1761:509-521.
[50]Misra S, Wu Y, Venkataraman G, et al. Heterotrimeric G-protein complex and G-protein-coupled receptor from a legume(Pisum sativum):role in salinity and heat stress and cross-talk with phspholipase C[J]. Plant J, 2007, 51(4):656-669.
[51]Xu ZP, Song Y, Yang K, et al. M3 mAChR-mediated IL-8 expression through PKC/NF-KB signaling pathways[J]. Inflamm Res, 2014, 63(6):463-473.
[52]Ruelland E, Cantrel C, Gawer M, et al. Activation of phospholipase C and D is an early response to a cold exposure in Arabidopsis suspension cells[J]. Plant Physiol, 2002, 130(2):999-1007.
[53]Xue H, Chen X, Mei Y. Function and regulation of phospholipid signalling in plants[J]. Biochem J, 2009, 421(2):145-156.
[54]Meijer H, Munnik T. Phospholipid-based signaling in plants[J]. Annu Rev Plan Biol, 2003, 54:265-306.
[55]Qin C, Wang X.The Arabidopsis phospholipase D family:characerization of a calcium-independent and phosphatidylcholineselective PLDζ1 with distinct regulatory domains[J]. Plant Physiol, 2002, 128(3):1057-1068.
[56]Li G, Lin F, Xue H. Genome-wide analysis of the phospholipase D family in Oryza sativa and functional characterization of PLDβ1 in seed germination[J]. Cell Res, 2007, 17(10):881-894.
[57]DeWald D, Torabinejad J, Jones C, et al. Rapid accumulation of phosphatidylinositol 4, 5-bisphosphate and inosiol 1, 4, 5-triphosphate correlates with calcium mobilization in salt-stressed Arabidopsis[J]. Plant Physiol, 2001, 126(2):759-769.
[58]Williams M, Torabinejad J, Cohick E, et al. Mutations in the Arabidopsis phosphoinositide phosphatase gene SAC9 lead to overaccumulation of PtdIns(4, 5)P2 and constiutive expression of the stress-response pathway[J]. Plant Physiol, 2005, 138(2):686-700.
[59]Konig S, Hoffmann M, Mosblech A, et al. Determination of content and fatty acid composition of unlabeled phosphoinositide species by thin-layer chromatography and gas chromatography[J]. Anal Biochem, 2008, 378(2):197-201.
[60]Leshem Y, Seri L, Levine A. Induction of phosphatidylinositol 3-kinase-mediated endocytosis by salt stress leads to intracellular production of reactive oxygen species and salt tolerance[J]. Plant J, 2007, 51(2):185-197.
(责任编辑 狄艳红)
Advance in the Research of Phospholipase C Gene Family
Wang Fawei1Wang Qi3Deng Yu1,2Dong Jinye2Wan Nan1Li Xiaowei1Li Haiyan1
(1. Ministry of Education Engineering Research Center of Bioreactor and Pharmaceutical Development,Jilin Agricultural University,Changchun 130118;2. College of Life Science,Jilin Agricultural University,Changchun 130118;3. High School attached to Northeast Normal University,Changchun 130021)
Phospholipase C(PLC)is a key member from phospholipase family, it cleaves phosphatidylinositol 4, 5-bisphosphate(PIP2)into diacylglycerol(DAG)and inositol 1, 4, 5-trisphosphate(IP3). In animals, PLCs are recognized as key components of signals through specific targets, such as protein kinase C or Ca2+-dependentsignaling networks. In plants, PLCs were characterized to regulate several abiotic and biotic stresses, but the mechanism of it are still unknown. In this review, we focused on the classification, structure, and the functions in different signal transduction.
PLC gene Inositol trisphosphate Diacylglycerol Structure Signal transduction
10.13560/j.cnki.biotech.bull.1985.2014.12.006
2014-04-25
国家自然科学基金项目(31201144,31271746),教育部高等学校博士学科点专项科研基金(20122223120003),吉林农业大学国家大学生创新创业训练计划项目(201410193036)
王法微,男,助理研究员,硕士生导师,研究方向:植物分子生物学;E-mail:fw-1980@163.com
李海燕,女,教授,博士生导师,研究方向:植物分子生物学;E-mail:hyli99@163.com

