耳鸣大鼠耳蜗基底膜内毛细胞Otoferlin mRNA及蛋白表达的研究
王晓宏,赵久晗,孙永新,徐爱华
(中国医科大学附属第一医院1.神经内科;2.康复科,沈阳110001)
耳鸣大鼠耳蜗基底膜内毛细胞Otoferlin mRNA及蛋白表达的研究
王晓宏1,赵久晗1,孙永新2,徐爱华2
(中国医科大学附属第一医院1.神经内科;2.康复科,沈阳110001)
目的研究耳鸣大鼠耳蜗基底膜内毛细胞耳畸蛋白(Otoferlin)表达的变化,从而推测其在耳鸣的发生中可能的作用机制。方法将24只Wistar大鼠随机分成空白对照组、生理盐水组和耳鸣模型组3组,每组8只。通过腹腔注射水杨酸钠制造耳鸣模型并用饮水抑制法对耳鸣模型进行验证。造模成功后,运用实时荧光定量RT-PCR方法及Western blot方法检测Otoferlin的表达情况。结果采用水杨酸钠注射方法成功建立了大鼠耳鸣模型;与空白对照组相比,生理盐水组大鼠OtoferlinmRNA和蛋白表达无明显变化(P>0.05),而耳鸣模型组OtoferlinmRNA及蛋白表达水平显著升高(P<0.05)。结论耳鸣大鼠耳蜗基底膜内毛细胞OtoferlinmRNA及蛋白质合成改变,可能是耳鸣产生的机制之一。
耳鸣;水杨酸钠;耳畸蛋白;耳蜗基底膜
耳鸣是无外界相应声源刺激下而被机体感知的一种响声。根据文献报道,持续性耳鸣患者约占总人口的10%,其中约有2%~5%的耳鸣人群生活质量严重下降[1]。目前,耳鸣发病机制尚不十分清楚,也无有效的治疗措施。研究表明,耳蜗内毛细胞带状突触在声音信号的释放和传递中起关键作用[2]。以往对耳鸣机制的研究主要集中在大脑皮层及耳蜗的内、外毛细胞、血管纹、螺旋神经元等部位,但对声音信息传递给中枢神经系统的第一个传入神经突触-内毛细胞带状突触,却一直未给予充分重视。
耳畸蛋白(Otoferlin)是近年来在耳蜗内毛细胞中发现的一种新的蛋白质,分子量约230 kDa,主要功能是促使突触囊泡与质膜紧密融合并释放神经递质,对维持正常听力起重要作用[3]。动物实验结果表明,Otoferlin蛋白广泛分布于大鼠的小脑、海马、耳蜗、前庭、耳蜗螺旋神经节、前庭神经核和睾丸等组织[4]。目前,关于耳鸣与耳蜗基底膜内毛细胞中Otoferlin的表达之间的关系尚未见报道。
本研究拟通过水杨酸钠注射诱导并成功建立Wistar大鼠耳鸣模型后,提取耳蜗基底膜,采用实时定量RT-PCR和Western blot的方法检测耳鸣大鼠模型耳蜗基底膜内毛细胞中Otoferlin的表达情况,从而推测其在耳鸣发生中可能的作用机制,为耳鸣的临床治疗及新药研发提供参考。
1 材料与方法
1.1 材料
2月龄Wistar大鼠,雌雄不限,体质量200~250 g,由中国医科大学动物中心提供。兔抗鼠Otoferlin多克隆抗体(美国ABcam公司);辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗鼠二抗(美国SANTA公司);水杨酸钠粉剂(国药集团化学试剂有限公司);声级计(香港希码声级计AR824,宁波凯诺仪器有限公司);大鼠操作性条件反射箱系统(宁波安来软件科技有限公司)。
1.2 方法
1.2.1 实验动物及分组:选用ABR听阈正常2月龄Wistar大鼠,排除中耳及内耳疾病,随机分为耳鸣模型组、生理盐水对照组和空白对照组3组,每组8只。耳鸣模型组:采用10%水杨酸钠腹腔注射(350 mg·kg-1,每2 d1次)10~14 d;生理盐水对照组:在造模相同时间点,腹腔注射相同体积的生理盐水;空白对照组:将大鼠置于安静环境中,无饮食限制及药物注射,无条件反射训练。
1.2.2 条件反射建立,确立耳鸣动物模型[5,6]:大鼠适应性喂养1周后,禁水1~2 d,使其处于轻度口渴状态。在本底噪声<25分贝声压级(deci Bel sound pressure level,dB SPL)隔声室内的隔音柜里进行实验操作。分别在3、10、15、20、25 min出现条件刺激背景音(8 Hz 50 dB SPL纯音停止,1 min/次)。停止背景音刺激后,如果动物舔水时间持续超过5 s,从饮水嘴处给予电压为50 V的电刺激,次数不限。通过此种训练方式,使动物将电击刺激与噪声停止条件刺激直接建立联系,形成“背景音停止-舔水动作停止或减少”的条件反射。以舔水抑制率(R)判断条件反射是否建立成功。公式为:R=B/(A+B),其中,A为背景音关闭前60 s的舔水时间,B为背景噪声关闭后60 s的舔水时间。当R值<0.2时,说明大鼠条件反射建立成功。保持饲养室内灯光12 h开/关,控制室温22~26℃,湿度30%~60%。成功建立大鼠条件反射后,观察大鼠条件反射消退期的变化,以舔水率R的变化情况为标准,判断大鼠是否产生耳鸣。
1.2.3 耳蜗基底膜制备[7]:成功建立耳鸣大鼠模型后,耳鸣模型组在相同时间段继续腹腔注射水杨酸钠(每2 d1次),并于注射2 h后用颈椎脱臼法处死大鼠,断头后取出颞骨,迅速分离耳蜗,剔除听小骨,开放圆窗和卵圆窗,在解剖显微镜下于PBS液中使用游离丝镊分离耳蜗基底膜顶回,清除前庭膜、盖膜及螺旋韧带,取出全耳蜗基底膜。
1.2.4 实时定量RT-PCR检测OtoferlinmRNA的表达:采用TRIZOL法提取总RNA,用12~18 oligo(dT)和super scriptⅡ进行逆转录,用双标记荧光探针混合物(SYBR Green PCR Master mix)在ABI prism 7500自动序列分析系统(Biosystems)中进行实时PCR分析,每组重复3次。参考GenBank中大鼠基因序列,设计扩增Otoferlin引物。Otoferlin引物序列(NM_001276720.1):上游:5′-GATGCGACTTCTG ATGCT-3′;下游:5′-TCCTCTGCCTCC TCTGA-3′,产物长度98 bp。内参照β-actin引物序列(NM_ 001101.3):上游:5′-TGCGTGACATTAAGGAGAA-3′;下游:5′-AAGGAAGGCTGGAAGAGT-3′,产物长度172 bp。采用2-△△Ct法进行计算,计算公式:(1)改变的倍数=2-△△Ct;(2)ΔΔCT=(实验组CT目的基因-实验组CT内参基因)-(对照组CT目的基因-对照组CT内参基因)。
1.2.5 Western blot检测Otoferlin蛋白表达:将各组耳蜗基底膜放入预冷100 μL细胞裂解液(20 mmol/L Tris-HCl pH7.5,150 mmol/L NaCl,1%Triton X-100,1 mmol/L PMSF,1 μg/mL亮肽素,1 μg/mL抑肽素)超声粉碎,12 000 r/min离心1 h后取上清。酚试剂法测量各组蛋白含量,每组取总蛋白40 μg上样,8%聚丙烯酰胺凝胶电泳。电泳后,50V 2 h将蛋白转移至硝酸纤维素膜上。使用TTBS洗膜后,将其置入含5%脱脂奶粉的TTBS溶液中4℃封闭过夜。TTBS清洗后,加入1∶800稀释的兔抗鼠一抗(Otoferlin和β-actin抗体),室温下孵育2 h。TBS洗膜,加入辣根酶标记山羊抗兔二抗(1∶10 000),室温下孵育2 h。ECL发光成像,ImageJ图象分析软件对印迹条带进行灰度值分析。
1.3 统计学分析
2 结果
2.1 耳鸣动物模型的建立
经过训练,动物成功建立了“背景音停止-舔水动作停止或减少”的条件反射。同时,在条件反射建立后,耳鸣模型组动物消退时间[(1.74±0.67)d]均明显快于生理盐水对照组[(4.56±0.81)d],差异有统计学意义(P<0.05),说明耳鸣模型组动物全部造模成功。
2.2 各组大鼠耳蜗基底膜细胞中OtoferlinmRNA表达的变化
提取总RNA后,紫外分光光度计测定OD260/280比值约2.0,说明所提取的RNA较纯,无蛋白质污染。如图1所示:空白对照组、生理盐水对照组和耳鸣模型组OtoferlinmRNA表达水平分别为1.0± 0.01、0.99±0.02和5.86±0.68。与空白对照组相比,生理盐水对照组的OtoferlinmRNA表达无明显变化(P>0.05),而耳鸣模型组表达则显著升高(P<0.05)。提示Otoferlin在正常及耳鸣大鼠耳蜗基底膜中均有表达,且耳鸣大鼠表达升高。
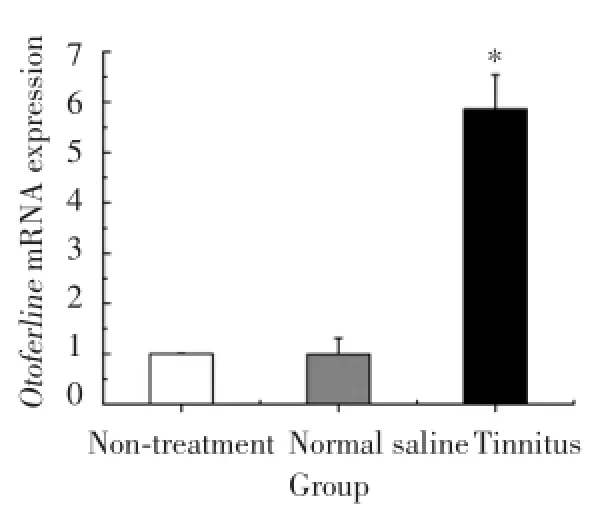
图1 各组大鼠耳蜗基底膜细胞中Otoferlin mRNA的表达情况Fig.1 Otoferlin mRNA expressions in inner hair cells of basilar membrane of rats
2.3 各组大鼠耳蜗基底膜细胞中Otoferlin蛋白表达的变化
采用Western blot方法检测了各组大鼠耳蜗基底膜细胞中Otoferlin蛋白的表达情况,结果如图2所示:空白对照组、生理盐水对照组和耳鸣模型组Otoferlin蛋白相对于内参蛋白β-actin的表达比值分别为0.39±0.12、0.41±0.13和0.75±0.21。Otoferlin蛋白表达变化情况与其mRNA表达情况相似。与空白对照组相比,生理盐水对照组Otoferlin蛋白表达无明显变化(P>0.05),而耳鸣模型组则显著升高(P<0.05)。提示Otoferlin蛋白在各组大鼠耳蜗基底膜细胞中均匀表达,且耳鸣大鼠表达明显升高。
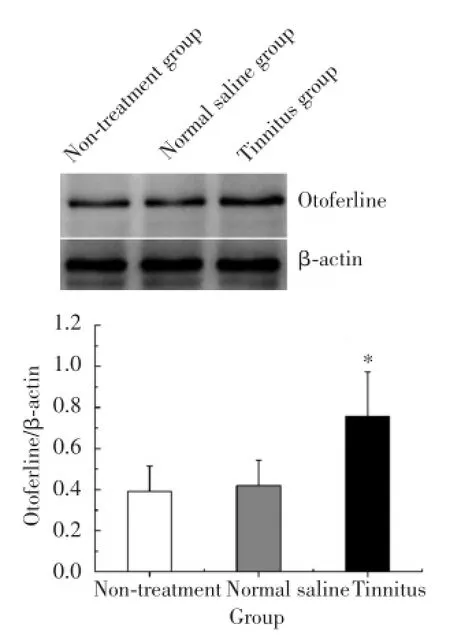
图2 各组大鼠耳蜗基底膜细胞中Otoferlin蛋白的表达情况Fig.2 Expressions of Otoferlin protein in inner hair cells of basilar membrane of rats
3 讨论
目前,耳鸣发生的机制尚未明了。尽管有许多有关耳鸣的假说,但均未能全面阐述所有的耳鸣现象。Otoferlin是一种具有6个钙离子结合区域(C2区域)的特殊跨膜蛋白质,由OTOF基因编码。研究表明,Otoferlin蛋白后4个C2区域由5个完整的天冬氨酸残基组成,可与钙离子结合。同时,这些C2区域与其他分子的结合也是钙离子依赖性[8]。研究证明,C2区域能够与磷脂或蛋白质(例如,胞浆磷脂酶A2、突触结合蛋白Ⅰ、Ras相关GTP结合蛋白等)结合,参与神经递质的释放,在细胞膜运输及信号传导方面具有十分重要的作用。研究显示Otoferlin蛋白参与钙离子依赖的突触囊泡融合及神经递质的释放。实验证明,OTOF基因敲除纯合小鼠表现为极重度耳聋,在对小鼠耳蜗切片进行免疫组化染色和胶体金技术标记时发现,小鼠耳蜗内神经细胞中带状突触附近的Otoferlin蛋白约占55%,其中突触前膜的Otoferlin蛋白约占21%、突触部位附近胞质中Otoferlin蛋白约占4%[9,10]。而在这些OTOF基因敲除的小鼠中,内毛细胞与传入神经元所形成的带型突触形态无任何异常变化,同时,Ca2+流通也正常,但其突触囊泡的胞吐功能却完全丧失。因此,Otoferlin可能是一种融合在内毛细胞带状突触前膜的钙离子感应器,对内毛细胞传入突触囊泡的分泌起十分重要的作用[11]。
目前,虽然关于Otoferlin蛋白的结构、表达和功能的研究已经取得了一定的进展,但是关于Otoferlin蛋白与耳鸣疾病的相互关系尚未见报道。因此,本研究利用水杨酸钠腹腔注射方法建立了耳鸣大鼠模型,同时研究Otoferlin在耳鸣大鼠模型耳蜗基底膜细胞中的表达情况。本研究中,根据条件反射消退期的变化情况判断造模动物是否产生耳鸣,如果动物产生耳鸣,则在背景音停止后,动物会把耳鸣当成部分安全的信号,从而加快条件反射的消退。本研究在大鼠建立条件反射后,观察并对比了大鼠条件反射消退期的变化情况,以摄水抑制率R为评价指标判断大鼠是否产生耳鸣。结果证明,在成功建立条件反射后注射水杨酸钠的大鼠产生了耳鸣。当条件刺激背景音出现时,大鼠因耳鸣而无法准确分辨背景音是否停止,因此消退期缩短。耳鸣模型组动物消退时间明显快于生理盐水对照组,差异具有统计学意义(P<0.05),说明耳鸣模型组动物全部造模成功。
本研究分别用实时定量RT-PCR和Western blot的方法检测了各组大鼠耳蜗基底膜细胞中Otoferlin表达的变化情况。结果提示,Otoferlin在正常及耳鸣大鼠耳蜗基底膜中均有表达,与空白对照组相比,生理盐水对照组大鼠OtoferlinmRNA和蛋白表达无明显变化(P>0.05),而耳鸣模型组OtoferlinmRNA和蛋白表达则显著升高(P<0.05)。提示在水杨酸钠注射诱导的大鼠耳鸣动物模型中Otoferlin表达出现了异常。结合以往对Otoferlin蛋白生理功能的研究结果,推测Otoferlin蛋白的功能异常可能是水杨酸钠诱导大鼠耳鸣的原因之一。Otoferlin蛋白与耳鸣疾病之间的关系仍有待于进一步深入研究。
[1]王洪田.耳鸣的诊断治疗新进展[J].实用医学杂志,2005,21(2):114-116.
[2]Zampini V,Johnson SL,Franz C,et al.Burst activity and ultrafast activation kinetics of CaV1.3 Ca2+channels support presynaptic activity in adult gerbil hair cell ribbon synapses[J].J Physiol,2013,591(16):3811-3820.
[3]Roberts WM.Snaring otoferlin′s role in deafness[J].Cell,2006,127(2):258-260.
[4]Schug N,Braig C,Zimmermann U,et al.Differential expression of otoferlin in brain,vestibular system,immature and mature cochlea of the rat[J].Eur J Neurosci,2006,24(12):3372-3380.
[5]陈观印,冯立宁,刘志,等.低剂量水杨酸钠大鼠耳鸣模型的建立[J].中国耳鼻咽喉头颈外科,2012,19(2):77-80.
[6]贾明辉,秦兆冰.耳鸣动物行为学模型的制作[J].听力学及言语疾病杂志,2007,15(1):73-75.
[7]孙建华,王雪峰,柳柯.庆大霉素对内毛细胞带状突触CaV1.3钙离子通道蛋白表达的影响[J].临床耳鼻咽喉头颈外科杂志,2014,28(4):261-264.
[8]Varga R,Kelley PM,Keats BJ,et al.Non-syndromic recessive auditory neuropathy is the result of mutations in the otoferlin(OTOF)gene[J].J Med Genet,2003,40(1):45-50.
[9]Roux I,Safieddine S,Nouvian R,et al.Otoferlin,defective in a human deafness form,is essential for exocytosis at the auditory ribbon synapse[J].Cell,2006,127(2):277-289.
[10]郭旭尧,袁伟,张学渊.Otoferlin蛋白与听毛细胞突触传导[J].听力学及言语疾病杂志,2013,21(3):320-323.
[11]Zak M,Pfister M,Blin N.The otoferlin interactome in neurosensory hair cells:significance for synaptic vesicle release and trans-Golgi network[J].Int J Mol Med,2011,28(3):311-314.
(编辑 王又冬)
Expression of Otoferlin in the Inner Hair CellsofBasilar Membrane in the RatModelof Tinnitus
WANGXiao-hong1,ZHAO Jiu-han1,SUNYong-xin2,XU Ai-hua2
(1.DepartmentofNeurology,The FirstHospital,China MedicalUniversity,Shenyang 110001,China;2.DepartmentofRehabilitation,The FirstHospital,China MedicalUniversity,Shenyang 110001,China)
ObjectiveTo study the expression of Otoferlin in the inner hair cells of basilar membrane in a rat model of tinnitus for their potential roles in tinnitus pathogenesis.MethodsTwenty fourWistarrats were randomly divided into three groups(n=8):group received salicylate as tinnitus models,group treated with normal saline,and the untreated controls.Tinnitus modeling was verified through drinking inhibition following intraperitoneal administration of salicylate.Expression of Otoferlin was examined by real-time RT-PCR and Western blot assays.ResultsTinnitus rat models were successfully established by the intraperitoneal administration of salicylate.Compared with the untreated controls,there were no significant differences of Otoferlin expressions in the normal saline group,at neither mRNA nor protein levels(P>0.05);Otoferlin expressions in tinnitus models group was higher than that in the untreated controls(P<0.05).ConclusionThe expressions of Otoferlin was increased in the inner hair cells ofbasilarmembrane ofratswith tinnitus,which mightbe a mechanism fortinnitus.
tinnitus;salicylate;Otoferlin;basilar membrane
R764.45
A
0258-4646(2014)12-1114-03

