骨形成蛋白7减轻葡聚糖硫酸钠诱导的大鼠结肠炎症及其机制
刘维新,周凤,张绅,任益,王莹,王婷
(中国医科大学附属第一医院消化内科,沈阳110001)
骨形成蛋白7减轻葡聚糖硫酸钠诱导的大鼠结肠炎症及其机制
刘维新,周凤,张绅,任益,王莹,王婷
(中国医科大学附属第一医院消化内科,沈阳110001)
目的探讨骨形成蛋白7(BMP7)治疗葡聚糖硫酸钠(DSS)诱导的大鼠结肠炎症的疗效及其机制。方法健康雄性大鼠60只,随机平均分为正常对照组、DSS组(DSS诱导结肠炎症组)及DSS+BMP7组(BMP7治疗DSS诱导的结肠炎症组),每组20只。正常对照组大鼠饮用灭菌水,DSS组及DSS+BMP7组大鼠每天饮用3.5%的DSS以建立肠炎模型,DSS+BMP7组隔日1次腹腔注射1 mL BMP7(0.1 μg/mL)。于第0、7、14及28天各组分别处死5只大鼠,采用组织学评分方法判断炎症程度,并于第28天采用流式细胞术检测外周血中调节性T细胞(Treg)比例变化,切取结肠组织分别利用实时PCR及Western blot检测Foxp3mRNA及蛋白的表达,采用ELISA法检测血清中转化生长因子β1(TGF-β1)水平。结果第7天时炎症程度DSS+BMP7组和DSS组低于正常对照组(P<0.05),但DSS+BMP7组与DSS组相比无统计学差异(P>0.05);第14和28天时DSS+BMP7组炎症程度高于DSS组(P<0.05),第28天时DSS+BMP7组与正常对照组相比无统计学差异(P>0.05)。第28天时Treg细胞比例DSS组及DSS+BMP7组低于正常对照组,且DSS+BMP7组显著高于DSS组(P>0.05);与正常对照组相比,DSS组和DSS+BMP7组中Foxp3的表达降低,且DSS+BMP7组高于DSS组(P<0.05)。DSS组和DSS+BMP7组细胞因子TGF-β1水平低于正常对照组,且DSS+BMP7组高于DSS组(P<0.05)。结论BMP7可能作用于Treg细胞,减轻DSS诱导的结肠炎性疾病。
骨形态发生蛋白7;调节性T细胞;结肠炎;转化生长因子β1
炎症性肠病是克罗恩病和溃疡性结肠炎的总称[1],目前其发病机制尚未明确,人们认为主要与肠道微生态环境及免疫遗传因素等有关[2]。在诸多因素中,免疫应答异常及过度炎性反应在炎症性肠病中占主要作用[3]。调节性T细胞(regulatory T cell,Treg)是一类在诱导和维持自身免疫耐受中起关键作用的调节性细胞,研究证实Treg细胞主要是CD4+CD25+Treg,通过抑制免疫应答,从而减缓炎症性肠病的进展。骨形成蛋白(bone morphogenetic protein,BMP)是转化生长因子β(transforming growth factor β,TGF-β)超家族成员,对组织的生长、分化具有调节作用,特别是对肺、肾、肠等组织的生成演化具有重要作用。在众多的BMP亚型中,BMP7在肠道广泛表达,BMP7通过刺激TGF-β1的产生对组织器官的修复起重要作用。应用BMP7后,肺部的纤维化状态可以得到明显的改善。还有学者发现,BMP参与了炎症及免疫反应过程,其在心脏、肺组织及肾脏中的作用已有明确报道[4~6],但之前大部分研究都着重于BMP7与组织器官纤维化的关系,在免疫方面尤其是对炎症性肠病的作用目前还未见相关研究。本研究拟通过建立葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导的炎症性肠病大鼠模型,并给予BMP7干预,检测CD4+CD25+Treg细胞的变化及TGF-β1的改变,进一步探讨BMP7对炎症性肠病的作用和可能的机制,为进一步的临床治疗提供新的思路。
1 材料与方法
1.1 实验材料
健康雄性6~8周龄的SD大鼠60只,DSS购自美国Sigma公司;大鼠Treg细胞流式细胞分析染色试剂盒及Trizol试剂购自美国Invitrogen公司;TGF-β1 ELISA试剂盒为美国eBioscience公司产品;逆转录及实时荧光定量PCR试剂盒购自北京百泰克科技有限公司;Western blot配胶试剂盒购自碧云天;Foxp3引物由美国Invitrogen公司合成;Foxp3一抗购自德国CST公司。其余材料均为实验室自备。
1.2 方法
1.2.1 大鼠肠炎模型的建立和分组:将大鼠随机分为正常对照组、DSS组和DSS+BMP7组,每组20只。正常对照组每天饮用灭菌水,DSS组和DSS+BMP7组每天饮用含3.5%DSS的水,直至实验结束。DSS+ BMP7组每隔1 d腹腔注射0.1 μg/mL的BMP7 1 mL,正常对照组和DSS组大鼠隔日腹腔注射生理盐水1 mL。每日均对所有组别的大鼠进行观察、称重及评分。肠炎观察指标包括体质量、腹泻程度及结肠病变情况等。
1.2.2 取材:各组分别于第0、7、14及28天处死5只大鼠,处死前均采大鼠尾静脉血用于检测Treg细胞,且第28天的大鼠外周血细胞及结肠组织还将用于流式细胞及PCR检测。选取每只大鼠的全段结肠,沿肠道方向纵行剖开,处理干净粪便后观察明确炎症部位,截取组织进行Foxp3mRNA及蛋白表达的检测并检测血清中细胞因子TGF-β1水平以及外周血中Treg细胞的比例。
1.2.3 组织学炎症程度评分:每日记录大鼠的体质量、大便性状和隐血情况。根据我们以往已发表的评分方法[7],在光镜下观察结肠组织切片。无溃疡、无炎症、无肉芽肿、无纤维化、无病变各记0分;小溃疡(<3 mm)、轻度炎症、有肉芽肿、病变局限于黏膜下层各记1分;大溃疡(>3 mm)、重度炎症病变深度达肌层、重度纤维化各记2分。将评分相加,计算平均值。
1.2.4 大鼠外周血中Treg细胞的比例:选取第28天炎性反应差异最大的SD大鼠行流式细胞检测,大鼠外周血的单个核细胞采用密度梯度离心法进行分离,浓度采用1×106/mL。将0.3 μL的抗CD4和抗CD25加入100 μL的上述细胞,4℃避光孵育45 min,离心5 min,PBS洗涤3次,加入200 μL固定液,4℃避光孵育60 min,离心5 min,之后2次采用PBS液洗涤,重悬细胞采用500 μL FACS缓冲液,最后将其进行流式细胞仪的检测。
1.2.5 结肠组织Foxp3mRNA的表达:选取第28天炎性反应差异最大的SD大鼠行实时PCR(real time PCR,RT-PCR)检测,提取结肠组织总RNA,将其逆转录合成cDNA,并将合成的cDNA为模板进行RTPCR检测。RT-RCT反应体系中包含2 μL的cDNA、10 μL的SYBR Premix、1 μL的上下游引物各一个,0.4 μL ROX和5.6 μL去离子水。反应条件:95℃30 s,95℃5 s,60℃34 s,共进行40个循环。最后采用相对定量的方法(即2-△△Ct法)对Foxp3mRNA相对表达量进行计算。
1.2.6 Western blot检测结肠组织Foxp3蛋白的表达:选取第28天炎性反应差异最大的SD大鼠行Western blot检测,将结肠组织裂解,以获取总蛋白,蛋白经定量后按照40 μg上样进行电泳,电泳后转膜,将转膜后的PVDF膜放在甲醇中固定10 s左右,之后室温下用5%脱脂牛奶封闭1 h,用5%脱脂牛奶配置一抗,一抗浓度(1∶500),4℃封闭过夜,继续室温下二抗封闭1 h,之后利用ECL发光液进行显色。
1.2.7 ELISA法检测血清TGF-β1水平:选取第28天炎性反应差异最大的SD大鼠行ELISA法检测。用包被缓冲液将已知抗原稀释至1~10 μg/mL,每孔加0.1 mL,4℃过夜。次日洗涤3次。加一定稀释的待检样品0.1 mL于上述已包被的反应孔中,置于37℃中孵育1 h后洗涤。在反应孔中加入新鲜稀释的酶标二抗0.1 mL,在37℃中孵育30~60 min后洗涤,最后一遍用超轻水洗涤。然后加底物液显色;于各反应孔中加入临时配制的TMB底物溶液0.1 mL,37℃10~30 min。最后在各反应孔中加入2 mol/L硫酸0.05 mL终止反应。
1.3 统计学分析
2 结果
2.1 处理前后肠炎程度评分
DSS+BMP7组与DSS组在第0天差异无统计学意义(P>0.05)。DSS组在第7、14、28天炎症程度评分明显高于正常对照组。DSS+BMP7组第7天与DSS组相比无统计学差异(P>0.05),而第14天较DSS组减轻(P<0.05),第28天DSS+BMP7组炎症程度评分明显低于DSS组(P<0.05),与正常对照组相比无统计学差异(P>0.05)。见表1。

表1 DSS和BMP7处理前后各组炎症程度评分Tab.1 The degree of colon inflammation in different groups before and after treatment with DSS and BMP7
2.2 流式细胞仪检测外周血中CD4+CD25+Treg细胞比例
外周血中CD4+CD25+Treg细胞比例DSS+BMP7组显著高于DSS组(P<0.01),但DSS+BMP7组与正常对照组比较比例略低(P<0.05)。见图1。

图1 外周血中CD4+CD25+Treg细胞比例Fig.1 The percentage of CD4+CD25+Treg cells in peripheral blood
2.3 RT-PCR检测结肠组织中Foxp3mRNA表达
RT-PCR检测结果显示,DSS+BMP7组特异性表达于CD4+CD25+Treg细胞的Foxp3mRNA水平明显高于DSS组(P<0.01),但较正常对照组低(P<0.05),见图2。

图2 RT⁃PCR检测结肠组织中Foxp3mRNA的表达Fig.2 RT⁃PCR detection of the expression of Foxp3 mRNA in colon
2.4 Western blot检测结肠组织Foxp3蛋白的表达
Western blot结果显示,DSS+BMP7组特异性表达于CD4+CD25+Treg细胞的Foxp3蛋白水平明显高于DSS组,但较正常对照组低。见图3。
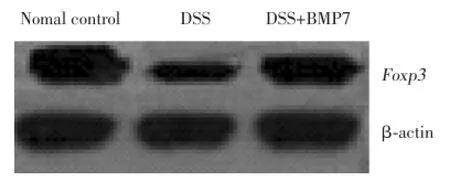
图3 Western blot检测结肠组织Foxp3蛋白的表达Fig.3 Western blot detection of the expression of Foxp3 in colon tissue
2.6 ELISA法检测血清TGF-β1水平
ELISA法检测显示,DSS+BMP7组TGF-β1表达量(60.14±3.12)显著高于DSS组(22.35±4.59)(P<0.05),但与正常对照组(71.56±462)相比其表达较低(P<0.05)。
3 讨论
炎症性肠病是一类慢性非特异性肠道炎症,主要包括溃疡性结肠炎和克罗恩病[1],其病因和发病机制目前尚不明确,目前认为多种因素参与了炎症性肠病的发生发展过程,免疫、微生物群体、生物环境以及遗传等因素都对溃疡性结肠炎的发生和发展具有一定影响[8]。目前较为普遍的观点认为发动病变的始动因素是免疫耐受和免疫反应之间的平衡被打破,即肠道的免疫功能失调[9]。
Treg细胞可分为自然调节性T细胞和诱导产生调节性T细胞,如Th3、Tr1,另外还有CD8 Treg、自然杀伤T细胞等几种亚型,这些与自身免疫性疾病的发生关系密切,其异常表达可导致自身免疫性疾病[10]。自然调节性T细胞主要为CD4+CD25+Treg,有研究将CD4+CD25+Treg缺陷的小鼠的T细胞转移到裸鼠中会导致多种自身免疫性疾病,而预先输入CD4+CD25+Treg可预防这类疾病的发生。将正常小鼠脾脏的CD4+T细胞去除CD25+细胞后转移给同基因型T细胞缺陷小鼠,将导致各种器官特异性自身免疫性疾病和系统性消耗疾病,而注射CD4+CD25+细胞群可以抑制这些自身免疫疾病的发生,从而最早证明了该群细胞具备免疫调节能力。CD4+CD25+Treg约占外周血及脾脏CD4+T细胞的5%~10%,CD4+CD25+Treg除表达CD4分子和CD25分子外,其特征标志为其高表达转录因子Foxp3。Foxp3不仅能作为CD4+CD25+Treg的标志分子,还是决定CD4+CD25+Treg功能的关键基因[11]。
Treg细胞的表型和功能都比较特异,这类细胞产生于胸腺,产生后运输至血液循环中,通过自主调节的方式抑制自身反应性T细胞的增殖及进一步活化,并且分泌抑制性细胞因子TGF-β1等物质来调节T细胞的增殖、分化以及其活性。CD4+CD25+Treg细胞能通过抑制免疫应答,从而减缓自身免疫性疾病的发生发展,包括炎症性肠病[12]。
BMP7是TGF-β超家族中成员之一,对组织器官的修复起重要作用,而过度表达则造成组织的纤维化[13]。之前大部分研究都着重于BMP与组织器官纤维化关系的研究[14],在免疫方面报道甚少。本文通过构建免疫相关炎症性肠病大鼠模型,通过给予BMP7来观察动物的炎性反应情况是否发生变化,从而进一步探讨其减缓炎症性肠病病情的机制是否通过Treg细胞来发挥起免疫抑制功能。
本研究表明,DSS+BMP7组给予BMP7治疗后,相比DSS组肠道炎症表现明显减轻,且相关免疫耐受因子TGF-β1及特异性表达于CD4+CD25+Treg细胞的Foxp3基因表达水平都明显增高。因此我们认为,给予BMP7治疗炎症性肠病有一定的疗效。而对其在分子水平上是如何进一步相互作用还需进一步研究。
[1]Saxena A,Kaur K,Hegde S,et al.Dietary agents and phytochemicals in the prevention and treatment of experimental ulcerative colitis[J].Tradit Complement Med,2014,4(4):203-217.
[2]Di Sabatino A,Biancheri P,Rovedatti L,et al.Recent advances in understanding ulcerative colitis[J].Intern Emerg Med,2012,7(2):103-111.
[3]Maul J,Zeitz M.Ulcerative colitis:immune function,tissue fibrosis and current therapeutic considerations[J].Langenbecks Arch Surg,2012,397(1):1-10.
[4]Maric I,Kucic N,Turk WT,et al.BMP signaling in rats with TNBS-induced colitis following BMP7 therapy[J].Am J Physiol Gastrointest Liver Physiol,2012,302(10):G1151-G1162.
[5]Flier SN,Tanjore H,Kokkotou EG,et al.Identification of epithelial to mesenchymal transition as a novel source of fibroblasts in intestinal fibrosis[J].J Biol Chem,2010,285(26):20202-20212.
[6]Maric I,Poljak L,Zoricic S,et al.Bone morphogenetic protein-7 reduces the severity of colon tissue damage and accelerates the healing of inflammatory bowel disease in rats[J].J Cell Physiol,2003,196(2):258-264.
[7]刘维新,张绅,任益,等.溃疡性结肠炎及溃疡性结肠炎相关性结直肠癌小鼠模型中血管生成因子的表达及其与血管新生的关系[J].中国医科大学报,2012,41(5):231-234.
[8]Krishnan K,Arnone B,Buchman A.Intestinal growth factor:potential use in the treatment of inflammatory bowel disease and their role in mucosal healing[J].Inflamm Bowel Dis,2011,17(1):410-422.
[9]Bamias G,Kaltsa G,Ladas SD.Cytokines in the pathogenesis of ulcerative colitis[J].Discov Med,2011,11(60):459-467.
[10]Ephrem A,Epstein AL,Stephens GL,et al.Modulation of Treg cells/T effector function by GITR signaling is context-dependent[J].Eur J Immunol,2013,43(9):2421-2429.
[11]Gibson DJ,Ryan EJ,Doherty GA.Keeping the bowel regular:the emerging role of Treg as a therapeutic target in inflammatory bowel disease[J].Inflamm Bowel Dis,2013,19(12):2716-2724.
[12]Mayne CG,Williams CB.Induced and natural regulatory T cells in the development of inflammatory bowel disease[J].Inflamm Bowel Dis,2013,19(8):1772-1788.
[13]Chu GC,Dunn NR,Anderson DC,et al.Differential requirements for Smad4 in TGF beta-dependent patterning of the early mouse embryo[J].Development,2004,131(15):3501-3512.
[14]Lavery K,Hawley S,Swain P,et al.New insights into BMP-7 mediated osteoblastic differentiation of primary human mesenchymal stem cells[J].Bone,2009,45(1):27-41.
(编辑 陈姜)
Bone Morphogenetic Protein 7 Alleviates Inflammation in the Rat Colitis Induced by Dextran Sodium Sulfate and Its Mechanism
LIU Wei-xin,ZHOUFeng,ZHANGShen,RENYi,WANGYing,WANGTing
(DepartmentofDigestive Diseases,The FirstHospital,China MedicalUniversity,Shenyang 110001,China)
ObjectiveTo detect the curing effect of bone morphogenetic protein 7(BMP7)in the colitis model of rat induced by dextran sodium sulfate(DSS)and its mechanism.MethodsA total of 60 rats were randomly divided into normal control group(treated by normal saline),DSS group(colitis model induced by DSS)and DSS+BMP7 group(DSS induced colitis model treated by BMP7).After 0,7,14,and 28 days,5 rats of each group were killed.The degree of colon inflammation was evaluated,the peripheral blood was analyzed by flow cytometry to detect changes in regulatory T(Treg)cellpercentage,and the colorectaltissueswere analyzed forFoxp3mRNA and protein expression using realtime PCRand Western blot.ELISA assay was used to detect the levels of serum cytokines transforming growth factor β1(TGF-β1).ResultsThe degrees of colon inflammation in the DSS group and DSS+BMP7 group were significantly higher than that of the control group on day 7.The degree of colon inflammation of the DSS+BMP7 group was lower than that of the DSS group(P<0.05)on day 14 and day 28.The percentage of Treg cell and the expression levels of Foxp3 and TGF-β1 in the DSS group and DSS+BMP7 group were lower than those in the control group,and the expression levels in the DSS+BMP7 group were higher than those in the DSS group(P<0.05)on day 28.ConclusionBMP7 may alleviate the colitis DSS induced by increasing Treg cells and TGF-β1.
bone morphogenetic protein 7;regulatory T cell;colitis;transforming growth factor β1
R574.62
A
0258-4646(2014)12-1084-04
辽宁省科技攻关计划(2013225303)
刘维新(1966-),女,副教授,博士. E-mail:weixinliu@yahoo.com
2014-10-22
网络出版时间:

