强迫游泳应激对大鼠甲状腺激素及垂体促甲状腺激素β亚基表达水平的影响
姜雅秋,姜雷,郭新红,王安邑,孙秋岩
(中国医科大学1.附属第一医院内分泌科,沈阳110001;2.保健科,沈阳110122)
强迫游泳应激对大鼠甲状腺激素及垂体促甲状腺激素β亚基表达水平的影响
姜雅秋1,姜雷2,郭新红1,王安邑1,孙秋岩1
(中国医科大学1.附属第一医院内分泌科,沈阳110001;2.保健科,沈阳110122)
目的探讨强迫游泳应激对Wistar大鼠甲状腺功能及垂体促甲状腺激素(TSH)β亚基(TSHβ)蛋白和mRNA表达水平的影响。方法选择6周龄Wistar雄性大鼠随机分成5组,除对照组外,强迫游泳10 min后分别于10 min、2 h、12 h及24 h断头,取血,化学发光分析法测定各组大鼠血清TSH、游离三碘甲腺原氨酸(FT3)和游离甲状腺素(FT4)水平;留取各组Wistar大鼠垂体,应用免疫组织化学染色检测TSHβ蛋白表达水平,垂体组织匀浆应用实时定量PCR分析TSHβmRNA表达水平。结果强迫游泳后2 h组、12 h组和24 h组血清FT3、FT4均升高,较对照组均无统计学差异(P>0.05),10 min组、2 h组及24 h组血清TSH水平较对照组无明显变化,但12 h组较其余各组均明显升高(P<0.05)。垂体TSHβ蛋白及mRNA表达强迫游泳后12 h组也较其他组明显升高(P<0.05)。结论强迫游泳应激可影响Wistar大鼠甲状腺功能,使血中甲状腺素水平升高。强迫游泳应激后Wistar大鼠垂体TSHβ蛋白及mRNA表达水平增加,峰值出现在12 h。提示丘脑-垂体-甲状腺轴可能在急性心理和生理应激时同样发挥重要的调节作用。
游离三碘甲腺原氨酸;游离甲状腺素;促甲状腺激素;促甲状腺激素β亚基
甲状腺素不仅在细胞的代谢、氧消耗,组织的生长、成熟和分化以及人体脂肪、碳水化合物代谢调节等方面起重要作用[1],下丘脑-垂体-甲状腺轴(hypothalamus-pituitary-thyroid,HPT)也构成了人体应激反应系统的重要一环[2,3]。随着神经内分泌调控及其机制研究的进展,应激对机体的负面作用也越来越被人们重视,有研究发现心理应激可明显降低机体的免疫功能[4]。在引起机体各种急性应激的突发重病发生时,血里的三碘甲腺原氨酸(triiodothyronine,T3)往往会偏低(低T3综合征)[5];有学者通过对心脏病患者的研究发现低T3血症是其预后不良与死亡的独立风险因子[6],而最近一些研究发现对难治抑郁症进行抗抑郁药物治疗时若能加用T3则能使疗效显著增高[7]。目前关于应激与甲状腺激素水平的研究结果不一,一些使用轻微刺激(如心理应激、慢束缚实验等)的实验发现外周血甲状腺激素水平轻微增加或无明显变化,一些使用较重程度刺激(如电击刺激等)的实验则发现外周血甲状腺激素水平降低[3],有学者认为这表现了HPT轴对应激强度及密度的敏感性[8]。本研究通过分析强迫游泳应激后外周血游离甲状腺素(free thyroxin,FT4)、游离三碘甲腺原氨酸(free triiodothyronine,FT3)、促甲状腺激素(thyroid-stimulating hormone,TSH)、垂体TSH β亚基(TSHβ)蛋白及其mRNA表达的变化,综合探讨急性应激对HPT轴的影响。
1 材料与方法
1.1 实验动物
6周龄SPF级Wistar雄性大鼠38只,体质量250~280 g。实验前自由饮食水,饲养于12 h/12 h明暗循环环境中。实验前1周开始每天抚摸动物5 min,以使大鼠习惯实验者。随机分为5组,第1组(n=8):对照组,当日断头,心脏取血;第2组~第5组:分别于26℃温水中强迫游泳10 min后立即(n= 7)、2 h(n=7)、12 h(n=8)、24 h(n=8)断头取垂体,心脏取血。垂体组织快速冷冻,保存于-70℃备用。血标本立即于0℃、3 000 r/min离心取血浆,保存于-20℃备用。实验在8:00~12:00内进行。
1.2 方法
1.2.1 血中激素测定:血清FT3、FT4及TSH应用化学发光法测定。
1.2.2 垂体TSHβ冰冻切片免疫组化染色:从-70℃冰箱取出组织,4%的多聚甲醛-PBS(pH7.4)固定1 h;0.01 mol/L PBS洗;3%H2O2去离子水孵育10 min,0.01 mol/L PBS洗;滴加一抗(1∶100),37℃水浴箱孵育90 min;0.01 mol/L PBS洗;滴加试剂PV9003于4℃冰箱孵育30 min,0.01 mol/L PBS洗;DAB显色,自来水终止反应后,苏木素复染;返蓝;封片;采用图像分析系统Image-Pro Plus 5.1对冰冻切片染色结果进行定量检测,检测各组大鼠垂体阳性表达染色的平均光密度,以每组标本15个视野的累积光密度(IOD)的平均值作为该例的测量值。
1.2.3 垂体TSHβmRNA实时定量PCR:组织匀浆;两相分离:12 000 r/m、4℃离心15 min,小心吸取上层水相至新的1.5 mL RNase Free的EP管中;上清液中加入200 μL-20℃预冷的氯仿,混匀,待充分乳化溶液呈乳白状后,室温静置5 min;12 000 r/m、4℃离心20 min;吸取最上层透明水相至新的1.5 mL RNase Free的EP管中。RNA沉淀:向上述的水相中加入400 μL异丙醇,混匀,12 000 r/m、4℃离心10 min;RNA清洗:弃去上清,加入1 mL DEPC水配制的75%乙醇(已-20℃预冷),12 000 r/m、4℃离心5 min,弃上清,干燥;RNA融解:再加入20 μL DEPC水溶解。RNA的纯度鉴定及含量测定:取RNA样品2 μL加入198 μL DEPC水后,以紫外分光光度计测260 nm和280 nm OD值,计算OD260/OD280比值,若其值>1.8,则视为提取的RNA纯度可用。mRNA逆转录合成cDNA:Total RNA根据原始浓度稀释为100 ng/μL,根据逆转录试剂盒(PrimeScriptTMRT reagent kit)的说明书将抽提的总RNA逆转录合成cDNA。实时PCR分析大鼠垂体组织中TSHβmRNA表达水平。设计引物根据美国NCBI数据库基因序列信息,用引物设计软件Primer 5.0分别设计出TSHβ和GAPDH基因的引物,由大连宝生物工程公司合成并纯化。为保证实验的标准化,在PCR反应中同时扩增一内源性参照基因。在TSHβ基因表达研究中,本研究选择看家基因GAPDH为内参基因。反应结束后确认实时PCR的扩增曲线,并要求溶解曲线为单峰;标准曲线R2≥0.98;扩增效率E≥2.0之间;阴性对照无荧光信号;应用LightCycler 480软件选择“Advanced Relative Quantitation”分析路径对目的基因mRNA表达的差异进行分析。
1.3 统计学方法
数据采用SPSS17.0统计学软件进行处理、分析,所有数据均采用表示,采用单因素方差分析与t检验进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 血清FT3和FT4水平
强迫游泳应激后2 h组、12 h组和24 h组血清FT3、FT4均较对照组有所升高,但差异无统计学意义(P>0.05)。见表1。
2.2 血清TSH水平
血清TSH水平10 min组、2 h组较对照组无明显变化(P>0.05),但12 h组TSH水平明显升高,与对照组、10 min组及2 h组比较有统计学差异(P<0.05),但游泳应激后24 h血清TSH水平与12 h相比明显降低,有统计学差异(P<0.05),且24 h血清TSH水平基本恢复到应激前水平(表1)。
2.3 垂体TSHβ表达水平
垂体TSHβ表达水平以IOD表示,10 min组与对照组比较无明显变化,2 h组较对照组升高,有统计学差异(P<0.05),12 h组较对照组、10 min组及2 h组明显升高,有统计学差异(P<0.05)。24 h组较12 h组有所降低,有统计学差异(P<0.05),但较对照水平仍升高,未恢复到应激前水平(表1,图1)。
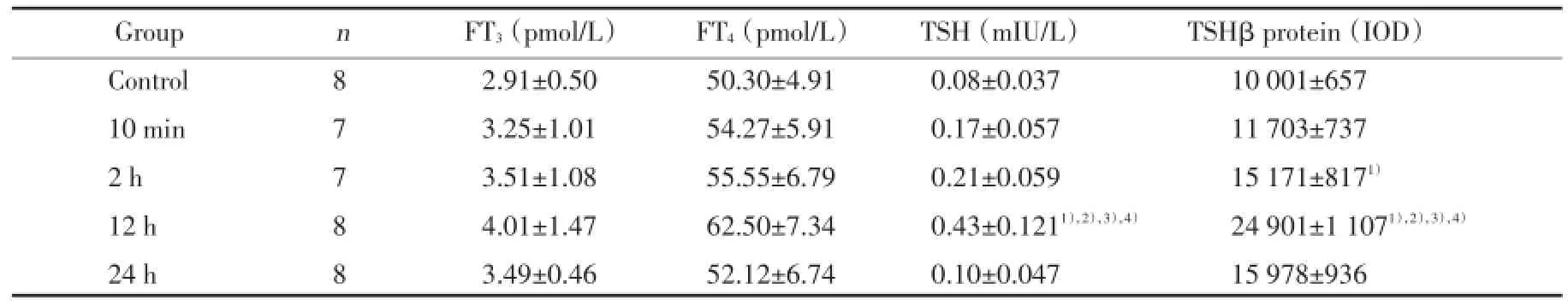
表1 强迫游泳应激后血清FT3、FT4、TSH及垂体TSHβ表达水平的变化Tab.1 Change of serum FT3,FT4,TSH and pituitary TSHβ expression level after forced swimming stress

图1 垂体TSHβ免疫组化染色×400Fig.1 Immunohistochemical staining of pituitary TSHβ×400
2.4 大鼠垂体TSHβmRNA表达水平
TSHβmRNA在大鼠垂体组织中的表达水平各实验组较对照组升高,有统计学差异(P<0.05),24 h组较12 h组有所降低,但较对照组水平仍升高,未恢复到应激前水平。见图2。
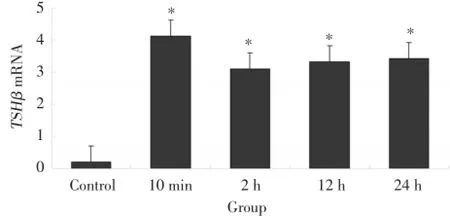
图2 强迫游泳应激后垂体TSHβmRNA表达水平的变化Fig.2 Dynamic change of pituitary TSH βmRNA expression level after forced swimming stress
3 讨论
本研究探讨强迫游泳应激对HPT轴功能变化的影响,研究中发现强迫游泳应激可使外周FT3、FT4及TSH增加,同时垂体TSH表达也增加。
有研究报道强迫游泳应激可使HPT轴中糖皮质激素的分泌于短期内明显增加并恢复正常,即强迫游泳应激10 min后糖皮质激素较前明显增加,但2 h后恢复到基础水平[9]。我们应用相同的应激形式及强度处理大鼠来研究对HPT轴功能的影响,结果提示强迫游泳应激对HPT轴的影响随时间的动态变化是不同的,TSH的升高较促肾上腺皮质激素的变化出现的慢而且持续时间较长,24 h后仍未恢复到基础水平。
一般认为,甲状腺激素起作用时间在数日到数周内,近来的研究发现甲状腺激素的短暂改变也可能造成一些明显后果,如对大鼠腹膜内注射T3能导致其海马内BDNFmRNA在2 h内显著变化[10],皮下注射2 h内发现大鼠食量增加[11],此外T3对海马神经活性变化的影响也被证实[12]。这些甲状腺激素的急性作用可能通过基因调控的细胞膜受体而起作用,但也可能不通过此途径起作用[13]。
本研究发现Wistar大鼠在强迫游泳后12 h出现T3、T4以及TSH增高。学者曾发现较轻的刺激(如心理、慢性束缚等)能引起大鼠血中甲状腺激素水平升高,与本研究结果相似。我们利用实时定量PCR测定垂体TSHβmRNA表达水平和血中TSH水平趋势略有不一致,可能由于合成与释放不同步,或是部分来自其脉冲式释放的特性。垂体TSHmRNA表达的增高再次证明了应激对HPT轴产生的影响,解释了TSH增高的一个可能来源,未来应进一步探讨游泳应激对下丘脑室旁核促甲状腺激素释放激素的含量及表达的影响。
很多应激源如寒冷、高热都可以直接通过中枢温度感受器直接作用于HPT,促甲状腺激素释放激素、TSH相继释放,使甲状腺激素分泌增加。急性应激可能主要通过蓝斑-交感-肾上腺髓质系统整合分析作出应答,进而兴奋交感神经,加速肾上腺髓质功能,使血浆中儿茶酚胺的浓度迅速升高,进而刺激甲状腺激素分泌有关。多数认为长期应激导致的甲状腺激素,尤其是T3的降低与下丘脑-垂体-肾上腺轴密切相关。
游泳应激对HPT轴功能影响的机制尚待进一步研究。在应激的经典模型中,皮质醇激素会表现出显著增高,有研究发现其能在垂体水平对TSH的释放产生影响,但也有研究认为这个作用发生在下丘脑水平[14,15]。对肾上腺切除的动物重复这种应激实验可能可以进一步对此类机制作出解释。
[1]Wrutniak-Cabello C,Casas F,Cabello G.Thyroid hormone action in mitochondria[J].J Mol Endocrinol,2001,26(1):67-77.
[2]Helmreich D,Crouch M,Dorr N,et al.Peripheral triiodothyronine(T3)levels during escapable and inescapable shock[J].Physiol Behav,2006,87(1):114-119.
[3]Kilburn-Watt E,Banati RB,Keay KA.Altered thyroid hormones and behavioural change in a sub-population of rat following chronic constriction injury[J].J Neuroendocrinol,2010,22(8):960-970.
[4]邵枫,林文娟,王玮雯,等.心理应激的免疫抑制作用及其神经内分泌反应的相关性[J].心理学报,2001,33(1):43-47.
[5]Mebis L,Van den Berghe G.Thyroid axis function and dysfunction in critical illness[J].Best Pract Res Clin Endocrinol Metab,2011,25(5):745-757.
[6]Iervasi G,Pingitore A,Landi P,et al.Low-T3syndrome:a strong prognostic predictor of death in patients with heart disease[J].Circulation,2003,107(5):708-713.
[7]Richard C,Shelton MD.The use of antidepressants in novel combination therapies[J].J Clin Psychiatry,2003,64(Suppl 2):14-18.
[8]Helmreich DL.Thyroid hormone regulation by stress and behavioral differences in adult male rats[J].Horm Behav,2011,60(3):284-291.
[9]Jiang YQ,Kawashima H,Uchida K,et al.Differential effects of forced swim-stress on the corticotrophin-releasing hormone and vasopressin gene transcription in the parvocellular division of the paraventricular nucleus of rat hypothalamus[J].Neurosci Lett,2004,358(3):201-204.
[10]Sui L,Ren WW,Li BM.Administration of thyroid hormone increases reelin and brain-derived neurotrophic factor expression in rat hippocampus in vivo[J].Brain Res,2010,1313(8):9-24.
[11]Kong WM,Martin NM,Smith KL,et al.Triiodothyronine stimulates food intake via the hypothalamic ventromedial nucleus independent of changes in energy expenditure[J].Endocrinology,2004,145(11):5252-5258.
[12]Caria MA,Dratman MB,Kow LM,et al.Thyroid hormone action:nongenomic modulation of neuronal excitability in the hippocampus[J].J.Neuroendocrinol,2009,21(2):98-107.
[13]Davis PJ,Leonard JL,Davis FB.Mechanisms of nongenomic actions of thyroid hormone[J].Front Neuroendocrinol,2008,29(2):211-218.
[14]Roelfsema F,Pereira AM,Biermasz NR,et al.Diminished and irregular TSH secretion with delayed acrophase in patients with Cushing′s syndrome[J].Eur J Endocrinol,2009,161(5):695-703.
[15]Haugen BR.Drugs that suppress TSH or cause central hypothyroidism[J].Best Pract Res Clin Endocrinol Metab,2009,23(6):793-800.
(编辑 陈姜)
EffectofForced Swimming Stresson Thyroxineand the Expression ofThyroid-stimulating Hormone βSubunitin Pituitary of Rat
JIANGYa-qiu1,JIANGLei2,GUOXin-hong1,WANGAn-yi1,SUNQiu-yan1
(1.Department of Endocrinology,The First Hospital,China Medical University,Shenyang 110001,China;2.Out-patient Department,China Medical University,Shenyang 110122,China)
ObjectiveTo clarify changes in the blood leveloftriiodothyronine(T3),thyroxin(T4),and expression levelofthyroid-stimulating hormone(TSH)β subunit(TSHβ)mRNA at pituitary in Wistar rats after forced swimming stress.MethodsMale Wistar rats with an age of 6 weeks were randomly divided into five groups(10 min,2 h,12 h,24 h,control group)depending on the time delayed after the 10-minute forced swimming.Blood was collected for serum TSH measurement by chemiluminescent immunoassay,pituitary tissue was excised for measurement of TSH expression by immunohistochemistry assay,pituitaries were also excised for extraction of total RNA.Real-time PCR was performed for quantification ofTSHβmRNA.ResultsSerum T4and T3in the 2 h,12 h and 24 h groups increased after forced swimming stress,but the increase was not significant as compared with that of the control group(P>0.05).Serum TSH of the 12 h group increased significantly compared with those of the other groups(P<0.05),but no significant change were noticed between the 10 min,2 h,24 h groups and the control group.TSHβmRNA expression at pituitary showed similar results.ConclusionForced swimming stress influenced the function of pituitary in Wistar rats,leading to increased serum thyroxin level.After forced swimming stress,the TSHβ concentration and mRNA expression level at pituitary in Wistar rats increased(peaked after 12 h),suggesting an importantregulatory role ofthalamus-pituitary-thyroid axisunderacute psychologicaland physiologicalstress.
free triiodothyronine;free thyroxin;thyroid-stimulating hormone;thyroid-stimulating hormone β subunit
R714.1
A
0258-4646(2014)12-1088-04
辽宁省高等学校创新团队项目(LT2012015)
姜雅秋(1968-),女,教授,博士. E-mail:jiangyaqiu@yeah.net
2014-10-09
网络出版时间:

