胡黄连苷Ⅱ对乙醇诱导的H9C2心肌细胞损伤的保护作用
胡军,赵渊源,孙靖涵,侯志文,于波
(中国医科大学附属第一医院心内科,沈阳110001)
胡黄连苷Ⅱ对乙醇诱导的H9C2心肌细胞损伤的保护作用
胡军,赵渊源,孙靖涵,侯志文,于波
(中国医科大学附属第一医院心内科,沈阳110001)
目的探讨胡黄连苷Ⅱ对乙醇所致H9C2心肌细胞损伤的保护作用。方法用MTT检测细胞存活率,LDH、SOD、Gpx、MDA及ROS试剂盒检测H9C2细胞在乙醇干预及胡黄连苷Ⅱ预处理条件下的氧化应激状态。结果100 mmol/L及以上浓度的乙醇可导致H9C2细胞的存活率下降,100~200 mmol/L之间细胞存活率下降最为明显,200 mmol/L的乙醇可导致上清液中LDH活性的增加、细胞匀浆中SOD及Gpx活性的下降、细胞匀浆中MDA及细胞内ROS含量的增加。而胡黄连苷Ⅱ预处理可部分改善乙醇所致细胞存活率的下降,其保护作用部分是通过提高细胞中SOD及Gpx活性实现的。结论胡黄连苷Ⅱ对乙醇所致H9C2心肌细胞氧化应激损伤,具有保护作用,其保护作用部分是通过提高细胞的抗氧化作用实现的。
胡黄连苷Ⅱ;H9C2心肌细胞;乙醇;氧化应激
氧化应激在包括酒精性心肌病在内的许多心血管疾病中起重要作用[1,2]。氧化应激以活性氧的产生与清除失衡为特点。活性氧的清除系统包括酶途经和非酶途经,前者包括超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶等,后者包括维生素C、维生素E等。活性氧主要包括超氧阴离子、过氧化氢、羟自由基,它们可以通过氧化蛋白、脂类、核酸而影响细胞的完整性,从而影响细胞的结构与功能,另一方面活性氧也可以启动细胞的凋亡途经。有研究报道,抗氧化治疗能够通过激活抗氧化酶系统,增强细胞对活性氧的清除能力,从而在乙醇诱导的损伤中发挥保护作用[3]。
胡黄连苷Ⅱ是一种从胡黄连中分离的环烯醚萜苷类物质,曾有研究显示胡黄连苷Ⅱ有多种药理学作用,对心脏、神经系统、肝脏等均具有保护作用,主要体现在抗凋亡、抗缺血、抗炎等方面。近期的研究显示胡黄连苷Ⅱ在缺氧复氧所致的心肌氧化应激损伤中有抗氧化作用[4]。然而,胡黄连苷Ⅱ在乙醇所诱导的H9C2心肌细胞的损伤中是否能发挥保护作用尚不清楚。因此,本研究拟探讨胡黄连苷Ⅱ在乙醇所致的H9C2心肌细胞的损伤中的作用并探讨其机制。
1 材料与方法
1.1 细胞及试剂
H9C2心肌细胞购自北京鼎国昌盛生物有限公司。胡黄连苷Ⅱ对照品购自中国药品生物制品检定所;胎牛血清购自杭州四季青生物工程有限公司;高糖DMEM培养基购自美国Hyclone公司;乳酸脱氢酶(lactate dehydrogenase,LDH)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽氧化酶(glutathione peroxidase,Gpx)检测试剂盒购自南京建成生物工程研究所;活性氧(reactive oxygen species,ROS)检测试剂盒购自江苏碧云天公司;其他常规试剂均购自北京鼎国昌盛生物有限公司。
1.2 方法
1.2.1 细胞培养及处理:H9C2心肌细胞培养于含10%胎牛血清、青霉素(100 U/mL)、链霉素(100 mg/mL)的高糖DMEM培养基中,置于5%CO2、37℃恒温培养箱中。当细胞培养至80%~90%融合时进行传代。将细胞接种于96孔板中(1×104~1.5×104/孔),用MTT法检测细胞存活率。将细胞接种于6孔板中(2×105~3×105/孔),用于检测SOD、LDH、Gpx及MDA,用倒置荧光显微镜检测细胞内活性氧。
1.2.2 细胞存活率检测:取对数生长期细胞接种至96孔板(1×104~1.5×104/孔,37℃培养24 h后,分别以0、0.32、1.6、8、40、200及1 000 mg/L胡黄连苷Ⅱ处理48 h,或者以0、50、100、200、400及800 mmol/L乙醇处理24 h。处理完毕的细胞每孔加入5 mg/mL MTT 15 μL,继续孵育4 h后,弃培养基,加入二甲基亚砜(150 μL/孔),置摇床上摇晃10 min。酶标仪测490 nm吸光值,计算细胞的存活率。
1.2.3 乙醇及胡黄连苷Ⅱ浓度的选择:以不同浓度乙醇(25~800 mmol/L)处理细胞24 h,检测细胞存活率,制作浓度生存率曲线,根据该曲线选择后续实验乙醇作用浓度;以不同浓度胡黄连苷Ⅱ(0.32~1 000 mg/L)预处理细胞24 h,之后以上述所选择的乙醇浓度处理24 h,检测细胞存活率,制作生存率曲线,根据该结果进行实验分组。
1.2.4 实验分组:(1)对照组(control组):以不含乙醇的DMEM培养液培养细胞48 h后收集细胞及培养液;(2)乙醇组(alcohol组):以不含乙醇的DMEM培养液培养细胞24 h后,将培养液置换为含200 mmol/L乙醇的DMEM培养液,培养细胞24 h后,收集细胞及培养液;(3)~(5)胡黄连苷Ⅱ预处理组(picrosideⅡ1组):分别以含8、40、200 mg/L胡黄连苷Ⅱ的DMEM培养液培养细胞24 h后,置换培养液为含200 mmol/L乙醇的DMEM培养液,培养24 h后,收集细胞及培养液。
1.2.5 LDH测定:收集各组细胞的培养液上清20 μL,按照LDH检测试剂盒说明书检测上清液中LDH的含量。
1.2.6 SOD、Gpx、MDA的测定:收集处理完毕的细胞,采用超声破碎仪碎裂细胞,用BCA定量试剂盒检测细胞匀浆的总蛋白含量,按照SOD、Gpx、MDA检测试剂盒说明书进行测定操作,计算各自的含量。
1.2.7 ROS的测定:采用ROS测定试剂盒检测细胞内ROS含量。用PBS清洗处理完毕的细胞,用含0.1%cDCFH-DA的无血清培养基孵育30 min,采用倒置荧光显微镜观察细胞内的荧光值。
1.3 统计学分析
2 结果
2.1 细胞形态学
显微镜下观察细胞形态,刚接种的心肌细胞呈球形,24 h后,大部分细胞已经贴壁、逐渐扩展,呈类三角形或不规则的星形,细胞伸出伪足,并相互交接成网;乙醇组细胞形态不一,漂浮细胞较多(图1)。

图1 细胞形态学结果Fig.1 Cell morphology of different groups
2.2 细胞存活率
MTT结果显示:不同浓度胡黄连苷Ⅱ(0.32~1 000 mg/L)处理细胞48 h对细胞的存活率无明显影响;乙醇以浓度依赖的方式导致细胞的存活率下降,乙醇浓度≥100 mmol/L时,差异有统计学意义(P<0.001),200 mmol/L时细胞存活率下降更为明显,故后续实验以200 mmol/L作为损伤条件;另一方面,胡黄连苷Ⅱ预处理细胞24 h可以浓度依赖的方式提高乙醇所致的细胞存活率的下降,从8 mg/L开始差异有统计学意义(P=0.016),1 000 mg/L与200 mg/L时比较,生存率未明显增强,故后续实验以8、40、200 mg/L来研究胡黄连苷Ⅱ的保护作用(图2)。
2.3 LDH检测结果
细胞培养液上清中LDH的含量作为评价细胞损伤的重要指标,检测结果显示:胡黄连苷Ⅱ预处理细胞24 h可以浓度依赖的方式降低乙醇所致的培养液上清液中LDH的升高(表1)。
2.4 MDA检测结果
MDA作为反映细胞脂质过氧化的敏感指标,正常组织中含量极低。检测结果显示:200 mmol/L乙醇可导致细胞内MDA含量的升高,而胡黄连苷Ⅱ预处理细胞24 h可以浓度依赖的方式降低乙醇所导致的MDA的升高(表1)。
2.5 SOD及Gpx检测结果
SOD及Gpx作为细胞抗氧化系统主要的酶,其活性代表着细胞的抗氧化能力。检测结果显示:200 mmol/L乙醇可导致细胞内SOD及Gpx活性的降低,而胡黄连苷Ⅱ预处理细胞24 h可以浓度依赖的方式提高乙醇所导致的细胞内SOD及GSH-Px活性的降低(表1)。
2.6 ROS检测结果
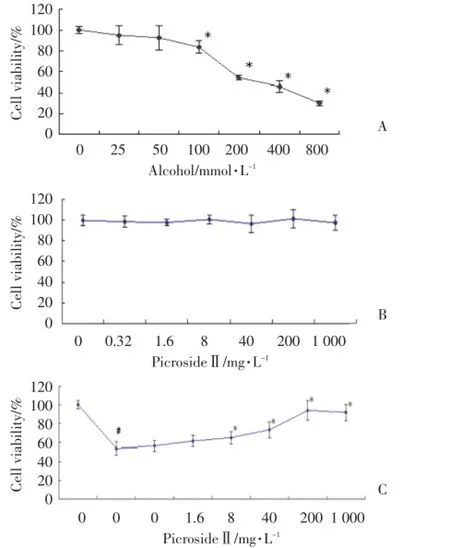
图2 细胞存活率MTT检测结果Fig.2 Results of MTT cell viability
细胞内ROS的含量可以cDCF的荧光强度表示,倒置荧光显微镜检测结果显示:200 mmol/L乙醇可导致细胞内荧光强度增加,而胡黄连苷Ⅱ预处理细胞24 h可以浓度依赖的方式降低乙醇所导致的细胞内荧光强度增加(图3)。

表1 各组细胞LDH、Gpx、SOD活性及MDA含量比较(n=6)Tab.1 Effect on LDH,Gpx,SOD activities and MDA content in H9C2 cardiomyocytes subjected to alcohol injury of each group(n=6)
3 讨论
氧化应激是指机体或细胞内氧自由基的产生和消除失衡,或外源性氧化物质过量摄入,导致ROS在体内或细胞内过量蓄积。ROS包括超氧阴离子自由基、过氧化氢、氧自由基等,是生物体内活性含氧化合物的总称,过量蓄积可引起细胞毒性改变的病理过程。生理条件下,组织正常的氧化代谢会生成少量的ROS,能够被细胞的抗氧化防御体系快速清除,从而维持体内氧化还原状态的平衡。但在病理条件及某些损伤因素的刺激下,细胞内氧化代谢产物增加,超过细胞抗氧化体系能够承受的范围,则发生氧化损伤。该过程在心肌缺血、心肌再灌注及酒精性心肌病等病变中都起着重要作用[4,5]。大量氧自由基的产生,可造成生物膜脂质过氧化、各种酶蛋白失活及DNA损伤。氧自由基通过攻击夺获生物膜脂质多聚不饱和脂肪酸侧链上的氢原子等过程,造成膜流动性与钙离子通透性增加,破坏膜结构完整性,钙跨膜内流与超负荷,最终导致细胞损伤或死亡。乙醇可通过上调丰富蛋白酪氨酸激酶(protein-rich tyrosine kinase-2,PYK2)下调caveolin-1促使ROS的产生。也有研究表明慢性乙醇摄入可诱导CYP2E1的表达增加,CYP2E1的高表达又可致超氧阴离子等氧化应激指标增加,而通过抑制CYP2E1的高表达可减轻乙醇诱导的心肌细胞功能障碍及凋亡[1,2,6,7]。Zhang等[8]和Antonenkov等[9]的研究表明氧化应激损伤在酒精性心肌病的启动及进展中起关键性作用。

图3 胡黄连苷Ⅱ对乙醇诱导H9C2心肌细胞损伤ROS含量的影响Fig.3 Effects of picroside II on ROS in H9C2 cardiomyocytes subjected to alcohol
胡黄连的主要生物活性成分是环烯醚萜苷,具有抗氧化、抗炎及抗凋亡的作用,其中胡黄连苷Ⅱ为其主要有效成分。研究表明,胡黄连苷Ⅱ对H2O2诱导的PC12细胞损伤具有明显的保护作用,其保护作用是通过清除氧自由基及增强细胞抗氧化系统的功能实现的。近期的研究表明,胡黄连苷Ⅱ对心肌细胞缺氧/复氧损伤有保护作用,提示胡黄连苷Ⅱ具有抗氧化、抗凋亡的作用,另外胡黄连苷Ⅱ在外周组织如肾脏、肝脏中也具有保护作用[10~12]。但其在酒精性心肌病中的作用未见报道。
检测上清液中LDH活性可以评估心肌细胞受损伤的严重程度。氧化应激时,不仅ROS生成增多,机体对ROS的清除能力也显著降低,从而造成ROS大量蓄积,引起严重的氧化损伤。MDA是ROS与细胞膜中多不饱和脂肪酸反应生成的脂质过氧化产物,其含量能够反映脂质过氧化损伤状态,间接地反映机体受ROS攻击的严重程度。SOD、Gpx作为体内主要的抗氧化酶,其活性也体现了细胞的抗氧化能力。本研究结果显示:乙醇可导致H9C2细胞氧化应激损伤,其中包括上清液中LDH升高,细胞内MDA及ROS升高,以及细胞内SOD、Gpx降低;而胡黄连苷Ⅱ可以浓度依赖的方式改善细胞内的氧化应激状态,降低细胞内活性氧的含量及增加细胞的抗氧化能力。本研究结果为进一步探讨胡黄连苷Ⅱ对酒精性心肌病的保护作用机制提供了一定的方向。
[1]桑颖,周立君,井玲,等.钙依耐性酪氨酸激酶2和微囊蛋白1传导路在酒精性心肌病中的作用及药物干预研究[J].中华医学杂志,2011,91(22):1561-1565.
[2]Kunitomo M,Yamaguchi Y,Kagota S,et al.Biochemical evidence of atherosclerosis progression mediated by increased oxidative stress in apolipoprotein E-deficient spontaneously hyperlipidemic mice exposed to chronic cigarette smoke[J].J Pharmacol Sci,2009,110(3):354-361.
[3]Zhang X,Klein AL,Alberle NS,et al.Cardiac-specific overexpression of catalase rescues ventricular myocytes from ethanol-induced cardiac contractile defect[J].J Mol Cell Cardiol,2003,35(6):645-652.
[4]Meng FJ,Jiao SM,Yu B.PicrosideⅡprotects cardiomyocytes from hypoxia/reoxygenation-induced apoptosis by activating the PI3K/ Akt and CREB pathways[J].Int J Mol Med,2012,30(2):263-270.
[5]Ji L,Fu F,Zhang L,et al.Insulin attenuates myocardial ischemia/ reperfusion injury via reducing oxidative/nitrative stress[J].Am J Physiol Endocrinol Metab,2010,298(4):E871-E880.
[6]Jing L,Jin CM,Li SS,et al.Chronic alcohol intake-induced oxidative stress and apoptosis:role of CYP2E1 and calpain-1 in alcoholic cardiomyopathy[J].Mol Cell Biochem,2012,359(1-2):283-292.
[7]Zhang RH,Gao JY,Guo HT,et al.Inhibition of CYP2E1 attenuates chronic alcohol intake-induced myocardial contractile dysfunction and apoptosis[J].Biochim Biophys Acta,2012,1832(1):128-141.
[8]Zhang X,Li SY,Brown RA,et al.Ethanol and acetaldehyde in alcoholic cardiomyopathy:from bad to ugly en route to oxidative stress[J].Alcohol,2004,32(3):175-186.
[9]Antonenkov VD,Grunau S,Ohlmeier S,et al.Peroxisomes are oxidative organelles[J].Antioxid Redox Signal,2010,13(4):525-537.
[10]Li T,Liu JW,Zhang XD,et al.The neuroprotective effect of picrosideⅡfrom hu-huang-lian against oxidative stress[J].Am J Chin Med,2007,35:681-691.
[11]Li Q,Li Z,Xu XY,et al.Neuroprotective properties of picrosideⅡin a rat model of focal cerebral ischemia[J].Int J Mol Sci,2010,11:4580-4590.
[12]Meng FJ,Hou ZW,Li Y,et al.The protective effect of picrosideⅡagainst hypoxia/reoxygenation injury in neonatal rat cardiomyocytes[J].Pharm Biol,2012,50(10):1226-1232.
(编辑 王又冬)
Protective Effectof PicrosideⅡagainstAlcohol-induced Injury in H9C2 Cardiomyocytes
HU Jun,ZHAOYuan-yuan,SUNJing-han,HOUZhi-wen,YUBo
(DepartmentofCardiology,The FirstHospital,China MedicalUniversity,Shenyang 110001,China)
ObjectiveTo explore the cardioprotective role ofpicrosideⅡagainstalcohol-induced injury in H9C2 cardiomyocytes.MethodsThe cellviability and cellulardamage ofcardiomyocyteswere respectively assessed by MTTand LDH assays.The activities ofSODand Gpx,and the contents of MDA were determined using detection kit.The levels of ROS were evaluated by inverted fluorescence microscope.ResultsH9C2 cell viability wasdecreased when treated with alcoholabove 100 mmol/L,and the mostsignificantdecline was observed between 100-200 mmol./L Pretreatment of H9C2 cardiomyocytes with picrosideⅡ(8-200 mg/L)inhibited LDH activity in culture media and increased cell viability in a dose-dependentmanner.This protective effectwas accompanied by significantly increased activities ofSOD and GSH-Px,which attenuating MDAin response to alcohol-induced injury.Furthermore,picrosideⅡalso inhibited ROS production in H9C2 cardiomyocytes.ConclusionThe present study demonstrated that picrosideⅡprotects H9C2 cardiomyocytes against alcohol-induced injury through reduction of ROS production and enhancement of the activity ofantioxidantdefense.
picrosideⅡ;H9C2 cardiomyocytes;alcohol;oxidative stress
R542.2
A
0258-4646(2014)06-0523-05
辽宁省科技厅计划项目(2012225084)
胡军(1987-),男,硕士研究生.
于波,E-mail:ybdy@hotmail.com
2014-03-06
网络出版时间:

