化学练习题链接背后的知识体系—溶度积
陈剑丽 衷明华
(韩山师范学院化学系,广东 潮州 521041)
主要考查知识点:溶度积常数(Ksp)
案例1:
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是( )。
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大;
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大;
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/LNH4Cl溶液中的Ksp小;
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2。
答案解析:
A项,Mg(OH)2与MgF2同属于AB2型沉淀,可根据Ksp大小比较例子浓度,Ksp[Mg(OH)2]比Ksp(MgF2)小,说明Mg(OH)2溶液中的c(Mg2+)更小;
B项,NH4+结合OH—能力比Mg2+强,使Mg(OH)2溶解平衡正移,从而使c(Mg2+)增大。
C项,Ksp不随浓度变化,只与温度有关;
D项,Mg(OH)2和MgF2二者Ksp接近,类比BaSO4可转化为BaCO3,使用浓NaF溶液可以使氢氧化镁转化。
正确选项:B。
案例2:
(2009年广东高考)硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是( )。

B.三个不同温度中,313K时Ksp(SrSO4)最大;
C.283K时,图中a点对应的溶液是不饱和溶液;
D.283K下的SrSO4饱和溶液升温到263K后变为不饱和溶液。
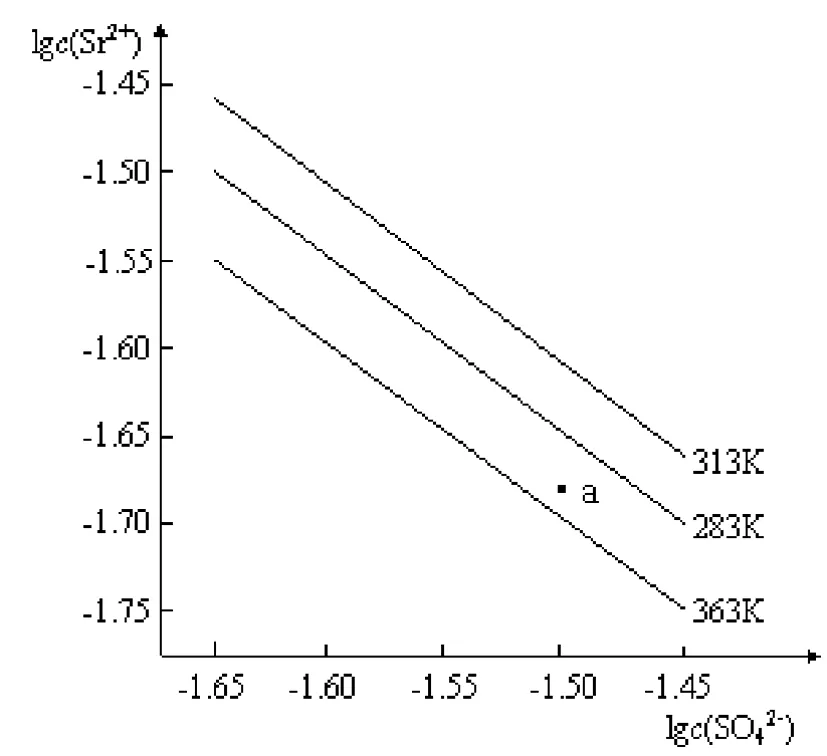
图 沉淀溶解平衡曲线
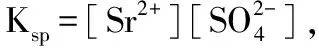
答案:BC。
迁移链接:
(一)对于一定温度下的平衡:

Ksp=[c(Mn+)]m?偊b[c(Am-)]n
(二)溶度积的大小只与难溶电解质的性质和温度有关,与沉淀的量无关。离子浓度的改变可使平衡发生移动,但不能改变溶度积,不同的难溶电解质在相同温度下的Ksp不同。
(三)Ksp反映了难溶电解质在水中的溶解能力。同种类型难溶电解质可以用溶度积直接比较时,物质的类型(如AB型、A2B型、AB2型等)必须相同。不同类型的难溶电解质不能用Ksp比较溶解度的大小判断规则。
(四)对于同类型物质,难溶电解质的Ksp越小,溶解度越小,越难溶。
(五)通过比较溶度积与溶液中有关离子浓度幂的乘积(离子积)Qc的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解。
①Qc>Ksp时:溶液过饱和,平衡向生成沉淀的方向移动—有沉淀生成;
②Qc=Ksp时:溶液饱和,处于平衡状态;
③Qc [1]胡冰.溶度积常数的灵活应用[J].新高考(物理化学生物),2009(10). [2]齐伟,卢银中,黄斌.思维导图(高中化学).湖南教育出版社,2010. [3]普通高中课程标准实验教科书,必修4,化学反应原理.人民教育出版社,2007年2月第3版. [4]苏文士.360°高考(化学).羊城晚报出版社,2010.
——饱和溶液与不饱和溶液

