金黄地鼠胰腺癌动物模型的建立
马青松,张小明,沈成义,吴泽珊,蒲 宇,武超颖,杨正伟
(1.资阳市第一人民医院放射科,四川 资阳 641300;2.医学影像四川省重点实验室·川北医学院附属医院放射科,四川 南充 637000;3.川北医学院病理生理学教研室,四川 南充 637000;4.川北医学院组织胚胎学教研室,四川 南充 637000; 5.泸州医学院附属医院放射科,四川 泸州 646000)
胰腺癌是常见的恶性肿瘤,恶性程度较高、发展快、预后差,目前尚无有效的筛查或早期诊断方法。据统计,美国每年有30 000多人死于胰腺癌,居癌症死亡第4位[1-2]。理想的胰腺癌动物模型为研究胰腺癌的发生、发展及其细胞、病理、分子生物学特性,及探讨其诊断和治疗奠定了基础。通过给叙利亚金黄地鼠皮下注射化学物质N-亚硝基双(2-氧丙基)胺[N-Nitrosobis(2-oxopropyl)amine,BOP],成功建立了化学诱导型胰腺癌动物模型,目前国内尚未见报道,现总结并报告如下。
1 材料与方法
1.1 实验材料
叙利亚金黄地鼠120只,由四川省实验动物专委会养殖场提供,品系为叙利亚种,合格证编号:0016952,鼠龄为8周,平均体重100 g,雌性。将实验动物随机分为实验组(80只)、对照组(40只),饲养在恒温(21+5)℃、恒湿(70+10)%、符合SPF条件的本院动物实验室内,每笼2~3只。笼具、垫料经紫外线消毒,食物、饮用水经高压灭菌供动物自由食用。食物为小鼠专用压缩颗粒饲料。试剂:BOP(产品代码 3525623-1G,Ash Stevens Chemical Co.,USA)。
1.2 模型建立
称取金黄地鼠重量,将BOP溶于0.9% 生理盐水溶液(1 mg BOP/mL生理盐水)。用2.5 mL无菌注射器吸取配制好的BOP溶液,以30°角进针,行实验组金黄地鼠背部中线部位皮下注射,注射剂量为10 mg BOP/kg体重。每周1次,持续7周。对照组皮下注射0.9%生理盐水溶液。每天观察动物基本情况,每周定时测量1次体重,记录每周食物摄入量及饮水量。
1.3 病理组织学检查
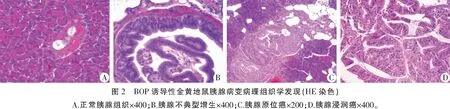
第1次注射后第11周开始,每两周1次,脱臼法随机处死实验组金黄地鼠10只,对照组5只;如有意外死亡的,即时解剖,并计入该周处死量。记录胰腺的肉眼观察结果,完整取下胰腺及胰腺肿瘤,电子称称取肿瘤重量,根据公式V=a2×b/2计算肿瘤体积[3],a代表肿瘤短径,b代表长径,单位为mm。用Bouin液固定,石蜡分别包埋肉眼所见胰腺肿瘤及胰腺组织,常规切片、HE染色,由病理科医师对所有切片进行组织学观察,行组织病理学诊断。以只为单位,记录观察结果。依据Konishi等[4]和Tsutsumi等[5]的方法,将BOP诱导的胰腺病变按进展过程分为不典型导管增生(atypical ductal hyperplasia,ATH)、原位癌(carcinoma in situ,CIS)、浸润癌(invasive carcinoma,CA)三类。即:ATH主要表现为导管(小管)扩张,导管上皮由一层以上细胞构成,伴多形核,被认为是癌前病变;CA表现为不规则的发育异常的小管伴浸润生长,绝大多数伴有特征性炎性反应及纤维组织增生;CIS则表现为腺泡周围局部浸润,没有纤维组织增生。
1.4 统计学分析
2 结果
2.1 实验动物基本情况
实验组与对照组金黄地鼠饮水量在第1~4周均不足150 mL/周,之后逐渐增加,最大饮水量220 mL/周,两组动物饮水量及食物摄取量差异没有统计学意义(P>0.05);实验组平均体重轻于对照组,差异有统计学意义(P<0.05)。17周后部分动物出现黄疸,表现为不同程度的巩膜、唇周、四肢皮毛裸露部皮肤黄染。
2.2 BOP诱导性金黄地鼠胰腺病灶肉眼发现
实验组在18只金黄地鼠中发现23个胰腺肿瘤。其中,1只发现3个胰腺肿瘤,3只发现2个,其余均为单发。其中,7个肿瘤直径<5 mm,16个肿瘤直径≥5 mm,最小肿瘤直径2.0 mm,最大肿瘤直径17.0 mm。肿瘤直径中位数6.8 mm,体积中位数178.7 mm3,质量中位数0.32 g。最早于第1次注射BOP后15周发现胰腺结节(图1为Bouin氏液固定后)。多数肿瘤呈粉红或肉红色,部分肿瘤为红白相间色。部分肿瘤表面不规整,略呈分叶状。剖开肿瘤,可见出血及坏死灶。肿瘤较大时与周围组织结构分界不清,不易剥离。
2.3 病理组织学检查
将BOP诱导的胰腺病变按先前介绍的方法分为ATH、CIS、CA三类(图2),其病理组织学发现见表1。第1次注射BOP后11周,即在10只实验鼠中发现5只胰腺具有不同程度的ATH,共在65只实验鼠中发现ATH。最早于第1次注射BOP后13周发现CIS,共在9只鼠中发现9个CIS;最早于第19周发现CA,实验组共在17只动物中发现22个CA。19周后,所有的实验组动物均发现ATH。镜检发现的所有CIS及CA均为胰腺导管腺癌(pancreatic ductal adenocarcinomas,PDAs)。肉眼发现的23个肿瘤中,20个为CA,3个为CIS;肉眼未能发现的8个PDAs中2个为CA;6个为CIS。实验组总成瘤率(ATH、CIS、CA三类病灶)81.3%(65/80)。第1次注射BOP 11周后不同时间段CIS发现数量没有统计学意义(P>0.05)。将17周前后ATH、CA发现病例数分别合并,行Fisher确切概率检验,差异具有统计学意义(P<0.01)。对照组发现1个胰腺肿瘤,两组差异具有统计学意义(P<0.01)。
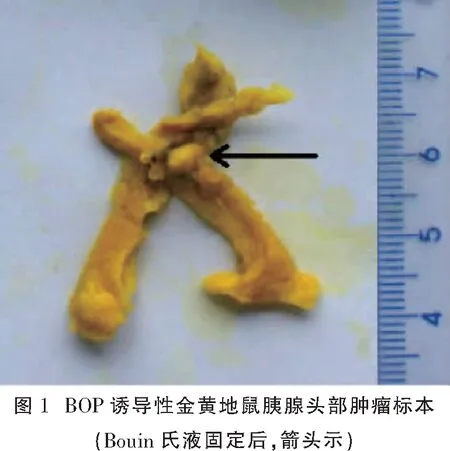
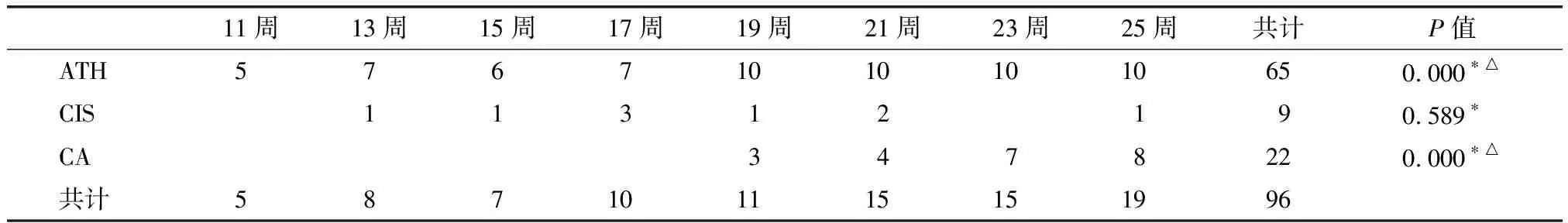
表1 不同时间点BOP诱导金黄地鼠胰腺病变病理发现
注:*Fisher确切概率检验;△ATH组及CA组将17周前后病例数分别合并。
3 讨论
理想胰腺癌动物模型应具备的条件[6]:①保留原发肿瘤生物学特性,癌肿形成过程与人胰腺癌自然发生过程相似,肿瘤酶学反应阳性。②具有客观而量化的指标,实验动物的大小、体重、寿命等适合实验。③实验方法简便易行,对人体无害或危害较少,对环境污染少;周期短,制备的模型具有可靠性、可重复性、有效性及实用性。④可对肿瘤生长和转移相关的细胞和分子现象进行研究。
目前,常见的胰腺癌动物模型包括化学诱导型、种植型及基因工程型[7-11],三者各有优缺点。其中,异位种植性胰腺癌动物模型受到位置特异性影响,与人的胰腺癌自然病程不一致;原位种植性胰腺癌动物模型技术要求较高、实验条件苛刻;而且,异位及原位移植瘤模型的肿瘤皆不是由胰腺自身产生的,不能真正模拟人胰腺癌的发病机制及肿瘤发生、发展过程;基因工程胰腺癌动物模型胰腺病变在遗传学及生物学方面可能与人类明显不同,花费较高,数量上难以满足实验要求。
20世纪70年代,Pour等[12]最早应用BOP诱导金黄地鼠胰腺癌。方法是按10 mg/kg体质量给金黄地鼠皮下注射BOP,每周1次,持续终身后将注射次数改进为10次,最早于第1次注射后第10周发现胰腺瘤变,于第13周开始出现较高的胰腺腺瘤及胰腺腺癌发生率。基于不同动物的BOP诱导实验表明,金黄地鼠经BOP诱导产生胰腺癌,而小鼠、大鼠则不产生胰腺癌,其原因尚不清楚。所有这些特点,使金黄地鼠成为胰腺癌模型的最佳选择,而BOP成为化学诱导物质首选[12]。
我们将BOP注射次数减为7次,减少了药物的毒副作用,以减少动物的死亡率,同样取得了相似的造模效果。实验鼠出现了胰腺ATH、CIS、CA,代表了胰腺癌形成的不同阶段。病理发现包括CIS、CA 共31个肿瘤,均为胰腺导管腺癌,起源于胰岛内及岛周导管(小管)上皮细胞; ATH最早于第1次注射BOP后11周即有发现,19周以后所有的实验组动物均发生ATH,而ATH被认为是胰腺癌癌前病变。我们将ATH、CIS、CA合并统计,总成瘤率高达81.3%。在建模过程中,部分实验鼠还出现了黄疸,表现为不同程度的巩膜、唇周、四肢皮毛裸露部皮肤黄染,以及体重减轻、远处转移(另文介绍)等人胰腺癌具有的表现。
该模型的意义在于建立的方法简单,可重复性强,诱导产生的胰腺肿瘤组织病理学及临床表现与人胰腺癌相似,可用于研究胰腺癌的发生、发展机制及其细胞、病理、分子生物学特性;还可评估药物疗效以及药物、饮食等对胰腺癌肝转移、肝脂质过氧化的影响等[12-16]。该实验提供了一种理想的胰腺癌体内研究动物模型。
【参考文献】
[1] Jemal A,Siegel R,Ward E,et al.Cancer statistics,2006[J].CA Cancer J Clin,2006,56(2):106-130
[2] Jemal A,Siegel R,Ward E,et al.Cancer statistics,2009[J].CA Cancer J Clin,2009,59(4):225-249
[3] Thorsen F,Ersland L,Nordli H,et al.Imaging of experimentalrat gliomas using a clinical MR scanner[J].Neurooncolo.2003,63(3):225-231
[4] Konishi Y,Mizumoto K,Kitazawa S,et al.Early ductal lesions of pancreatic carcinogenesis in animals and hamsters[J].Pancreatol,1990,7(1-3):83-89
[5] Tsutsumi M,Kondoh S,Noguchi O,et al.K-ras mutation in early ductal lesions induced in a rapid production model for pancreatic carcinoma in Syrianhamsters[J].Cancer Res,1993,84(11):1101-1105
[6] 孟令新,李 强,郭仁德,等.裸鼠胰腺癌动物模型及其应用进展[J].中华实验外科杂志,2006,23(12):1583-1584
[7] 马青松,张小明,沈成义.胰腺癌动物模型的类型及特点[J].国际医学放射学杂志,2010,33(2):103-106
[8] Cerny WL,Mangold KA,Scarpelli DG.Action of K-ras in transplantable pancreatic ductal adenocarcinomas of Syrian golden hamsters[J].Carcinogenesis,1990,11(11):2075-2079
[9] Kyriazis AA,Kyriazis AP.Preferential Sites of Growth of Human Tumors in Nude Mice following Subcutaneous Transplantation [J].Cancer Res,1980,40(12):4509-4511
[10] Jia L,Shang YY,Li YY.Effect of antidepressants on body weight,ethology and tumor growth of human pancreatic carcinoma xenografts in nude mice[J].World J Gastroenterol,2008,14(27):4377-4382
[11] Leach SD.Mouse models of pancreatic cancer:the fur is finally flying[J].Cancer Cell,2004,5(1):7-11
[12] Pour P,Althoff J,Krüger FW,et al.A potent pancreatic carcinogen in Syrian hamsters:N-nitrosobis(2-oxopropyl) amine[J].J Natl Cancer Inst,1977,58(5):1449-1453
[13] van Kouwen MC,Laverman P,van Krieken JH,et al.FDG-PET in the detection of early pancreatic cancer in a BOP hamster model[J].Nucl Med Biol,2005,32(5):445-450
[14] Kilian M,Gregor JI,Heukamp I,et al.Matrix metalloproteinase inhibitor RO 28-2653decreases liver metastasis by reduction of MMP-2 and MMP-9 concentration in BOP-induced ductal pancreatic cancer in Syrian Hamsters:inhibition of matrix metalloproteinases in pancreatic cancer[J].Prostaglandins Leukot Essent Faty Acids,2006,75(6):429-434
[15] Heukamp I,Kilian M,Gregor JI,et al.Effects of the antioxidative vitamins A,C and E on liver metastasis and intrametastatic lipid peroxidation in BOP-induced pancreatic cancer in syrian hamsters[J].Pancreatology,2005,5(4-5):403-409
[16] Furukawa M,Yamasaki A,Yoshida J,et al.Mutations of LKB1 gene in pancreatic ductal adenocarcinomas induced by N-nitrosobis(2-oxopropyl)amine in hamsters[J].Anticancer Res,2009,29(10):4047-4050

