河豚毒素DNA适配子的制备及应用
邵碧英,陈 彬,陈文炳,杨 方,缪婷玉,彭 娟
(福建出入境检验检疫局检验检疫技术中心,福建省检验检疫技术研究重点实验室,福建 福州 350001)
河豚毒素DNA适配子的制备及应用
邵碧英,陈 彬,陈文炳,杨 方,缪婷玉,彭 娟
(福建出入境检验检疫局检验检疫技术中心,福建省检验检疫技术研究重点实验室,福建 福州 350001)
人工合成78个碱基的随机ssDNA文库,采用指数富集配基的系统进化技术与诱变聚合酶链式反应(polymerase chain reaction)结合的方法,通过筛选富集、克隆、测序,获得了与河豚毒素(tetrodotoxin,TTX)特异结合的单克隆DNA适配子A3。DNA适配子A3的二级结构主要为茎环结构,与TTX的亲和力为1.254。对适配子和TTX结合的磷酸盐缓冲液pH值、荧光染料结合时间进行优化,结果表明,最适pH值为7.5,最佳结合时间为10 min。建立的快速筛选检测TTX的DNA适配子-荧光染料法对TTX的检出限为10-6mo1/L。
河豚毒素;适配子;荧光染料;检测
河豚毒素(tetrodotoxin,TTX)是一种毒性很强的小分子物质。TTX的检测方法有生物法[1]、荧光光度法[2]、酶免疫分析法[3]、色谱法[4]、色谱-质谱联用法[5-6]、液相色谱-荧光检测法[7-8]等。鼠生物法是测定TTX的传统方法,但该法与小鼠个体差异显著相关,且操作复杂。用酶免疫分析法测定TTX,需要制备TTX的抗体,而TTX是小分子物质,其抗体尤其是单克隆抗体很难制备。液相色谱-质谱联用法等虽然特异性强、灵敏度高,但都需要昂贵的仪器。适配子(又称适体)是通过指数富集配基的系统进化(systematic evolution of ligands by exponential enrichment,SELEX)技术从人工合成的DNA或RNA随机文库中筛选出来的,与非核酸靶物质特异结合的高亲和性单链寡核苷酸序列。目前已有包括病毒[9]、细菌[10-11]、蛋白质[12-13]、染料[14]、抗生素[15-16]、农药[17-19]、生物毒素[20-21]、重金属[22]等多种靶物质适配子筛选及应用的研究报道。本实验在先前研究[23]的基础上,以TTX为靶物质,采用SELEX技术与诱变聚合酶链式反应(polymerase chain reaction,PCR)相结合的方法,从中间为35 个碱基的随机序列、全长为78个碱基的ssDNA文库中筛选、获得了能特异结合TTX的DNA适配子,并以该适配子为探针初步建立了TTX的DNA适配子-荧光染料检测法。
1 材料与方法
1.1 材料与试剂
TTX(纯度≥99%) 成都曼思特生物科技有限公司;随机ssDNA文库、引物,参照文献[23],将随机部分改为35 个碱基,总长为78 个碱基,委托上海生工生物工程技术有限公司合成,随机ssDNA文库用TE溶液(pH 8.0)稀释至浓度为40 μmol/L,引物稀释至10 μmol/L,-20 ℃保存备用;荧光染料EvaGreenTM(使用时按1∶20比例进行稀释;0.01mol/L磷酸盐(phosphatebuffered saline,PBS)缓冲液(pH 6.0~8.0)) 美国Biotium公司;其他材料与试剂参照文献[23]。
1.2 仪器与设备
Uitrospec 1100pro型核酸/蛋白分析仪 英国安玛西亚公司;Tgradient型梯度PCR仪 德国Biometra公司;Infinite F200 Pro增强型荧光化学发光微孔板读数仪瑞士Te can公司。
1.3 方法
1.3.1 TTX DNA适配子的制备
参照文献[23],采用SELEX技术、结合诱变PCR技术,通过克隆、测序、亲和力测定等手段,制备与TTX特异结合的单克隆DNA适配子,用DNAMAN软件分析DNA适配子的核苷酸序列和二级空间结构,并测定适配子与TTX的亲和力。
1.3.2 TTX DNA适配子-荧光染料检测法的建立
1.3.2.1 检测原理
荧光染料EvaGreenTM本身没有荧光,与dsDNA作用时,EvaGreenTM嵌合到dsDNA中,产生较强的荧光信号。当dsDNA与TTX孵育后,TTX能识别与其特异性结合的适配子,并形成适配子-TTX复合物,使dsDNA的双链解开,dsDNA变成ssDNA,嵌合的荧光染料EvaGreenTM从dsDNA中得以释放,从而导致系统荧光信号骤然减弱,通过检测系统中荧光信号的变化就可筛选检测TTX[24]。
1.3.2.2 DNA适配子的dsDNA的制备
以1.3.1节获得的单克隆DNA适配子为模板,参照文献[23],用引物Ⅰ、引物Ⅱ进行PCR扩增,纯化PCR产物,即得到dsDNA,于核酸/蛋白分析仪上测定浓度,用ddH2O将dsDNA稀释至10 pmol/L,-20 ℃保存备用。
1.3.2.3 检测步骤
取DNA适配子的dsDNA,加入适宜pH值的0.01 mol/L磷酸缓冲液,再加入TTX待测样品,室温条件下孵育l h。孵育结束后,加入2 øL荧光染料EvaGreenTM,结合一段时间后,测定荧光强度值,根据荧光变化值判定结果,荧光变化值大的表明TTX含量高。
1.3.2.4 PBS缓冲液pH值的优化
分别取5 øL稀释好的dsDNA于5 个编号为1~5的l.5 mL 离心管中,各管中分别加入589 øL pH值为6.0、6.5、7.0、7.5、8.0的PBS缓冲液(0.01 mol/L)和6 øL TTX溶液(1 mmol/L),混匀,置室温孵育l h;取198 øL TTX与dsDNA反应后的混合液于酶联微孔中,每个pH值重复3 孔,每孔中加入2 øL荧光染料EvaGreenTM,结合10 min;用荧光化学发光微孔板读数仪测定荧光强度值,设置仪器激发波长为485 nm,发射波长为533 nm,取重复3 孔的平均值。
1.3.2.5 荧光染料结合时间的优化
取5 øL稀释好的dsDNA,加589 øL 1.3.2.4节优化选定的PBS缓冲液和6 øL TTX溶液(1 mmol/L),混匀,置室温孵育l h;取198 øL TTX与dsDNA反应后的混合液,加入2 øL荧光染料EvaGreenTM,结合一定时间后,测定荧光强度值,取重复3 孔的平均值。
1.3.2.6 DNA适配子-荧光染料检测法对TTX检出限的测定
用1%乙酸溶液将TTX溶液按照1∶10进行系列稀释,浓度为10-1~10-7mol/L;分别取5 øL 10 pmol/L dsDNA于8 个编号为1~8的l.5 mL 离心管中;每管加589 øL优化选定的PBS缓冲液,1号管中加入6 øL PBS缓冲液作为空白对照,2~8号管中分别加入6 øL 系列稀释的TTX溶液,混匀,置室温孵育l h;取198 øL TTX与dsDNA反应后的混合液,同时取200 øL PBS缓冲液作为背景信号,分别加入2 øL荧光染料EvaGreenTM,结合时间为1.3.2.5节优化后的时间,测定荧光强度值,取重复3 孔的平均值。1.3.3 DNA适配子-荧光染料检测法的实际应用
TTX主要存在于河鲀的性腺、肝脏、脾脏、肾脏、眼睛、皮肤、血液等部位,肉多为弱毒或无毒,因此选取鱼的内脏进行TTX测定的实验。收集非洲鲫鱼、草鱼作为阴性对照。兔头鲀、横纹东方鲀、月腹刺鲀、红鳍东方鲀等河豚鱼样品由本实验收集保存[25]。分别取实验材料的内脏,匀浆,称取5.00 g匀浆试样,参照文献[7]提取、净化TTX,用建立的DNA适配子-荧光染料法检测是否含有TTX。
2 结果与分析
2.1 TTX DNA适配子的制备及分析结果
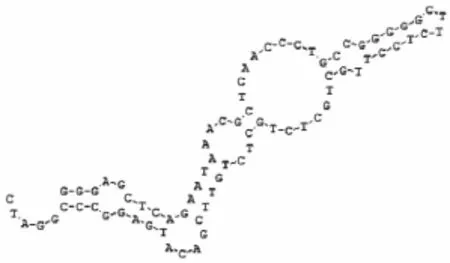
图1 预测的DNA适配子A3的二级结构Fig.1 Predicted secondary structure of the DNA aptamer
将SELEX技术与诱变PCR技术相结合,从随机ssDNA中筛选到能与TTX特异结合、亲和力最高的1 条单克隆DNA适配子(标记为A3),核苷酸序列为:5’-GGG AGC TCA GAA TAA ACG CTC AAC CCT GCC GGG GGC TTC TCC TTG CTG CTC TGC TCT GTT CGA CAT GAG GCC CGG ATC-3’。用DNAMAN软件分析,DNA适配子A3的二级结构预测如图1所示,主要为茎环结构。DNA适配子A3与TTX的亲和力为1.254。
2.2 PBS缓冲液pH值的优化结果
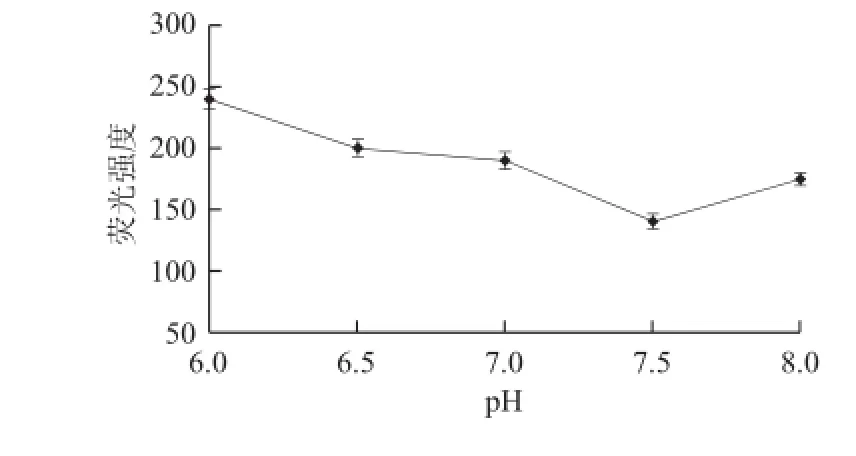
图2 PBS缓冲液pH值的优化结果Fig.2 Selection of optimal PBS buffer solution pH
如图2所示,不同pH值的PBS缓冲液对荧光强度的检测具有显著的影响,当pH值为7.5时,荧光强度值最小,即荧光变化值最大,说明在pH 7.5时,缓冲液对反应体系的影响最小。这是因为荧光强度的变化由EvaGreenTM的释放量决定,EvaGreenTM的释放量又受适配子-TTX结合程度的影响,而pH值能够影响适体-TTX复合物的解离。在pH 7.5时,适体-TTX复合物的解离程度最小,因此pH 7.5是本反应体系的最适pH值。
2.3 荧光染料结合时间的优化结果
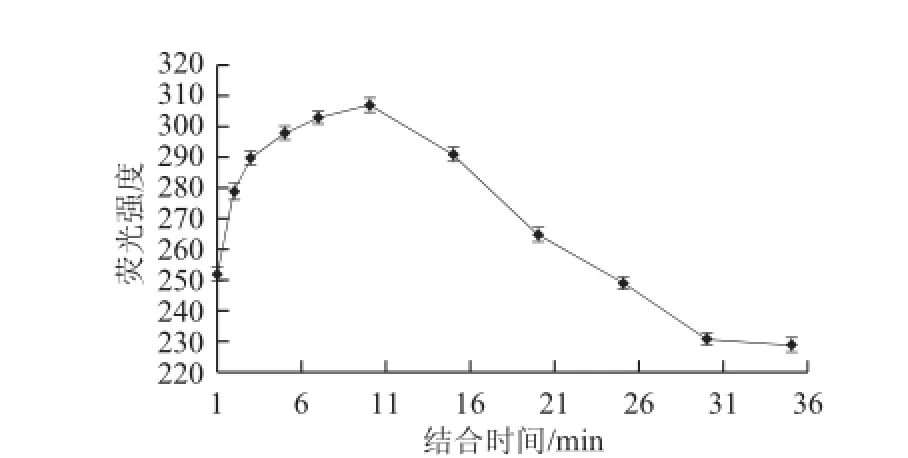
图3 荧光染料结合时间的优化结果Fig.3 Selection of optimal fluorochrome-binding time
如图3所示,在加入染料后,前10 min内荧光强度呈现明显的上升趋势,在10 min时达到最大值,之后荧光强度值逐渐下降,至30 min后趋于稳定。荧光染料与DNA适配子的dsDNA的结合处于一个动态的变化过程,在不断的结合同时又不断的解离,需要反应一段时间才能达到平衡,而染料与DNA适配子的dsDNA结合后也会出现缓慢淬灭,所以在达到最大荧光强度后又开始逐渐减弱。只有当荧光染料与适配子处于结合的最佳状态时,体系才会产生最大荧光。由图3可知,结合时间为10 min时,荧光强度最大,由此表明荧光染料EvaGreenTM与DNA适配子dsDNA的最佳结合时间为10 min。
2.4 DNA适配子-荧光染料法对TTX检出限的测定结果
空白对照的荧光强度为324.5,背景信号为9.57,DNA适配子-荧光染料法对TTX检出限的测定结果如图4所示。随着TTX浓度的减小,所测得的荧光强度与空白对照的变化值越来越小,当TTX浓度为10-7mo1/L时,荧光强度和空白对照很相近,变化值接近于背景信号值,表明此法对浓度为10-7mo1/L TTX的检测已无意义。因此,建立的检测方法可检测低至10-6mo1/L的TTX。
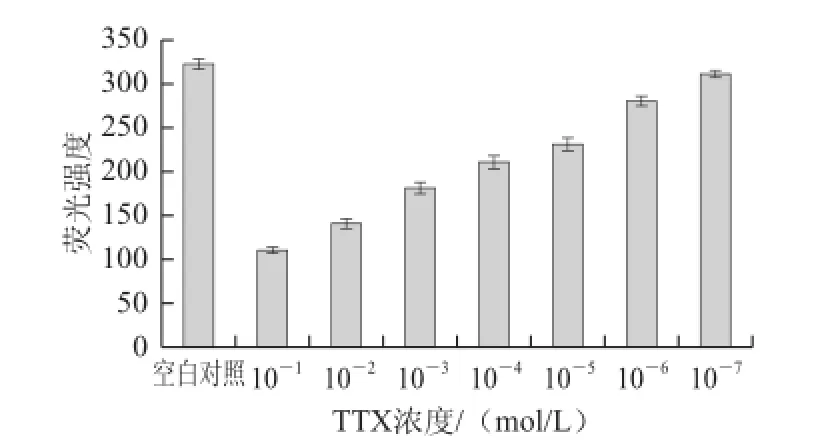
图4 方法检出限的测定结果Fig.4 Detection limit of the developed method
TTX的分子式为C11H17N3O8,相对分子质量为319.271,当TTX浓度为10-6mo1/L时,换算成质量浓度时约为3.19×10-4mg/mL。而现行采用的用于测定TTX的GB/T 23217—2008《水产品中TTX的测定:液相色谱-荧光检测法》中对TTX标准品的检出限为5×10-2mg/mL[23]。由此可见,本实验建立的TTXDNA适配子-荧光染料法的检出限低于现行标准,已经能满足日常检测的需求。
2.5 TTX DNA适配子-荧光染料法的实际应用
用建立的DNA适配子-荧光染料法测定了非洲鲫鱼、草鱼和4 种河豚鱼的内脏提取液的TTX,结果如表1所示,非洲鲫鱼、草鱼的荧光差值极小,而4 种河豚鱼的荧光差值都较大,且大于背景信号,表明4 种河豚鱼的TTX的检测结果均为阳性,也表明建立的检测方法特异性好。

表1 鱼样品中TTTTXX的检测结果(n=3)Table 1 Detection of TTX in fish samples (n = 3)
3 讨 论
荧光染料EvaGreenTM在适配子的应用研究中已得到较广泛应用[24,26]。本实验应用SELEX技术与诱变PCR技术相结合的方法,制备了能特异结合TTX的全长为78个碱基的DNA适配子,并根据DNA适配子-TTX复合物与荧光染料EvaGreenTM的作用,建立了TTX的DNA适配子-荧光染料检测方法。该方法与现有的TTX检测方法相比,无需昂贵的仪器和复杂的操作,具有操作简便、成本低廉、快速、灵敏等优点,但此方法在TTX检测上的精确应用,包括荧光强度变化值与TTX浓度的线性关系、回收率、精密度和重复性等还需进一步研究。
有文献报道,经过实验筛选获得的适配子在实际应用中起主要作用的只是其中的一小部分核苷酸,即所谓的核心区域[27]。一旦分析获得此核心区域,剔除了不需要的核苷酸部分,减少了非核心区域的干扰作用,与靶物质的结合效果更好。在先前的研究中,邵碧英等[23]成功地从总长为113 个碱基的随机ssDNA文库中筛选到与TTX最高亲和力的DNA适配子G10。为了获得碱基数更少的DNA适配子,从而降低下一步识别适配子核心区域的难度,又从总长为78 个碱基的随机ssDNA文库中筛选到了与TTX有最高亲和力并有实际应用效果的DNA适配子A3。适配子A3、G10均包括了两端固定序列以及从随机序列中筛选到的特定序列,其核心区域具体是哪部分核苷酸、以及核心区域的应用效果如何尚待研究。
[1] 张理, 谢克勤, 赵金山, 等. 用昆明小鼠定量测试河豚毒素的研究[J].中国食品卫生杂志, 2004, 16(6): 497-500.
[2] 郑典元, 夏依依, 丁占平. 河豚毒素生物检测法与荧光光度法的比较研究[J]. 湖北农业科学, 2012, 58(7): 163-165; 168.
[3] KAWATSU K, HAMANO Y, YODA T, et al. Rapid and highly sensitive enzyme immunoassay for quantitative determination of tetrodotoxin[J]. Japanese Journal of Medical Science and Biology, 1997, 50(3): 133-150.
[4] 张虹, 柳正良, 黄蓓琳, 等. 反相离子对-高效液相色谱法测定河豚毒素[J]. 中国现代应用药学杂志, 2001, 18(3): 197-198.
[5] 陈晓, 文红梅, 李伟, 等. 亲水液相色谱-质谱联用法测定河豚子中的河豚毒素[J]. 药物分析杂志, 2013, 33(6): 76-79.
[6] 阮丽萍, 蔡梅, 刘华良, 等. 高效液相色谱-串联质谱法测定烤鱼片中的河豚毒素[J]. 江苏预防医学, 2014, 25(2): 11-13.
[7] 杨方, 钱疆, 刘正才, 等. GB/T 23217—2008 水产品中河豚毒素的测定: 液相色谱-荧光检测法[S].
[8] 陈伟珠, 洪专, 张怡评, 等. 河豚毒素的高效液相/荧光精确定量技术研究[J]. 中国卫生检验杂志, 2009, 19(2): 24-25; 33.
[9] KHATI M, SCHUMAN M, IBRAHIM J, et al. Neutralization of infectivity of diverse R5 clinical isolates of human immunodeficiency virus type 1 by gp120-Binding 2’F-RNA aptamers[J]. Virology, 2003, 77(23): 12692-12698.
[10] 陈敏, 江树勋, 邵碧英, 等. 单核增生李斯特氏菌适体的筛选与结构分析[J]. 食品科学, 2009, 30(19): 197-199.
[11] 王雷, 李元跃, 陈融斌, 等. 运用SELEX技术筛选嗜水气单胞菌适配子[J]. 集美大学学报: 自然科学版, 2012, 17(1): 5-9.
[12] TUERK C, GOLD L. Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase[J]. Science, 1990, 249: 505-510.
[13] 郎春燕, 江树勋, 邵碧英, 等. 应用SELEX技术筛选沙门氏菌抗原的适配子[J]. 食品科学, 2011, 32(13): 203-206.
[14] 王琛, 徐丰, 金由辛, 等. 特异亲和活性蓝染料的小分子RNA的SELEX筛选[J]. 生物化学与生物物理学报, 1999, 31(5): 504-508.
[15] KWON M, CHUN S M, JEONG S, et al. In vitro selection of RNA against kanamycin B[J]. Molecules and Cells, 2001, 11(3): 303-311.
[16] 李卫滨, 兰小鹏, 杨湘越, 等. 筛选环孢霉素A适配子的SELEX技术的建立[J]. 中国生物化学与分子生物学报, 2007, 23(10): 829-834.
[17] 雷兆静, 张存政, 刘媛, 等. SELEX技术筛选毒死蜱单链DNA适配子[J]. 江苏农业学报, 2012, 28(1): 204-209.
[18] 张强, 胡秋莲, 张冠, 等. 甲胺磷的核酸适体筛选[J]. 食品安全质量检测学报, 2013, 4(2): 106-110.
[19] 王丽, 刘贤金, 张存政, 等. 4 种有机磷农药DNA适体的筛选及结构分析[J]. 南京农业大学学报, 2013, 58(6): 121-126.
[20] 唐吉军, 谢剑炜, 邵宁生, 等. 采用毛细管电泳技术筛选特异识别蓖麻毒素适配子的研究[J]. 高等学校化学学报, 2006, 27(10): 64-67.
[21] 王文凤. 真菌毒素寡核苷酸适配体的筛选与应用[D]. 无锡: 江南大学, 2012.
[22] 刘庆业, 范燕燕, 凌绍明, 等. 适配子修饰金纳米粒子光度法检测铅[J].冶金分析, 2010, 30(4): 58-61.
[23] 邵碧英, 高兴, 杨方, 等. 河豚毒素DNA适配子的筛选与结构分析[J].中国食品学报, 2012, 12(2): 137-143.
[24] 陈伶利, 李杰, 贺气志, 等. 基于核酸适配体-荧光染料EvaGreenTM快速检测ATP的研究[J]. 湖南中医药大学学报, 2011, 31(5): 6-9.
[25] 陈文炳, 林少华, 邵碧英, 等. 河豚鱼Cyt b基因部分DNA序列分析与应用[J]. 食品科学, 2012, 33(20): 227-232.
[26] CHEN Y, WU Y, WANG J, et al. Identification of cervidae DNA in feedstuff using a real-time polymerase chain reaction method with the new fluorescence intercalating dye EvaGreen[J]. Journal of AOAC International, 2009, 92(1): 175-180.
[27] LIN J S, McNATTY K P. Aptamer-based regionally protected PCR for protein detection[J]. Clinical Chemistry, 2009, 55(9): 1686-1693.
Preparation and Application of Tetrodotoxin DNA Aptamer
SHAO Bi-ying, CHEN Bin, CHEN Wen-bing, YANG Fang, MIAO Ting-yu, PENG Juan
(Fujian Provincial Key Laboratory of Inspection and Quarantine Technology Research, Center of Inspection and Quarantine Technology, Fujian Entry-Exit Inspection and Quarantine Bureau, Fuzhou 350001, China)
A 78-mer ssDNA library was synthesized in vitro. The tetrodotoxin (TTX) specifi c monoclonal DNA aptamer A3 was prepared using systematic evolution of ligands by exponential enrichment (SELEX) combined with mutagenic PCR by screening, enrichment, cloning and sequencing. The secondary structure of the DNA aptamer A3 mainly contained stem ring structure, and the affi nity for tetrodotoxin was 1.254. The PBS buffer pH and fl uorochrome-binding time were optimized. The results showed that the optimum pH was 7.5 and the best binding time was 10 min. As a result, a DNA aptamerfl uorochrome method for rapidly screening and detecting tetrodotoxin was developed with a detection limit of 10-6mo1/L.
tetrodotoxin; aptamer; fluorochrome; detection
Q78
A
1002-6630(2014)24-0205-04
10.7506/spkx1002-6630-201424039
2014-06-30
国家质检总局科研项目(2010IK145;2014IK104)
邵碧英(1973—),女,研究员,博士,研究方向为食品生物学分子检测。E-mail:byshao@sohu.com

