基于电子舌对富含ACE抑制肽大米蛋白水解物的脱苦评价
胡勤玲,郑良清,王 申,易 青,吴永宁,宫智勇*
(武汉轻工大学食品科学与工程学院,农产品加工湖北省协同创新中心,湖北 武汉 430023)
基于电子舌对富含ACE抑制肽大米蛋白水解物的脱苦评价
胡勤玲,郑良清,王 申,易 青,吴永宁,宫智勇*
(武汉轻工大学食品科学与工程学院,农产品加工湖北省协同创新中心,湖北 武汉 430023)
利用风味酶、活性炭、β-环状糊精对大米蛋白水解液进行脱苦,采用电子舌技术评价脱苦效果,并用高效液相色谱法评价脱苦前后的水解物对血管紧张 素转化酶活性抑制效果变化,探讨大米蛋白水解物的最佳脱苦工艺。结果表明,风味酶法脱苦的最佳处理条件为加酶量2.5%、水解时间20 min、水解pH 5.8;活性炭脱苦的最佳处理条件为活性炭用量2.0%、料液温度60℃、处理时间20 min、料液pH 7.0;β-环状糊精脱苦的最佳处理条件为10% β-环状糊精包埋30 min。
血管紧张素转化酶抑制肽;脱苦;电子舌;风味酶;活性炭;β-环状糊精
大米蛋白是一种优质的植物蛋白,经过水解的大米蛋白,可释放出一定的氨基酸和生物活性肽,增大蛋白分子极性,在增大其溶解性的同时,其发泡、乳化等性质也表现出来。随着溶解度增加,其泡沫稳定性和乳化稳定性却并未呈现规律性变化。基于大米蛋白溶解性差的特点,对大 米蛋白进行水解获得 活性多肽就具有很高的研究价值[1-3]。生物活性肽是指有益于生物机体的生命活动或者具有生理作 用的肽类化合物,又称功能肽,它们具有多种生理功能,如激素作用、免疫调节、抗血栓、抗高血压、降胆固醇、抑菌、抗病毒、抗癌作用等[4-5]。
酶法水解蛋白质可得到多种具有高血管紧张素转化酶(angiotensin Ⅰ-converting enzyme,ACE)活性抑制作用的降压肽,但在水解的同时也会有相应的苦味肽形成,严重影响其可食性[6]。苦味肽的分子链中都含有疏水性的环状氨基酸结构,产生的苦味均与舌部味蕾细胞表面蛋白质的三维结构密切相关。苦味化合物与舌部味蕾膜蛋白相互结合后,其疏水基更大程度增加了分子间的结合力,并使结合产物之间的氢键共价键及离子键等之间的结合更加稳定。因此,通常的水溶液很难使已与味蕾蛋白结合的苦味肽游离出来。有学者已对这些苦味物质作过不同程度的研究,这些物质是一些疏水性的肽类,国外有报道用酶法类蛋白反应覆盖法来解决苦味,仍处于理论研究状态,对苦味去除的系统研究和脱苦的大米蛋白功能产品国内报道较少[7-8]。
为得到口感和风味俱佳的多肽产品,人们在科学研究和生产实践中针对性找到许多消除和降低蛋白酶解产物的脱苦技术。现代主要脱苦方法有物理脱苦、酶法脱苦和微生物脱苦3种。对苦味的评价长期以来主要采用感官评定法,但其结果不够客观,易受环境、评价者情绪、健康状况等的影响[9-10]。电子舌作为一种快速检测味觉品质的新技术,能够以类似人的味觉感受方式检测出味觉物质,可以对样品进行量化,同时可以对一些成分含量进行测量,具有高灵敏度、可靠性、重复性[11]。感官评定法依赖经过长期训练、拥有特殊味觉判别能力的品评专家来判断,很多时候难以找到适合的人选,且人的感觉器官在分辨力、敏感度、稳定性等方面存在个体差异并极易受外界因素的干扰[12-14],仪器评价方法则避免了感官评价的不足。电子舌是以人类味觉感受机理为基础研究开发的一种新型现代化分析检测仪器,通 过传感器阵列代替生物味觉味蕾细胞感测检测对象,经系统的模式识别方法得到结果[15]。本研究利用风味酶、活性炭、β-环状糊精对大米蛋白水解液进行脱苦,采用电子舌技术评价脱苦效果,并用高效液相色谱(high performance liquid chromatography,HPLC)法评价脱苦前后ACE抑制肽的效果,探讨大米蛋白水解物的最佳脱苦工艺。
1 材料与方法
1.1 材料与试剂
大米蛋白(蛋白含量81%) 江西恒天实业有限公司;碱性蛋白酶(2.4 AU/g)、胰蛋白酶(1 250 USP)、风味酶(3.0 AU/g) 丹麦Novozymes公司;ACE、马尿酰-组氨酰-亮氨酸(N-hippuryl-his-leu hydrate,HHL)、马尿酸(hippuric acid,Hip) 美国Sigma化学公司;活性炭、β-环状糊精 碧云天生物技术研究所。其他试剂均为分析纯。
1.2 仪器与设备
TS-5000Z型电子舌 日本Insent公司;1525-2998高效液相色谱仪 美国Waters公司;FA 1104N电子天平上海精密科学仪器有限公司;EMS-8A加热磁力搅拌器天津市欧诺仪器仪表有限公司;PB-10普及型pH计 德国Sartorius 公司;TGL-205离心机 长沙平凡仪器仪表有限公司;HD-3紫外检测器 上海沪西分析仪器厂。
1.3 方法
1.3.1 大米蛋白的双酶水解[16]
具体工艺流程:大米蛋白→酶解(底物质量分数7.5%,碱性蛋白酶加酶量2%(占底物蛋白质量分数,下同)、温度55 ℃、pH 9.0、酶解时间120 min;胰蛋白酶加酶量2%、温度37℃、pH 8.0、酶解时间30 min)→灭酶(调节pH 5.0)→离心(4 000 r/min,10 min)→上清液→大米蛋白水解液。
1.3.2 大米蛋白水解物的脱苦
1.3.2.1 风味酶脱苦单因素试验
风味酶控制肽的苦味脱除,有氨肽酶法和羧肽酶法。氨肽酶作用于N端疏水氨基酸,使其水解变成游离的氨基酸;而羧肽酶作用于肽链碳端的疏水氨基酸,使其释放出来,从而达到脱苦、去苦的目的[17]。风味酶的反应最佳温度为50 ℃,最佳pH值范围5.0~7.0,故从加酶量、水解时间和水解pH值3 个方面进行单因素试验,由于水解后的pH值对苦味有影响,因此将各处理条件下的大米蛋白水解液pH值统一调整到7后再通过电子舌评价分别考察3 个因素对水解液苦味脱除的影响。
1.3.2.2 风味酶脱苦正交试验
通过电子舌评价所确定的单因素试验结果,确定3 个因素的取值水平范围,进行正交试验确定最佳水解条件组合,正交试验设计因素水平见表1。

表1 风味酶脱苦正交试验因素水平表Table 1 Hydrolysis parameters and levels for orthogonal array design
1.3.2.3 活性炭脱苦单因素试验
活性炭具有丰富的内部孔隙结构和较高的比表面积,是一种优良的吸附材料。其物理、化学性质稳定,耐酸碱,能经受水湿、高温及高压,不溶于水和有机溶剂,活性炭对疏水性氨基酸等的吸附,可使苦味消失,活性炭脱苦法是脱除蛋白水解物苦味最早使用的方法[18]。从活性炭用量、料液pH值、料液温度及处理时间4 个方面进行单因素试验,由于水解后的pH值对苦味有影响,因此将各处理条件下的大米蛋白水解液的pH值统一调整到7后再通过电子舌评价分别考察4 个因素对水解液苦味脱除的影响。
1.3.2.4 活性炭脱苦正交试验
考察活性炭用量、料液pH值、料液温度及处理时间对脱苦效果的影响,选用L9(34)正交试验来确定最佳脱苦条件,正交试验设计因素水平见表2。
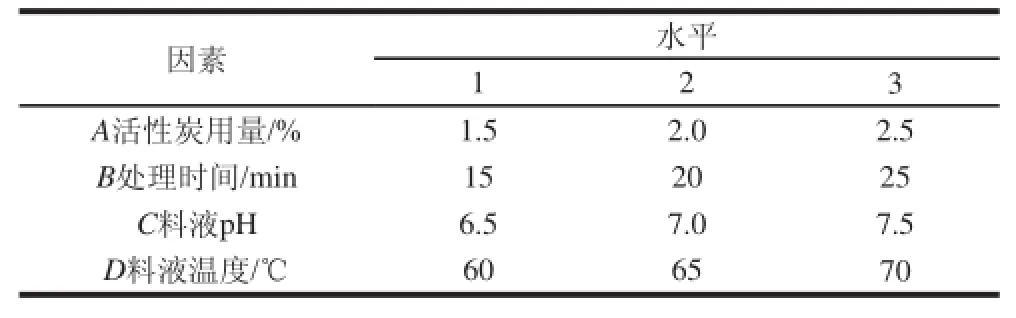
表2 活性炭脱苦正交试验因素水平表Table 2 Active carbon treatment parameters and levels for orthogonal array design
1.3.2.5 β-环状糊精脱苦
分别将质量分数1%、2%、3%、4%、5%、6%、7%、8%、9%、10%的β-环状糊精添加到一定蛋白质量分数(肽含量50%)的大米蛋白水解液中,置于50℃水浴锅,每隔10 min取出50 mL,取8 次,取出后通过电子舌评价分别考察β-环状糊精质量分数和包埋时间对水解液苦味脱除的影响。
1.3.3 苦味的评价方法
将1.3.1节中得到的大米蛋白双酶水解液作为基准液,其苦味值定义为0,取70 mL脱苦后的大米蛋白水解液倒入电子舌配备的小塑料杯中,每个约35 mL作为平行,放入仪器中进行测试,利用苦味传感器获得味觉数据结果,得到其苦味值。电子舌评价得到4 组苦味值,由于第1组值稳定性较差,故选择后3组苦味值,取其平均值,得到最终的苦味值。
1.3.4 ACE活性抑制的评价[19-20]
采用高效液相色谱法,将HHL溶解在0.05 mol/L pH 8.3的硼酸盐缓冲液中(含0.3 mol/L氯化钠),配制成浓度为2.5 mmol/L的HHL溶液。依次加入30 μL的HHL、10 μL不同脱苦条件下的大米蛋白水解液,37 ℃恒温水浴5 min,然后加入20μL ACE液,恒温反应1 h后加入70 μL 1 mol/L HCl溶液终止反应,得到供试液。取20 μL供试液进样,通过HPLC图谱定量马尿酸的生成量,以马尿酸的生成量来计算样品的ACE活性抑制率,见下式。
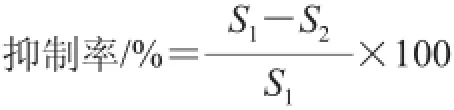
式中:S1为马尿酸标准品峰面积;S2为样品马尿酸峰面积。
色谱条件:色谱柱Phenomenex C18(4.6 mm×250 mm),流动相A:水(含0.05%三氟乙酸),流动相B:乙腈(含0.05% TFA);梯度洗脱条件:0~15 min:B为10%~60%,15~18 min:B为60%~10%;二极管阵列检测器,检测波长:228 nm;流速:0.8 mL/min;进样量:20 μL;柱温:25 ℃。
1.4 数据处理
数据采用SPSS 17.0统计分析软件进行处理。
2 结果与分析
2.1 风味酶脱苦苦味评分
2.1.1 单因素试验结果
由表3可以看出,当加酶量为2.5%时水解液的苦味值最低,故选择加酶量为2.5%;随着水解时间的延长,水解液的脱苦效果反而不理想,在水解时间为0.5 h时苦味值较低,故选择水解时间为0.5 h;水解pH值为6.0时,苦味值最低,故选择水解pH值为6.0,正交试验在此基础上确定因素水平范围。

表3 风味酶脱苦电子舌评定结果Table 3 Evaluation of the debittering efficiency of flavourzyme by one-factor-at-a-time dessiiggnn
2.1.2 风味酶脱苦电子舌法正交试验结果
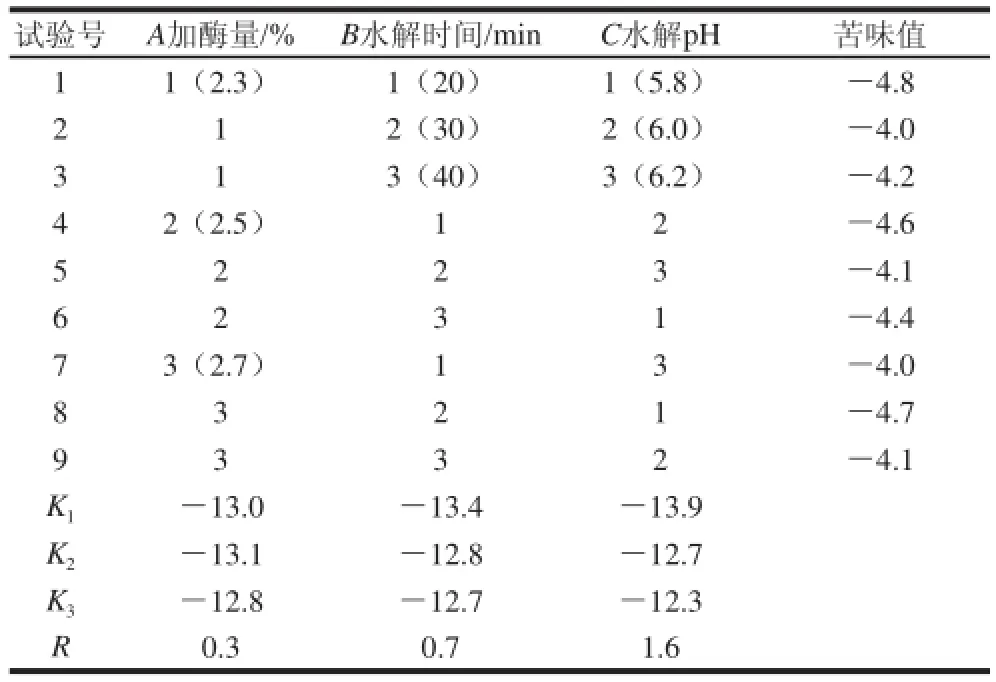
表4 风味酶脱苦电子舌法正交试验设计与结果Table 4 Orthogonal array design and results for debittering with flavourzyme yme
由表4极差分析可知,采用电子舌评价方法,酶解条件对风味酶法脱苦的影响依次为水解pH值>水解时间>加酶量,得到最优方案为加酶量2.5%、水解时间20 min、水解pH 5.8,将此最优方案与正交表中苦味值最低的第1号试验作对比试验,在该条件下大米肽的苦味值为-5.1,优于第1号试验,故风味酶法脱苦的最佳处理条件为加酶量2.5%、水解时间20 min、水解pH 5.8。
2.2 活性炭脱苦的苦味评分
2.2.1 单因素试验结果

表5 活性炭脱苦电子舌评定结果Table 5 Evaluation of the debittering efficiency of active carbon by one-factor-at-a-time dessiiggnn
由表5可以看出,在活性炭用量2%、处理时间20 min、料液pH 7时苦味值最低;随着料液温度的升高,苦味值降低,在65 ℃时,苦味值最低,但如再升高料液温度,可能会影响大米肽的活性,故选择料液温度为65℃,正交试验在此基础上确定因素水平范围。
2.2.2 活性炭脱苦电子舌法正交试验结果
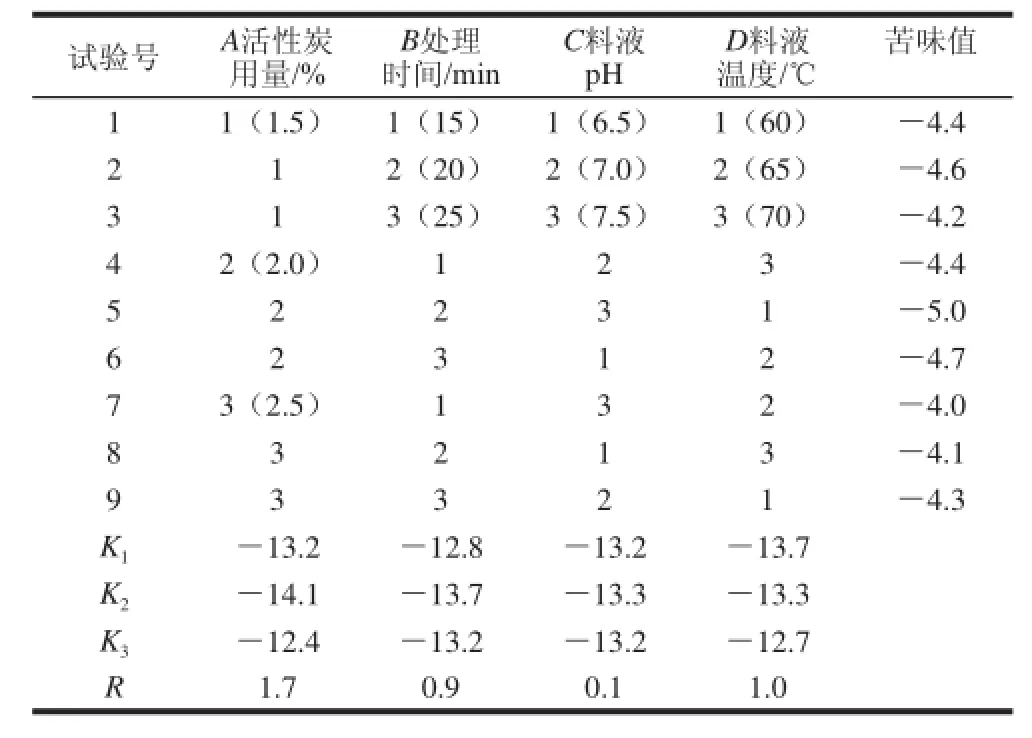
表6 活性炭脱苦电子舌法正交试验设计与结果Table 6 Orthogonal array design and results for debittering with activated carrbboonn
由表6极差分析可知,采用电子舌评价方法,反应条件对活性炭脱苦的影响依次为活性炭用量>料液温度>处理时间>料液pH值,得到最优方案活性炭用量2.0%、料液温度60℃、处理时间20 min、料液pH 7.0,将此最优方案与正交表中最好的第5号试验作对比实验,在该条件下大米肽的苦味值为-5.2,优于第5号试验,故活性炭脱苦的最佳处理条件为活性炭用量2.0%、料液温度60℃、处理时间20 min、料液pH 7.0。
2.3 β-环状糊精脱苦试验苦味评分
通过电子舌评价分别考察β-环状糊精质量分数和包埋时间对水解液苦味脱除的影响,其结果见图1。
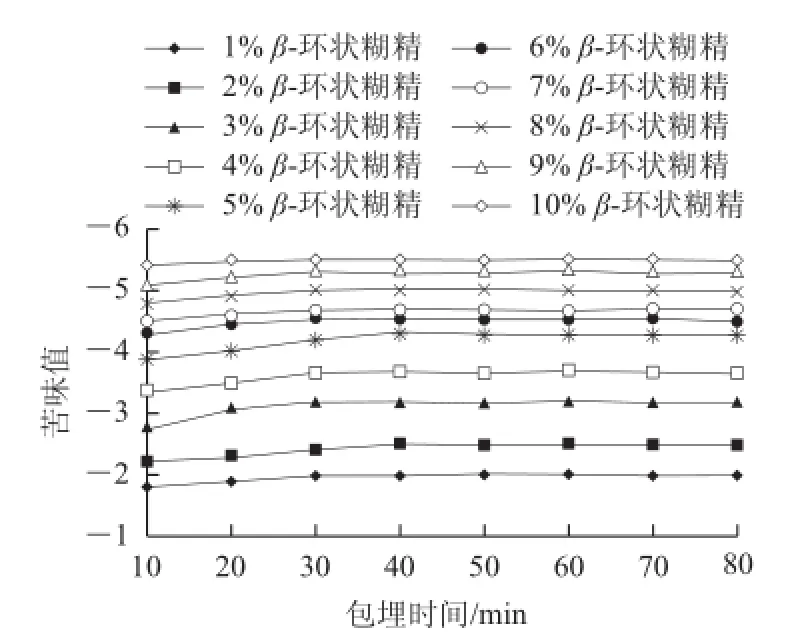
图1 1 β-环状糊精脱苦实验电子舌评价Fig.1 Evaluation of the debittering efficiency of β-cyclodextrin by one-factor-at-a-time design
由图1可以看出,随着β-环状糊精添加量的增加,大米肽的苦味值降低,由于电子舌不能辨别出糊口感,其检测出的各质量分数β-环状糊精的脱苦效果均有差异,故选择β-环状糊精添加量为10%;包埋30 min后,不同质量分数β-环状糊精的苦味值已基本没有变化,苦味基本脱除,故选择包埋时间为30 min。
2.4 不同脱苦方法对大米肽ACE抑制活性的影响
2.4.1 风味酶法脱苦对大米肽ACE抑制率的影响
通过测定大米蛋白双酶水解液及经风味酶法脱苦处理的典型试样1、4、8号ACE抑制率,考察该脱苦工艺对大米蛋白水解物ACE抑制活性的影响,其结果见图2。

图2 电子舌评价典型试样ACE抑制率Fig.2 ACE inhibitory activity of rice protein hydrolyzates debittered with flavourzyme
由图2可知,经风味酶脱苦后的3 个典型试样相对于未脱苦的大米蛋白水解液其ACE抑制率仅试样1有显著降低,试样4和试样8没有显著变化,且电子舌评价典型试样4的ACE抑制率相对最高。
2.4.2 活性炭脱苦对大米肽ACE抑制活性的影响
通过测定大米蛋白双酶水解液及经活性炭脱苦处理典型试样2、5、6号的ACE抑制率,考察该脱苦工艺对大米蛋白水解物ACE抑制活性的影响,其结果见图3。
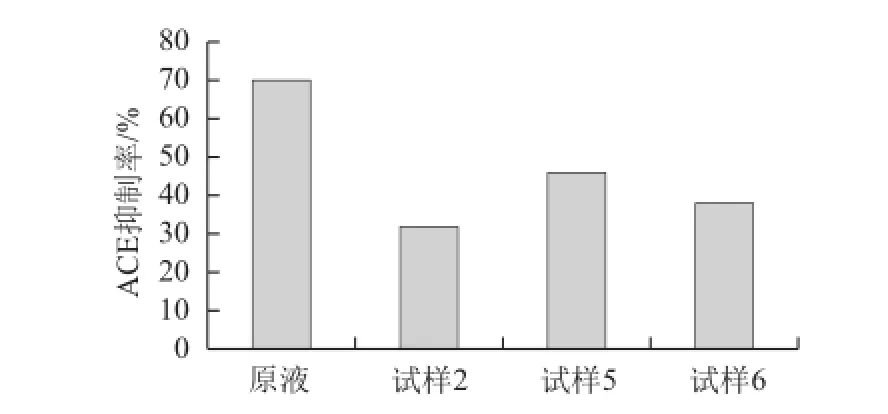
图3 电子舌评价典型试样ACE抑制率Fig.3 ACE inhibitory activity of rice protein hydrolyzates debittered with active carbon
由图3可知,经活性炭脱苦后的大米蛋白水解液的ACE抑制率与未经脱苦的大米蛋白双酶水解物相比都有很大程度的下降,经统计学分析其ACE抑制率相对原液均有显著下降。活性炭对疏水性氨基酸等的吸附,使苦味的消失常伴随着营养价值的下降[21]。
3 讨 论
本研究利用风味酶、活性炭、β-环状糊精对大米蛋白水解液进行脱苦,采用电子舌技术评价脱苦效果,并用HPLC法评价脱苦前后的水解物对ACE的抑制活性,探讨大米蛋白水解物的最佳脱苦工艺。结果表明,风味酶法脱苦的最佳处理条件为加酶量2.5%、水解时间20 min、水解pH 5.8;活性炭脱苦的最佳处理条件为活性炭用量2.0%、料液温度60 ℃、处理时间20 min、料液pH 7.0;β-环状糊精脱苦的最佳处理条件为β-环状糊精添加量10%、包埋时间30 min。
ACE能够调节血压,在预防高血压中,ACE活性的抑制率是一个重要的指标[22]。风味酶法脱苦的几个典型试样的ACE抑制率相比未脱苦的大米蛋白水解液略有降低;而活性炭脱苦法虽有很好的脱苦效果,但其几个典型试样的ACE抑制率相比未脱苦的大米蛋白水解液有显著降低;这主要是由于活性炭是表面吸附剂,对苦味肽吸附的同时也吸附了其他的肽氨基酸等[23];由于β-环状糊精将肽包合,无法测定其对ACE抑制活性的影响,理论上说该法不会造成氮损失,在消化过程中被包合的肽可释放出来[24-25]。这3 种方法都有较好的脱苦效果,但β-环状糊精脱苦法无法测定其对ACE抑制活性的影响,若从考虑原料的利用率来说,可选择活性炭脱苦法,因为活性炭可以回收再利用,且活性炭脱苦操作比较简单;若从营养与安全的角度考虑,可选择风味酶法脱苦,因为其脱苦效果好且ACE抑制率基本没有显著变化[26-27]。
[1] 王章存, 申瑞玲, 姚惠源. 大米蛋白研究进展[J]. 中国粮油学报, 2004, 19(2): 11-15.
[2] 陈季旺, 姚惠源. 大米蛋白的开发利用[J]. 食品工业科技, 2002, 23(6): 87-89.
[3] AGBOOLA S, NG D, MILLS D. Characterisation and functional properties of Australian rice protein isolates[J]. Journal of Cereal Science, 2005, 41(3): 283-290.
[4] 庞广昌, 王秋韫. 生物活性肽的研究进展理论基础与展望[J]. 食品科学, 2001, 22(2): 80-84.
[5] KORHONEN H, PIHLANTO A. Bioactive peptides: production and functionality[J]. International Dairy Journal, 2006, 16(9): 945-960.
[6] 许永红. 蛋白质酶法水解物苦味的控制[J]. 食品工业科技, 1997, 18(3): 1-4.
[7] LIU Xiaowei, JIANG Deshou, PETERSON D G. Identification of bitter peptides in whey protein hydrolysate[J]. Journal of Agricultural and Food Chemistry, 2014, 62(25): 5719-5725.
[8] 裴晓惠, 张佳程, 齐建勋, 等. 核桃蛋白肽脱苦及其对ACE抑制活性的影响[J]. 食品工业科技, 2012, 33(20): 236-239.
[9] 姜曼, 宋俊梅. 大豆肽营养功能及脱苦方法研究进展[J]. 粮食与油脂, 2009, 10(4): 42-44.
[10] SAHA B C, HAYASHI K. Debittering of protein hydrolyzates[J]. Biotechnology Advances, 2001, 19(5): 355-370.
[11] 黄秋婷, 黄惠华. 电子舌技术及其在食品工业中的应用[J]. 食品与发酵工业, 2004, 30(7): 98-101.
[12] 王佳佳, 胡志和, 赵悦. 利用电子舌对富含ACE抑制肽的酪蛋白水解物的脱苦评价[J]. 食品科学, 2013, 34(4): 212-216.
[13] JIN Ting, WU Yuxue, WANG Qiang. Production and characteristics of protein hydrolysates from Bombay duck (Harpodon nehereus)[J]. Journal of Food Processing and Preservation, 2012, 36(1): 30-37.
[14] KOO S H, BAE I Y, LEE S, et al. Evaluation of wheat gluten hydrolysates as taste-active compounds with antioxidant activity[J]. Journal of Food Science and Technology, 2011, 25(2): 1-8.
[15] 蒋丽施. 电子舌在食品感官品评中的应用[J]. 肉类研究, 2011, 25(2): 49-52.
[16] 蔡广霞. 大米源血管紧张素转化酶抑制肽的复合酶法制备、纯化及构效关系研究[D]. 武汉: 武汉工业学院, 2012.
[17] 刘俊花, 葛玉, 张宝善. 食品风味酶的研究进展[J]. 中国酿造, 2005, 24(2): 6-8.
[18] 魏娜, 赵乃勤, 贾威. 活性炭的制备及应用新进展[J]. 材料科学与工程学报, 2003, 21(5): 777-780.
[19] CHEUNG H S, CHUSHMAN D W. Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung[J]. Biochem Pharmacol, 1971, 20(5): 1637-1648.
[20] WU Jianping, DING Xiaolin. Characterization of inhibition and stability of soy protein derived angiotensin Ⅰ-converting enzyme inhibitory peptides[J]. Food Research International, 2002, 35(10): 367-375.
[21] WU Shaohui, WEI Juan, YU Xin, et al. Technology of enzymatic hydrolysis to silver carp protein and debittering and deodourization effects of active carbon[J]. Guangdong Agricultural Sciences, 2010, 11(2): 58-63.
[22] CHEN Jiwang, WANG Yimei, ZHONG Qixin, et al. Purifi cation and characterization of a novel angiotensin-Ⅰ converting enzyme (ACE) inhibitory peptide derived from enzymatic hydrolysate of grass carp protein[J]. Peptides, 2012, 33(1): 52-58.
[23] CHEN Zhicheng. Study on the debitterizing techniques of ponkan juice[J]. Journal of Guangxi Vocational and Technical College, 2009, 4(2): 4-9.
[24] HOU Lixia, WANG Jinshui, ZHANG Duo. Optimization of debittering of soybean antioxidant hydrolysates with β-cyclodextrins using response surface methodology[J]. Journal of Food Science and Technology, 2013, 50(3): 521-527.
[25] LINDE G A, JUNIOR A L, FARIA E V, et al. The use of 2D NMR to study β-cyclodextrin complexation and debittering of amino acids and peptides[J]. Food Research International, 2010, 43(1): 187-192.
[26] 李丹丹, 江连洲, 李杨, 等. 风味酶和活性炭对大豆分离蛋白水解液脱苦效果比较研究[J]. 中国油脂, 2011, 36(8): 24-27.
[27] SEO W H, LEE H G, BAEK H H. Evaluation of bitterness in enzymatic hydrolysates of soy protein isolate by taste dilution analysis[J]. Journal of Food Science, 2008, 73(Suppl 1): 41-46.
Using Electronic Tongue to Evaluate the Effect of ACE Inhibitory Peptide Enrichment on Debittering Rice Protein Hydrolyzate
HU Qin-ling, ZHENG Liang-qing, WANG Shen, YI Qing, WU Yong-ning, GONG Zhi-yong*
(Hubei Collaborative Innovation Center for Processing of Agricultural Products, College of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
This work was executed to explore the best debittering process for rice protein hydrolysate by separately using fl avourzyme, active carbon and β-cyclodextrin. The debittering effi ciency was measured by means of electronic tongue (ET) and the angiotensin Ⅰ-converting enzyme (ACE) inhibitory activity of rice protein hydrolysate before and after debittering was evaluated by high performance liquid chromatography (HPLC). Results showed that the optimal debittering conditions were hydrolysis at an initial pH of 5.8 for 20 min with 2.5% of fl avourzyme, treatment at 60 ℃ for 20 min with 2.0% of active carbon or embedding for 30 min with 10% of β-cyclodextrin.
ACE inhibitory peptides; debittering; electronic tongue; fl avourzyme; active carbon; β-cyclodextrin
TS252.4
A
1002-6630(2014)24-0024-05
10.7506/spkx1002-6630-201424005
2014-06-22
国家高技术研究发展计划(863计划)项目(2010AA023003);武汉轻工大学校研究生创新基金资助项目(2013cx018)
胡勤玲(1987—),女,硕士研究生,研究方向为食品营养与安全。E-mail:huqinling1029@163.com
*通信作者:宫智勇(1966—),男,教授,博士,研究方向为食品营养与安全。E-mail:gongzycn@163.com

