沙葱总黄酮提取工艺优化及其体外抗氧化、抗菌作用
萨茹丽,木其尔,王翠芳,包玲玲,敖长金,*,王思珍
(1.内蒙古农业大学动物科学学院,内蒙古 呼和浩特 010018;2.内蒙古民族大学动物科学技术学院,内蒙古 通辽 028000)
沙葱总黄酮提取工艺优化及其体外抗氧化、抗菌作用
萨茹丽1,木其尔1,王翠芳1,包玲玲1,敖长金1,*,王思珍2
(1.内蒙古农业大学动物科学学院,内蒙古 呼和浩特 010018;2.内蒙古民族大学动物科学技术学院,内蒙古 通辽 028000)
在单因素试验的基础上,采用响应面方法对纤维素酶辅助提取沙葱总黄酮的工艺参数进行优化,得到最优工艺条件为提取时间4 h、提取温度39 ℃、体系pH 4.3,沙葱总黄酮提取量为5.48 mg/g。通过体外抗氧化及抗菌实验得出,此条件下提取所得沙葱总黄酮具有较好的总还原能力、体外清除DPPH自由基及清除羟自由基的能力,对沙门氏菌具有较好的抑制作用,对大肠杆菌和金黄色葡萄球菌的抑制作用较弱,对绿脓杆菌无抑制作用。
沙葱;总黄酮;响应面法;体外抗氧化;体外抗菌
沙葱(Allium mongolicum Regel)为百合科葱属植物[1],在蒙古语中称之为“胡穆利”,学名“蒙古韭”,是广泛生长于荒漠草原上的野生植物,营养成分丰富,所含氨基酸与微量元素种类齐全[2]。研究表明沙葱及其提取物,如沙葱多糖、沙葱黄酮等在抗氧化[3-5]、抗菌及提高畜产品品质[6-8]、改善家畜免疫机能[9-11]等方面具有较好的生物功效。但因传统的沙葱黄酮提取工艺黄酮得率较低,耗时较长,不利于大规模的沙葱黄酮的提取,所以本研究在单因素试验的基础上,依据Box-Behnken试验设计原理,设计三因素三水平的响应面优化方案,对沙葱总黄酮的纤维素酶酶解法提取工艺参数进行优化,并对该工艺条件下提取所得沙葱总黄酮的体外抗氧化以及抗菌作用进行研究,旨在为沙葱资源的全面开发利用与生产实践提供理论依据。
1 材料与方法
1.1 材料、菌种与试剂
新鲜沙葱样品采自内蒙古鄂尔多斯市鄂托克前旗天然牧场。将样品洗净,65 ℃烘干,粉碎,过80 目筛,按1∶10(g/mL)的比例加入石油醚进行脱脂、脱色处理,挥干石油醚后得沙葱粉末,干燥贮存备用[12]。
菌种:大肠杆菌(ATCC-25922)、金黄色葡萄球菌(ATCC-25923)、绿脓杆菌(27853)、沙门氏菌(50096),均由内蒙古医科大学病原微生物实验室提供,使用前复苏培养至对数生长期。
芦丁标准品 贵州迪大科技有限责任公司;纤维素酶(cellulase R-10)、2,6-二叔丁基对甲酚(butylated hydroxytoluene,BHT)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma公司;清除羟自由基试剂盒 南京建成生物科技公司;其他试剂均为国产分析纯。
1.2 仪器与设备
RE52CS旋转蒸发仪 上海亚荣生化仪器厂;Synergy H4多功能酶标仪 美国伯腾科技有限公司;恒温水浴锅 常州诺基仪器有限公司;冷冻干燥机 德国Merck Milipore公司;恒温培养箱 苏州威尔公司。
1.3 方法
1.3.1 沙葱提取物的制备
准确称取0.1 g沙葱粉末置于15 mL试管中,参照文献[13-14]中的实验方案并进行优化,按照料液比1∶50(g/mL)加入体积分数75%乙醇溶液,并加入纤维素酶3mg,调节体系pH 4.3,40℃反应5h,反应结束后将试管置于沸水中水浴10 min灭活酶后,将所得产物经2 000 r/min离心10 min,收集上清液,冷冻干燥后得沙葱提取物。
1.3.2 沙葱总黄酮的鉴定
准确称取沙葱提取物100 mg,蒸馏水定容至10 mL即得质量浓度为10 mg/mL的沙葱提取液。对沙葱提取液进行紫外光谱扫描,初步确定沙葱提取液中是否存在黄酮类物质的特有吸收峰,之后采用紫外线照射法、盐酸镁粉法、三氯化铁法、氢氧化钠法对沙葱提取液中所含的黄酮类物质进行特征鉴别,进一步确定沙葱提取液中所含黄酮类物质的种类。
1.3.3 芦丁标准曲线的绘制
参照文献[13-14]方法。准确称取105 ℃烘干至质量恒定的芦丁标准品6.0 mg,用95%乙醇溶解,定容至10 mL,得0.6 mg/mL的芦丁标准品原液。将芦丁标准品原液稀释成不同质量浓度芦丁标准品应用液后,按照NaNO2-Al(NO3)3法进行反应(根据预实验结果确定NaNO2-Al(NO3)3法对沙葱中黄酮类化合物的检测准确度较高,精密度与稳定性均优于其他黄酮类化合物的检测方法),使用多功能酶标仪测定反应液在510 nm波长处吸光度,并以芦丁标准品质量浓度为横坐标,吸光度为纵坐标绘制标准曲线。
1.3.4 沙葱总黄酮提取量的计算
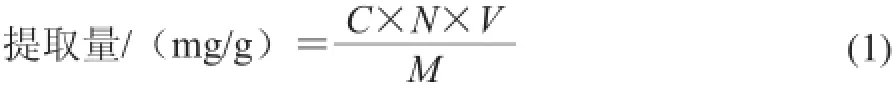
式中:C为测定液中总黄酮含量/(mg/mL);N为稀释倍数;V为样品体积/mL;M为原料质量/g。
1.3.5 单因素试验
影响酶促反应的关键因素是酶添加量、提取时间、提取温度以及反应体系pH值,因此在单因素试验中以体积分数75%乙醇溶液为提取溶剂,分别固定料液比1∶50(g/mL)、纤维素酶添加量4.5 mg/g、体系pH 4.4、提取温度40 ℃、提取时间3 h,重点考察纤维素酶添加量、体系pH值、提取温度、提取时间对沙葱总黄酮提取量的影响。
1.3.6 响应面优化试验设计
综合单因素试验结果,参照文献[14-15],依据Box-Behnken试验设计原理,选择对沙葱总黄酮提取量影响较显著的单因素提取时间、提取温度及体系pH值为因素,设计三因素三水平的响应面分析方案,试验因素及水平见表1。

表1 沙葱总黄酮提取响应面试验因素与水平Table 1 Factors and levels used in RSM for total flavonoids from Allium mongolicum Regel
1.3.7 沙葱总黄酮体外抗氧化活性测定
1.3.7.1 沙葱总黄酮总还原能力测定
总还原能力以吸光度表示,按照本实验优化的沙葱总黄酮提取工艺提取沙葱总黄酮原液,经冷冻干燥后得沙葱总黄酮,临用前使用95%乙醇配制成实验所需质量浓度,对照组使用相同质量浓度的BHT。在试管中分别加入2.5 mL pH 6.6的磷酸盐溶液,再加入0.01 g/mL的铁氰化钾溶液1 mL,混匀后加入不同质量浓度的样品溶液1 mL,充分摇匀后于50 ℃水浴静置20 min,待冷却后迅速加入10%三氯乙酸溶液2.5 mL混匀,吸取2 mL于另一试管中,加入0.1 g/mL的三氯化铁溶液1 mL混匀,静置10 min后于700 nm波长处检测吸光度。
1.3.7.2 沙葱总黄酮体外DPPH自由基清除能力测定
准确称取7.88 mg DPPH,用95%乙醇溶解并定容于100 mL容量瓶中,得浓度为2×10-4mo1/L的DPPH原液,避光保存(0~4 ℃)。沙葱总黄酮在实验前用95%乙醇配制成所需质量浓度,对照组使用相同质量浓度的BHT。分别取100 μL不同质量浓度的样品溶液与2×10-4mol/L DPPH液100 μL于96 孔板中,中速混匀5 min,避光反应30min后测定525nm波长处吸光度(Ai)。与此同时分别测定100 μL 95%乙醇加100 μL DPPH后的吸光度(Ac)和100 μL待测液加100 μL 95%乙醇后的吸光度(Aj)。样品对有机自由基的清除能力以清除率表示,清除率按式(2)计算:

1.3.7.3 羟自由基清除能力测定
按照南京建成生物科技公司试剂盒操作说明书进行操作。
1.3.8 沙葱总黄酮抑菌能力测定
抑菌圈直径的测定与最小抑菌浓度(minimal inhibitory concentration,MIC)的检测试验方法参照文献[5]报道的方法进行,沙葱总黄酮的体外抑菌率实验方法参照许颖等[17]的方法进行。
1.4 数据统计与分析
数据使用Excel 2010进行初步整理分析,Design-Expert 8.04软件进行响应面的设计与分析,SAS 9.0软件进行显著性检验,结果以±s表示,n=5。
2 结果与分析
2.1 沙葱总黄酮的鉴定

图1 紫外扫描结果Fig.1 UV absorption spectrum of total flavonoids from Allium mongolicum Regel
沙葱提取液的紫外扫描结果见图1,可知沙葱提取液分别在250~280 nm及330~370 nm存在吸收峰,此结果符合黄酮类物质在紫外吸收区域有两个吸收峰的紫外吸收特征,判断沙葱提取液中含有黄酮类物质。

表2 黄酮类化合物的显色反结果Table 2 Color reactions for identification of the extracted flavonoids
由表2可知,沙葱提取液经多种黄酮类物质的特异性颜色反应后可以确定沙葱提取液中含有黄酮类、黄酮醇类化合物,因此将沙葱提取液命名为沙葱总黄酮提取液。
2.2 芦丁标准曲线的绘制
以芦丁为标准品,以510 nm波长处测得的吸光度为纵坐标、芦丁标准品质量浓度为横坐标,使用Excel软件进行标准曲线的绘制,得出芦丁标准曲线。所得标准曲线回归方程为y=3.903 8x+0.351 5,方程的决定系数R2=0.999 8,可以用于沙葱总黄酮提取液中总黄酮含量的计算。
2.3 单因素试验结果
2.3.1 纤维素酶添加量对沙葱总黄酮提取量的影响

图2 纤维素酶添加量对沙葱总黄酮提取量的影响Fig.2 Effect of enzyme loading on the extraction efficiency of total flavonoids from Allium mongolicum Regel
固定料液比1∶50(g/mL)、提取温度40 ℃、反应体系pH 4.4、提取时间2 h,选择纤维素酶添加量分别为1.5、3.0、4.5、6.0、7.5 mg/mL,进行沙葱总黄酮的提取。如图2所示,随着纤维素酶添加量的增加,沙葱总黄酮提取量呈现逐渐升高后趋于平稳的趋势,当纤维素酶添加量为4.5 mg/mL时总黄酮提取量最高,由此来看,0.1 g沙葱粉末添加4.5 mg/mL的纤维素酶时酶与底物的添加剂量达到最佳状态,因此在后续试验中选择纤维素酶添加量为4.5 mg/mL。
2.3.2 体系pH值对沙葱总黄酮提取量的影响

图3 体系pH值对沙葱总黄酮提取量的影响Fig.3 Effect of hydrolysis pH on the extraction efficiency of total flavonoids from Allium mongolicum Regel
固定料液比1∶50(g/mL)、提取温度40 ℃、纤维素酶添加量4.5 mg/mL、提取时间2 h,调节体系pH值分别为2.4、3.4、4.4、5.4、6.4,进行沙葱总黄酮的提取。如图3所示,随着体系pH值的增加,沙葱总黄酮提取量呈现先增大后减小的趋势,当体系pH 4.4时,沙葱总黄酮提取量最大,非常显著高于其他pH值条件下总黄酮提取量(P<0.01),因此后续试验中选择体系pH值为3.4、4.4、5.4作为响应面优化的中心试验值。
2.3.3 提取温度对沙葱总黄酮提取量的影响
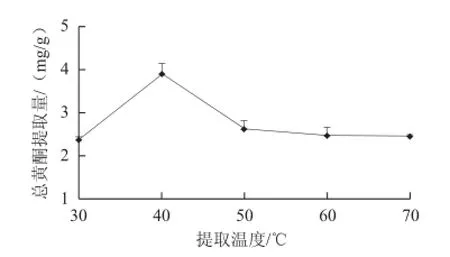
图4 提取温度对沙葱总黄酮提取量的影响Fig.4 Effect of temperature on the extraction efficiency of total flavonoids from Allium mongolicum Regel
固定料液比1∶50(g/mL)、体系pH 4.4、纤维素酶添加量4.5 mg/mL、提取时间2h,设置提取温度分别为30、40、50、60、70 ℃,进行沙葱总黄酮的提取。如图4所示,反应温度在30 ℃时的总黄酮提取量较低,同其他温度组比较差异显著(P<0.05),随着温度的升高,总黄酮提取量呈现先升高后减小的趋势,当温度为40 ℃时反应所得的沙葱总黄酮提取量最高,非常显著高于其他各组(P<0.01),温度上升至50 ℃以后总黄酮提取量变化不再明显,同时显著低于40 ℃时的总黄酮提取量,因此后续试验中选择提取温度为30、40、50 ℃为响应面优化的中心试验值。
2.3.4 提取时间对沙葱总黄酮提取量的影响

图5 提取时间对沙葱总黄酮提取量的影响Fig.5 Effect of hydrolysis time on the extraction efficiency of total flavonoids from Allium mongolicum Regel
固定料液比1∶50(g/mL)、反应体系pH 4.4、纤维素酶的添加量4.5 mg/mL、提取温度40 ℃,设置提取时间分别为1、2、3、4、5 h,进行沙葱总黄酮的提取。如图5所示,随着提取时间的延长,黄酮提取量呈现出逐渐增加的趋势,当提取时间超过3 h后,黄酮提取量变化不再明显,同1、2 h时黄酮提取量比较差异非常显著(P<0.01),因此后续试验中选择提取时间为2、3、4 h作为响应面优化的中心试验值。
2.4 响应面法优化纤维素酶酶解提取沙葱总黄酮工艺
响应面分析方案及结果见表3。以沙葱总黄酮提取量为响应值,经过回归拟合后所得各个试验因素对沙葱总黄酮提取量的回归方程为:
Y=5.38+0.29A-0.066B-0.17C-0.027AB+0.032AC+ 0.18BC-0.17A2-1.02B2-0.87C2
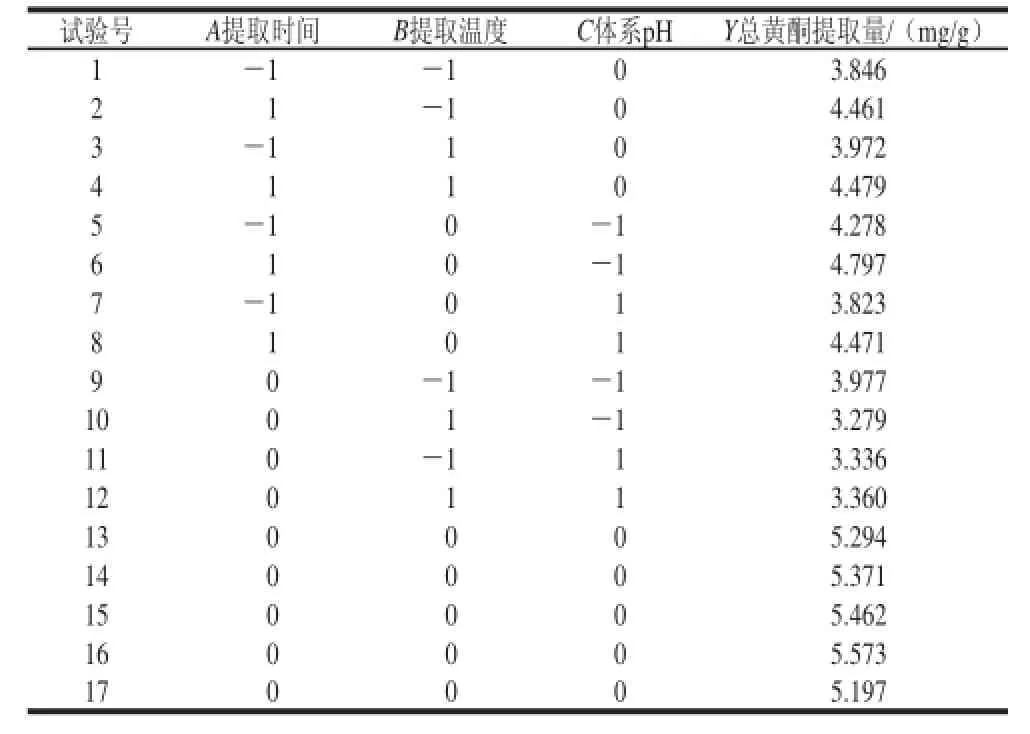
表3 沙葱总黄酮响应面分析试验设计及结果Table 3 Experimental design and results of RSM for extraction of flavonoids from Allium mongolicum Regel
对回归模型的方差分析结果见表4,该模型回归显著(P<0.001),表明自变量与响应值之间的模型关系显著;失拟项(P=0.361 6)不显著,说明回归方程与实际情况拟合良好;并且该模型决定系数R2=0.981 6,证明该模型能够解释98.16%的响应值变化,可以用此模型来分析和预测纤维素酶酶解提取沙葱总黄酮的提取量。F值可以反映出各因素对试验指标影响的重要性,由F值得到的因素贡献率为:A>C>B,即提取时间>体系pH值>提取温度。对模型各项进行方差分析可知,模型中一次项A(提取时间)、交互项B2、C2对沙葱总黄酮提取量的影响为非常显著(P<0.01),一次项C(体系pH值)对沙葱总黄酮提取量的影响为显著(P<0.05),一次项B(提取温度)、交互项AB、AC、BC、A2对沙葱总黄酮提取量的影响不显著(P>0.05),无统计学意义。
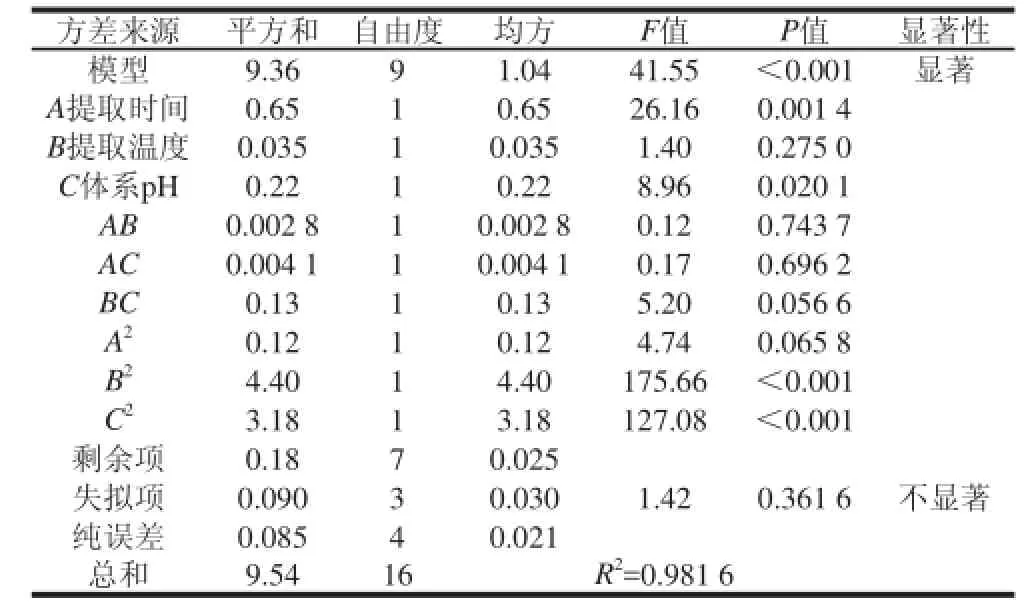
表4 回归模型方程的方差分析Table 4 Analysis of variance for the fitted regression model
为进一步考察提取温度、提取时间以及体系pH值对沙葱总黄酮提取量的交互作用,对其等高线图和响应面图进行分析,结果如图6~8所示。
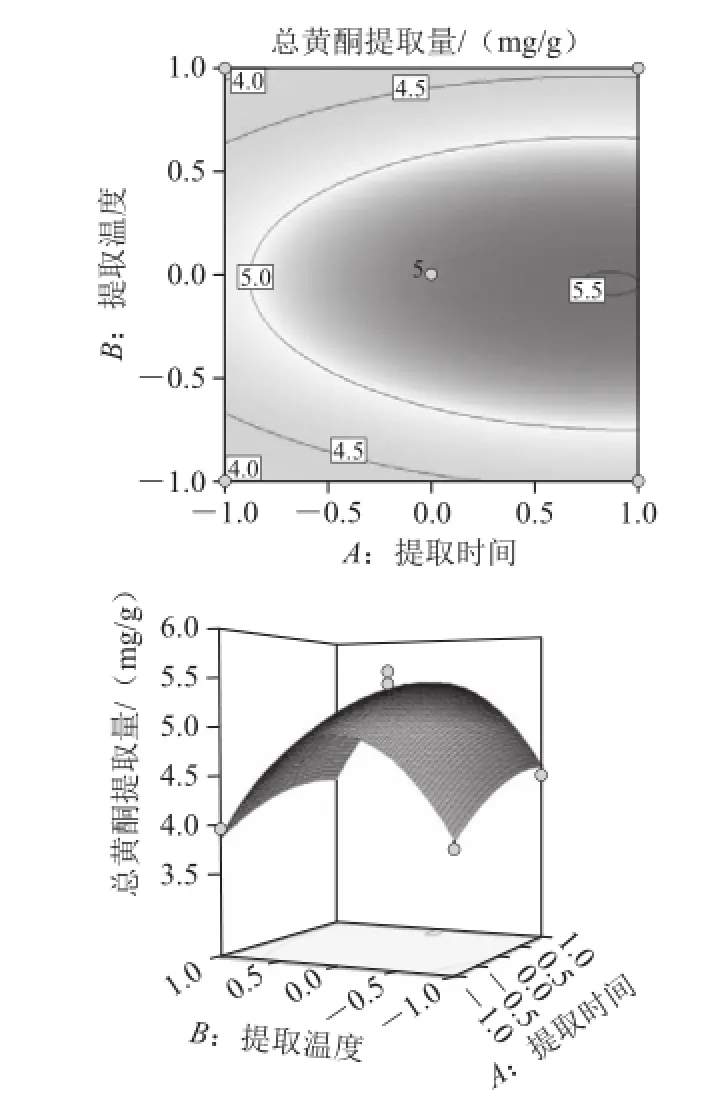
图6 提取温度和提取时间对总黄酮提取量的影响Fig.6 Response surface and contour plots for the effect of temperature and hydrolysis time on the extraction efficiency of total flavonoids from Allium mongolicum Regel
由图6可知,当固定体系pH值为4.4时,随着提取时间的延长,沙葱总黄酮提取量逐渐增加,达到3 h之后上升趋势趋于平稳;随着提取温度的逐渐升高沙葱总黄酮提取量呈现先上升后下降的趋势,在40 ℃左右沙葱总黄酮提取量达到最大值。
图7为固定提取温度为40 ℃时,体系pH值与提取时间对沙葱总黄酮提取量的影响。由图7可知,随着提取时间的延长,沙葱总黄酮提取量有逐渐增加的趋势,达到3 h后此上升趋势趋于平稳。随着体系pH值的增加沙葱总黄酮提取量有增加的趋势,在pH 4.4时沙葱总黄酮提取量达到最大值,此后随着pH值继续增加沙葱总黄酮提取量逐渐下降。
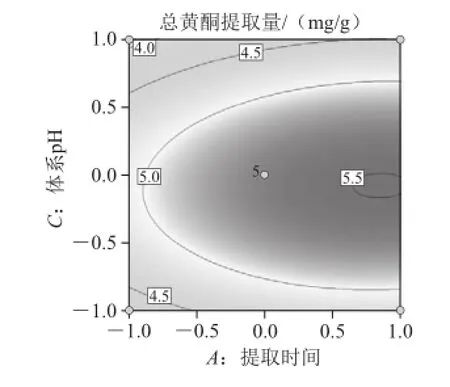
图7 体系pH值和提取时间对总黄酮提取量的影响Fig.7 Response surface and contour plots for the effect of hydrolysispH and time on the extraction efficiency of total flavonoids from Allium mongolicum Regel

图8 体系pH值和提取温度对总黄酮提取量的影响Fig.8 Response surface and contour plots for the effect of temperature and hydrolysis pH on the extraction efficiency of flavonoids total flavonoids from Allium mongolicum Regel
图8 表明,固定提取时间为3 h,随着提取温度的逐渐升高沙葱总黄酮提取量呈现先上升后下降的趋势,提取温度达到40 ℃时沙葱总黄酮提取量达到最高值,之后开始逐渐下降。随着体系pH值的增加沙葱总黄酮提取量有增加的趋势,在pH 4.4左右沙葱总黄酮提取量达到最大值,此后随着pH值继续增加沙葱总黄酮提取量有下降的趋势。
通过数据分析得到纤维素酶辅助提取沙葱总黄酮的理论最佳工艺参数为提取时间4 h、提取温度39.49 ℃、体系pH 4.3,此条件下预测沙葱总黄酮最大提取量为5.51 mg/g。
2.5 最佳提取工艺参数的验证
实际应用中对纤维素酶辅助提取沙葱总黄酮的最佳工艺参数进行适当的调整,取提取温度为39 ℃,之后对同一批沙葱粉末进行验证实验(n=5)。调整后沙葱总黄酮提取量为(5.48±0.02)mg/g,接近于理论提取量5.51 mg/g,说明该提取工艺可操作性强,结果稳定可靠2.6 沙葱总黄酮体外抗氧化活性
2.6.1 沙葱总黄酮总还原能力

图9 沙葱总黄酮总还原能力Fig.9 Total reducing capacity of total flavonoids from Allium mongolicum Regel
由图9可知,随着沙葱总黄酮质量浓度的增加,沙葱总黄酮的总还原能力呈逐渐增加趋势,但相同质量浓度条件下,沙葱总黄酮的总还原能力均显著低于BHT对照组(P<0.01)。
2.6.2 沙葱总黄酮体外DPPH自由基清除率
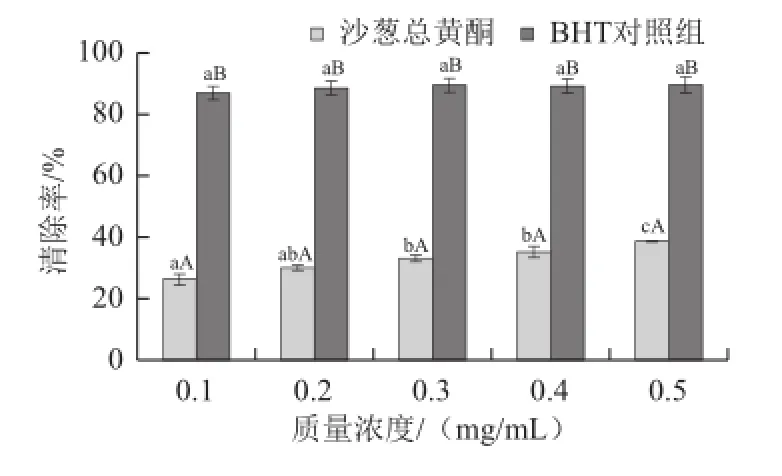
图10 沙葱总黄酮对DPPH自由基的清除率Fig.10 Scavenging ability against DPPH radicals of total flavonoids from Allium mongolicum Regel
利用DPPH溶液的特征吸收峰,用酶标仪测定加入沙葱总黄酮后DPPH溶液在525 nm波长处的吸光度,吸光度的下降程度表示其对DPPH自由基的清除能力[14]。如图10所示,沙葱总黄酮体外对DPPH自由基的清除能力随着质量浓度的升高而逐渐增大,但相同质量浓度条件下沙葱总黄酮对DPPH自由基的清除能力同BHT对照组比较降低程度非常显著(P<0.01)。
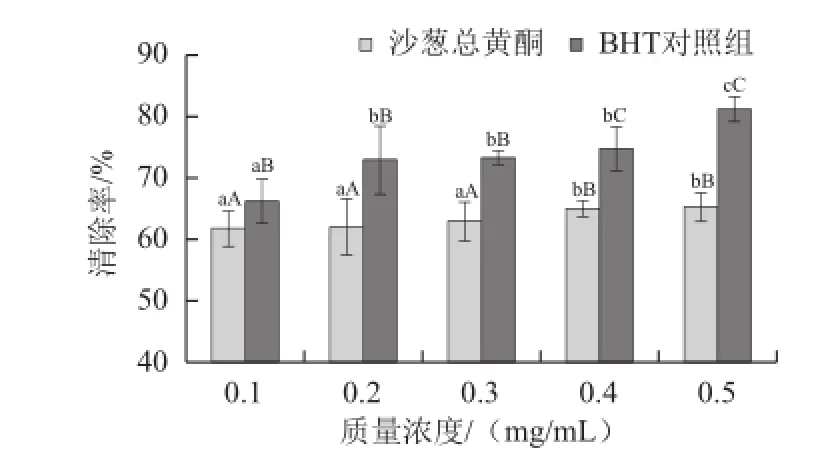
图11 沙葱总黄酮对羟自由基的清除率Fig.11 Scavenging ability against hydroxyl radicals of total flavonoids from Allium mongolicum Regel
2.6.3 沙葱总黄酮体外清除羟自由基能力由图11可以看出,不同质量浓度的沙葱总黄酮对羟自由基的清除率均大于60%,且随着沙葱总黄酮质量浓度的增加,其对羟自由基的清除率有增加的趋势,但差异不显著(P>0.05),在相同剂量条件下,沙葱总黄酮对羟自由基的清除能力均低于BHT对照组,且差异非常显著(P<0.01)。
2.7 沙葱总黄酮体外抑菌活性
2.7.1 沙葱总黄酮抑菌圈直径与MIC

表5 沙葱总黄酮抑菌圈直径以及MICTable 5 Antibacterial activity of total flavonoids from Allium mongolicum Regel in vitro
抑菌圈直径的大小可表示其抑菌能力的强弱,直径越大抑菌能力越强。由表5可知,当添加的沙葱总黄酮质量浓度为10 mg/mL时对沙门氏菌的抑制能力比大肠杆菌、金黄色葡萄球菌强,抑菌圈直径为9.5 mm,属于低度敏感,对大肠杆菌和金黄色葡萄球菌的抑制能力均属于不敏感,对绿脓杆菌无抑制作用。本实验还就沙葱总黄酮对各供试菌种的MIC进行了测定,结果显示,沙葱总黄酮体外对大肠杆菌和金黄色葡萄球菌的MIC均为5 mg/mL,对沙门氏菌的MIC为2.5 mg/mL。
2.7.2 沙葱总黄酮抑菌率
使用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐法测定沙葱总黄酮体外对大肠杆菌、绿脓杆菌、金黄色葡萄球菌以及沙门氏菌的抑制率,如图12所示,将细菌数定值在1×104个/mL时,随着沙葱总黄酮质量浓度的升高,其对大肠杆菌、金黄色葡萄球菌、沙门氏菌的抑制作用均呈现上升的趋势,相同质量浓度条件下对沙门氏伤寒菌的抑制作用均强于其他3种菌,且差异非常显著(P<0.01)。低质量浓度(12.5、25 μg/mL)时沙葱总黄酮对金黄色葡萄球菌的抑制作用强于对大肠杆菌的抑制作用,差异显著(P<0.01),质量浓度为50 μg/mL时沙葱总黄酮对大肠杆菌和金黄色葡萄球菌的抑制作用接近,质量浓度为100 μg/mL时沙葱总黄酮对大肠杆菌的抑制作用强于对金黄色葡萄球菌的抑制作用,差异非常显著(P<0.01),各质量浓度沙葱总黄酮对绿脓杆菌均无显著抑制作用。
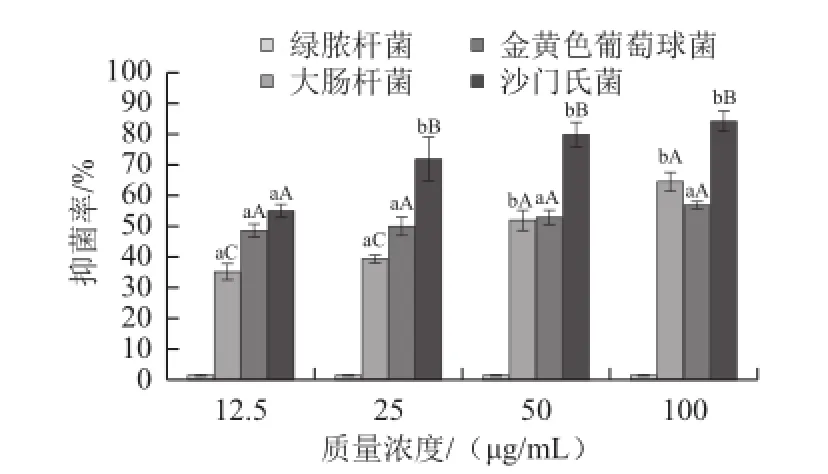
图12 沙葱总黄酮体外抑菌作用Fig.12 Growth inhibitory effect of total flavonoids from Allium mongolicum Regel in vitro against four bacteria
3 讨 论
3.1 酶解法提取沙葱黄酮工艺
纤维素酶酶解法是目前广泛用于植物有效成分提取工艺的一种方法。其反应原理是纤维素酶作为辅助提取剂,可直接使植物细胞壁酶解,导致植物细胞内部有效成分直接暴露到提取介质中,从而得到植物有效活性成分[18]。纤维素酶酶解提取方法虽然对反应条件要求较高,但也因其反应条件温和,除去对细胞壁进行直接的酶解以外对其内部其他部位无任何损伤,所以能够完好地保护植物有效成分在植物体内的生化结构,保证提取所得产物天然生物活性的完好。研究[19-21]表明用此方法可提取获得含量较高且生物活性完整的天然植物活性成分。除此之外结合响应面分析方法对其提取工艺进行优化,较传统的正交试验所得提取工艺参数更准确,且能够更加全面地反应各个单因素对提取量的影响效果。许多学者均使用响应面法优化植物有效成分的提取工艺得到了较为准确的工艺参数[13-16],如侯学敏等[14]利用响应面法优化薄荷叶总黄酮提取工艺的同时得到了抗氧化活性较好的黄酮提取物。因此本实验中选用纤维素酶对沙葱植物细胞壁进行破碎,并用响应面法优化确定沙葱总黄酮的提取工艺参数为在1.0 g沙葱粉中加入4.5 mg/mL纤维素酶,39 ℃条件下保持pH值为4.3提取4 h,提取量可达到5.48 mg/g,与赵春艳[8]报道3.6 mg/g相比较总黄酮提取量显著提高。原因可能是因为黄酮类化合物的提取量与植物种类以及提取方法、检测手法等密切相关,本实验中所用原料为新鲜沙葱脱脂粉末后经过生物酶破壁,使包裹在植物细胞内的黄酮类物质得到完全的释放从而有效地提高了沙葱黄酮提取量,与此同时使用响应面法进行提取工艺的优化,在单因素试验的基础上更加全面的进行分析与组合,从而确定了提取量较高的提取工艺。
3.2 沙葱黄酮体外抗氧化活性
自由基是机体组织细胞正常生理代谢过程中产生的一种含有一个不成对电子的原子团。适量的自由基在机体中会起到免疫信号传导的作用,但自由基的量超过其最佳阈值后会给机体带来许多不良反应,可导致细胞、蛋白以及核酸的氧化损伤。如若不能及时有效地控制自由基的浓度,清除机体内自由基,则会使机体氧化应激机制启动,严重者导致各个系统的生理功能紊乱、癌变等。许多研究证明导致人类癌症、糖尿病、老年痴呆以及帕金森等疾病以及衰老死亡生理过程的罪魁祸首就是活性氧自由基[22-23]。而黄酮类化合物具有较强的抗氧化清除有机自由基的能力,这与其特殊的结构有一定关系。黄酮类物质的结构中具有多酚羟基以及C2、C3之间的双键和C4酮羰基等结构,这些结构均具有较好的供氢和供电子能力,将氢或电子供给机体内产生的自由基后显著降低自动氧化链反应的速率,从而有效清除有机自由基,抑制机体氧化反应。本实验证明使用纤维素酶辅助提取所得的沙葱总黄酮具有较强的体外抗氧化活性与陈明珠[24]、石青浩[25]等研究报道一致。
3.3 沙葱黄酮抗菌活性
黄酮类化合物的结构属于酚类衍生物,而酚类物质可以使生物细胞壁及细胞膜破碎,细胞内容物扩散、细胞膜通透性改变、细胞内外物质与信息的传递失衡而起到抑制微生物生长的作用[26]。因此研究者预测黄酮类物质也具有类似的抑制微生物生长的抗菌作用,研究表明黄酮类物质对革兰氏阳性菌和革兰氏阴性菌以及霉菌、真菌等具有一定的抑制作用[27-29]。但其抑菌作用与黄酮类物质分子结构中有无电荷密度较高的部位有关,与其整个分子结构中电荷分布有关[22]。本实验研究发现酶解法提取的沙葱总黄酮对大肠杆菌、绿脓杆菌、金黄色葡萄球菌和沙门氏菌均有一定的抑制作用,其中对沙门氏伤寒菌的抑制作用最强,与张生潭[30]、王文[31]等研究结果一致。
4 结 论
本研究经过单因素试验确定对纤维素酶辅助提取沙葱总黄酮影响较重要的3个因素为提取时间、提取温度和体系pH值,在此基础上,采用响应面法优化纤维素酶辅助提取沙葱总黄酮最佳工艺参数,结合实际情况,将工艺参数调整为提取时间4 h、提取温度39 ℃、体系pH 4.3,在此条件下沙葱总黄酮的提取量为5.48 mg/g,接近理论最佳提取工艺提取量5.51 mg/g,显著高于赵春艳[8]研究报道所得沙葱总黄酮提取量,所得产物与其所得沙葱黄酮产物结构相同[12],且此法操作简单,结果可靠,可以用于沙葱总黄酮的制备。此外本研究还发现沙葱总黄酮具有一定的体外抗氧化活性,对沙门氏菌的抑制作用较强,对大肠杆菌和金黄色葡萄球菌的抑制作用较弱,对绿脓杆菌无抑制作用。
[1] 敖长金. 沙葱化学成分及其生物学功能研究进展[J]. 饲料工业, 2010(18): 5-9.
[2] 巴俊杰, 张春丽, 高建萍, 等. 沙葱营养成分分析[J]. 内蒙古农业大学学报, 2002, 23(4): 114-115.
[3] 萨茹丽, 杨斌, 敖长金. 沙葱有效提取物对肉仔鸡免疫机能影响的研究[J]. 饲料工业, 2009, 30(10): 28-41.
[4] 宋巴达玛. 沙葱多糖对肉羊免疫机能和抗氧化作用的影响[D]. 呼和浩特: 内蒙古农业大学, 2010: 5-7.
[5] 乌仁张嘎. 沙葱挥发油的提取, 成分鉴定及其体外抑菌效果的研究[D]. 呼和浩特: 内蒙古农业大学, 2011: 18-20.
[6] 扈瑞平. 沙葱多糖的分离、纯化和结构鉴定及其生物学活性的研究[D]. 呼和浩特: 内蒙古农业大学, 2010: 4-5.
[7] 赵丽华. 沙葱和油料籽实对羊肉理化指标及食用品质的影响[D]. 呼和浩特: 内蒙古农业大学, 2005: 3-4.
[8] 赵春艳. 沙葱中黄酮类化合物的分离纯化、结构鉴定及其对小鼠免疫及免疫抗氧化机能影响的研究[D]. 呼和浩特: 内蒙古农业大学, 2008: 10-28.
[9] 缪亚娟. 沙葱异黄酮含量测定及其对机体抗氧化与非特异性免疫影响的研究[D]. 呼和浩特: 内蒙古农业大学, 2009: 5-6.
[10] 哈斯额尔敦, 敖长金, 张巧娥, 等. 沙葱水溶性提取物对绵羊瘤胃发酵功能(体外)的影响[J]. 内蒙古农业大学学报: 自然科学版, 2007, 28(11): 114-116.
[11] 王丽思, 敖长金, 张兴夫. 沙葱多糖对小鼠腹腔巨噬细胞的激活作用[J]. 中国畜牧兽医, 2010, 37(4): 50-52.
[12] 萨茹丽. 沙葱黄酮提取工艺优化、结构鉴定及其相关生物活性研究[D]. 呼和浩特: 内蒙古农业大学, 2014: 18-23.
[13] 扶庆权, 侯佩, 陈能. 响应面法优化芦蒿叶总黄酮的提取工艺[J]. 食品科学, 2013, 34(4): 94-98.
[14] 侯学敏, 李林霞, 张直峰, 等. 响应面法优化薄荷叶总黄酮提取工艺及抗氧化活性[J]. 食品科学, 2013, 34(6): 124-128.
[15] 吕长鑫, 李萌萌, 徐晓明, 等. 响应面分析法优化纤维素酶提取紫苏多糖工艺[J]. 食品科学, 2013, 34(2): 6-10.
[16] 董旭, 杜先锋. 响应面法优化纤维素酶提取山核桃蒲多酚类物质[J].食品科学, 2013, 34(4): 109-113.
[17] 许颖, 李德超, 孙剑. 金银花醇提液对根管粪肠球菌生物膜作用体外研究[J]. 黑龙江医药科学, 2010, 33(6): 49-50.
[18] 杨晓凤. 酶法提取老鹰茶中黄酮类化合物[J]. 西南农业学报, 2011, 24(6): 2368-2371.
[19] 公衍玲, 金宏, 黄山, 等. 酶法提取荆芥总黄酮的研究[J]. 中国林副特产, 2011(4): 13-16.
[20] 徐清萍, 安广杰, 常法玲, 等. 酶法提取怀菊花总黄酮工艺研究[J].郑州轻工业学院学报: 自然科学版, 2010, 25(5): 31-35.
[21] BOULANOUAR B, ABDELAZIZ G, AZZA S, et al. Antioxidant activities of eight Algerian plant extracts and two essential oils[J]. Industrial Crops and Products, 2013, 46(4): 85-96.
[22] 唐浩国. 黄酮类化合物研究[M]. 北京: 科学出版社, 2009: 23-274.
[23] 闫琳娜. 松针落叶总黄酮的提取、纯化及抗氧化性能分析[D]. 长春: 吉林大学, 2009: 5-12.
[24] 陈明珠, 申艳艳, 赵越, 等. 槐角黄酮的体外抗氧化活性研究[J]. 食品工业科技, 2013, 34(4): 94-96.
[25] 石青浩, 李荣, 姜子涛. 食用鼠曲草黄酮的提取及体外抗氧化性研究[J]. 食品与生物技术学报, 2013, 32(3): 307-312.
[26] GOULD G W. New methods of food preservation[M]. New York: Aspen Publisher, 1999: 79-83.
[27] 刘平, 陈光辉, 邓淑华, 等. 金莲花总黄酮抗菌作用的实验研究[J].中国实验方剂学杂志, 2013, 19(6): 207-209.
[28] 陈晓伟, 韦媛媛, 周吴平, 等. 一点红总黄酮分离及抗菌研究[J]. 食品科技, 2009, 34(1): 163-165.
[29] 邵明昱. 葫芦巴种子总黄酮提取分离、抑菌及抗氧化活性的研究[D].乌鲁木齐: 新疆农业大学, 2012: 3-12.
[30] 张生潭, 王兆玉, 兰新宇, 等. 响应面法优化麻疯树叶总黄酮提取工艺及其抗菌活性研究[J]. 中药材, 2013, 6(2): 308-311.
[31] 王文, 陶蕾, 赵强, 等. 唐古特白刺中黄酮类化合物正交提取工艺与体外抗菌活性研究[J]. 中兽医医药杂志, 2011(6): 5-8.
Total Flavonoids from Allium mongolicum Regel: Optimization of Extraction Process and Antioxidant and Antibacterial Effects in vitro
SA Ru-li1, MU Qi-er1, WANG Cui-fang1, BAO Ling-ling1, AO Chang-jin1,*, WANG Si-zhen2
(1. College of Animal Science, Inner Mongolia Agricultural University, Hohhot 010018, China; 2. College of Animal Science and Technology, Inner Mongolia University for the Nationalities, Tongliao 028000, China)
This report describes the selection and optimization of experimental conditions for cellulase-assisted extraction of total flavonoids from Allium mongolicum Regel using a combination of single factor experiment and response surface methodology. It was demonstrated that the optimal extraction parameters were determined to be hydrolysis at 39 ℃ for 4 h with an initial solvent pH of 4.3, leading to an extraction yield of 5.48 mg/g. Further this study found that the extracted flavonoids had good total reduction capability and scavenging activities against DPPH and hydroxyl radicals, and exhibited strong inhibition against Salmonella. However, the inhibitory effect against E. coli and Staphylococcus aureus was weak, and no inhibition against Pseudomonas aeruginosa was observed.
Allium mongolicum Regel; flavonoids; response surface methodology; antioxidant activity in vitro; antibacterial activity in vitro
S816.9
A
1002-6630(2014)24-0001-08
10.7506/spkx1002-6630-201424001
2014-04-29
国家自然科学基金地区科学基金项目(31260558;31160474);“十二五”国家科技支撑计划项目(2013BAD10B04)
萨茹丽(1986—),女,博士研究生,研究方向为动物营养与畜产品品质。E-mail:qisaruli@126.com
*通信作者:敖长金(1962—),男,教授,博士,研究方向为动物营养与畜产品品质。E-mail:changjinao@aliyun.com

